免疫检查点抑制剂(ICIs)改变了转移性黑色素瘤的治疗格局,其中,PD-1 抑制剂单药或联合抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、抗淋巴细胞激活基因3(LAG-3)抑制剂已成为晚期黑色素瘤的一线标准方案1,2,但最佳治疗序贯策略仍缺乏高级别证据支撑。尤其是新型联合方案瑞拉利单抗+纳武利尤单抗(rela/nivo)在治疗中的定位,一直是临床决策的难点。近期发表于《Journal for ImmunoTherapy of Cancer》的国际多中心真实世界研究,纳入190例不可切除/转移性黑色素瘤患者,比较了三种含rela/nivo的免疫序贯方案的疗效与安全性2,不仅证实了rela/nivo 后线应用(继 ipi/nivo 或抗 PD-1 单药后)的生存获益显著优于前线使用,同时还揭示了原发性/继发性耐药对后续治疗应答的影响,为个体化序贯策略制定提供了关键依据。
研究将患者分为三个治疗组:A 组(n=40)为 rela/nivo治疗进展后序贯伊匹木单抗+纳武利尤单抗(ipi/nivo),B 组(n=71)为 ipi/nivo 进展后序贯 rela/nivo;C 组(n=79)为抗PD-1单药(含辅助治疗)进展后序贯 rela/nivo。
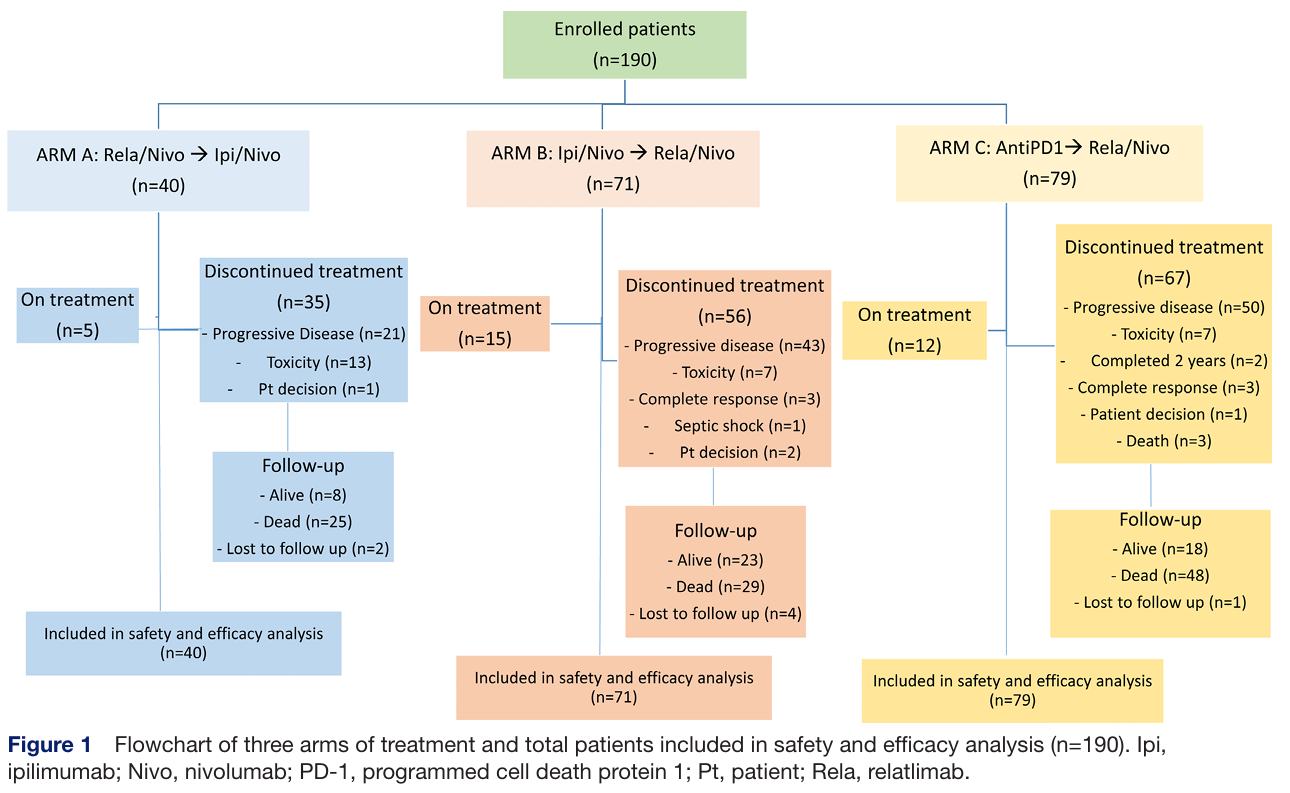
图1. 治疗分组流程图及纳入安全性与疗效分析的所有患者(n=190)
Ipi:伊匹木单抗;Nivo:纳武利尤单抗;PD-1:程序性死亡蛋白1;Pt:患者;Rela:瑞拉利单抗基线特征显示,C 组患者预后因素更优,IV期M1c-d 比例、LDH 升高比例及≥3个转移灶比例均低于A、B组;而 B 组患者基线肿瘤负荷更高,脑转移(26.8%)和≥3 个转移灶(54.9%)比例显著高于 A、C 组 。与此同时,不同治疗组的治疗暴露时长同样差异明显:一线治疗阶段,抗 PD-1 单药(C组)中位治疗时长最长,为7.0 个月;ipi/nivo(B组)最短,仅为2.5 个月;二线治疗阶段,rela/nivo 在 B、C 组的中位治疗持续时间(3.1 个月、3.9 个月)明显长于 A 组的ipi/nivo(1.4 个月)。此外,A 组和 C 组原发性耐药比例(60.0%、65.6%)高于 B 组(39.4%),B 组患者既往治疗线数更多,体现了真实世界中患者群体的异质性。
rela/nivo后线应用的二线治疗
应答率显著优于前线使用
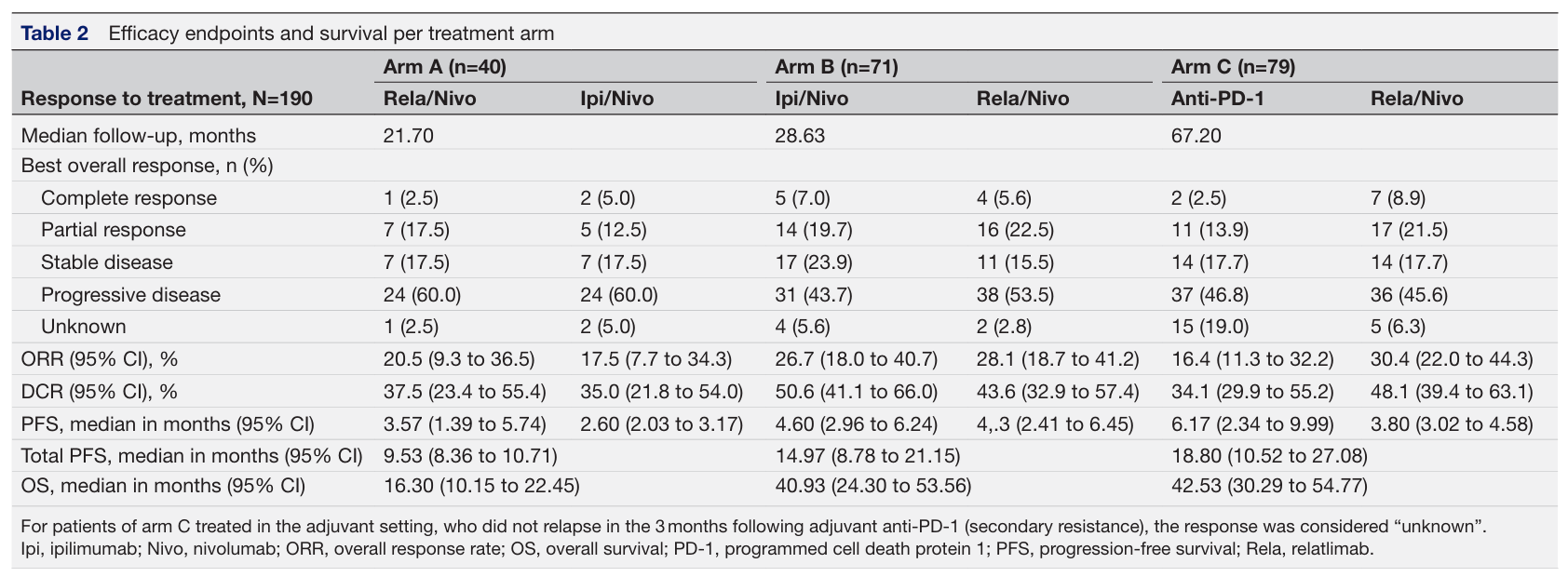
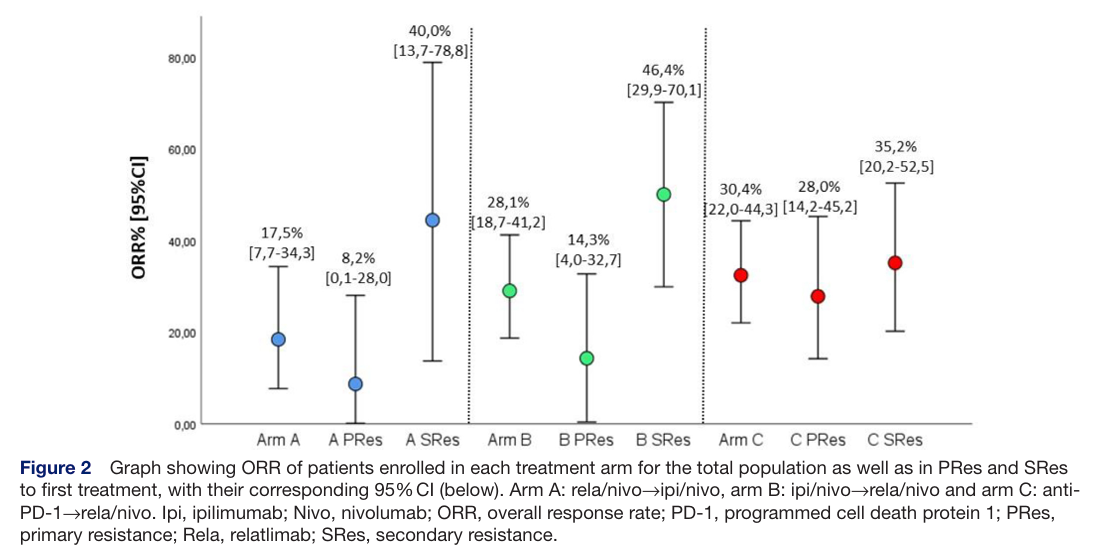
研究主要终点为二线治疗的客观缓解率(ORR),结果显示C组ORR最高为30.4%(95% CI 22.0%-44.3%),其次为B组(28.1%,95% CI 18.7%-41.2%),A组最低(17.5%,95% CI 7.7%-34.3%)。疾病控制超过6个月的患者比例同样呈现相似趋势,C 组为41.9%、B 组为39.1%,均高于 A 组的28.9%。与此同时,研究还发现,耐药类型对二线应答的影响存在显著的组间特异性:B 组患者中,对一线治疗存在继发性耐药的患者二线 ORR(46.4%)显著高于原发性耐药患者(14.3%,p=0.026);A 组中也呈现类似趋势(继发性耐药 ORR 40% vs 原发性耐药 8.2%,p=0.08);而 C 组中,抗PD-1 单药原发性与继发性耐药患者对 rela/nivo 的应答率无显著影响(28.0% vs 35.2%)。值得注意的是,C 组中辅助治疗阶段接受抗 PD-1 的患者,二线 rela/nivo 的 ORR(52.6%)显著高于转移性阶段开始抗PD-1治疗的患者(23.3%,p=0.029)。图2. 各治疗组患者的客观缓解率(ORR)
涵盖总体人群以及首次治疗中呈原发耐药(PRes)和继发耐药(SRes)的亚组,ORR下展示了相应的95%置信区间在三组治疗方案的生存分析中,Kaplan-Meier曲线及Log-rank检验结果均显示序贯治疗顺序对患者长期预后具有显著影响。具体来看,A组中位总生存期(OS)仅为16.3个月(95% CI:10.2–22.5),显著低于B组(40.9个月,95% CI:24.3–53.6)及C组(42.5个月,95% CI:30.3–54.8);同时2年OS率也仅为35%,而B组与C组分别达到64%和68%,差异具有统计学意义(p=0.004与p=0.001)。类似趋势同样体现在后续治疗反应中位二线无进展生存期(PFS2)上,A组仅为2.6个月,而B组和C组分别为4.4个月和3.8个月。2年PFS2率方面,A组仅6%,而B组与C组分别达到25%与22%,进一步证实rela/nivo作为后线序贯策略能够显著改善患者生存获益。图3. 不同治疗组的OS和tPFS(上方)以及PFS1和PFS2(下方)的Kaplan-Meier生存曲线
Log-rank检验显示,A组与B组之间在OS(p=0.004)、tPFS(p=0.008)和PFS2(p=0.004)方面存在统计学显著差异;A组与C组之间在OS(p=0.001)、tPFS(p=0.001)和PFS2(p=0.002)方面也存在统计学显著差异整体分析表明,在抗PD-1治疗失败后,选择rela/nivo作为后续序贯方案可显著改善生存结局,而反向序贯策略效果有限,提示免疫治疗序贯路径的优化对延长患者长期获益具有重要临床意义。拓展阅读:
此前,RELATIVITY-020 I/IIa期试验显示,晚期黑色素瘤患者在抗PD-1治疗进展后序贯使用rela/nivo的ORR仅为9%–12%3;而另一项单中心真实世界研究报道的ORR可达33%4。本研究中rela/nivo的ORR为30.4%,与后者结果较为一致,差异可能与患者基线特征及既往治疗线数不同有关。针对ipi/nivo进展后序贯使用rela/nivo的研究相对较少,本研究显示该策略的ORR为28.1%,中位OS达40.9个月,提示即使在高肿瘤负荷患者中,该方案仍具有一定的临床价值。
此外,关于免疫序贯治疗的耐药机制,既往研究表明联合治疗进展与单药治疗进展可能涉及不同的耐药途径。这一机制差异也有助于解释本研究中C组原发耐药患者仍能从rela/nivo获益,而B组继发耐药患者应答更佳的现象。本研究基于国际多中心真实世界数据,系统揭示了含rela/nivo的免疫序贯治疗策略在疗效上的差异。核心结论显示,rela/nivo作为后线治疗(尤其在ipi/nivo或抗PD-1治疗进展后)可显著延长生存并提升客观缓解率,相较于前线使用rela/nivo后再序贯ipi/nivo的策略效果更优。同时,研究结果表明,一线治疗中的耐药类型可为二线方案选择提供参考。在临床实践中,可优先推荐ipi/nivo或抗PD-1单药作为一线治疗方案,rela/nivo作为二线治疗;对于辅助治疗阶段出现抗PD-1耐药的患者,rela/nivo应作为首选二线方案;而在rela/nivo前线治疗失败后,ipi/nivo虽仍可产生一定应答,但需关注毒性导致的治疗中断风险。当然,未来仍然需要继续开展前瞻性随机试验进一步验证序贯策略的最佳方案,同时探索ctDNA等生物标志物,实现更加精准的治疗分层,以进一步提升转移性黑色素瘤患者的长期生存获益。参考文献
1.Robert C, et al. N Engl J Med, 2015, 372: 320-330.
2.Guardamagna M, et al. J Immunother Cancer. 2025;13(11):e012225.
3.Ascierto PA, et al. J Clin Oncol. 2023;41(15):2724-2735.
4.Jang S, et al. JCO, 2023, 41: e21533.
 歆语健康发布于 3天前
歆语健康发布于 3天前 收藏专家
收藏专家