前列腺癌是男性常见的恶性肿瘤之一,尤其在高/极高危局部晚期和转移性人群中,如何优化治疗策略、提升根治机会并延长生存,始终是临床关注的核心问题。近年来,新型雄激素受体通路抑制剂(ARPI)如达罗他胺不断拓展其临床应用场景。在ESMO 2025大会上,多项围绕达罗他胺的研究成果集中亮相,涵盖新辅助治疗、联合靶向探索及真实世界疗效评估等多个维度。这些数据不仅进一步夯实了其在非转移性去势抵抗性前列腺癌(nmCRPC)中的地位,更揭示其在高危局部晚期患者中的病理降期作用,并探索了其与PI3K/AKT/mTOR通路抑制剂联用的潜力。本文基于大会摘要,系统梳理达罗他胺的前沿进展,为临床决策提供权威参考。
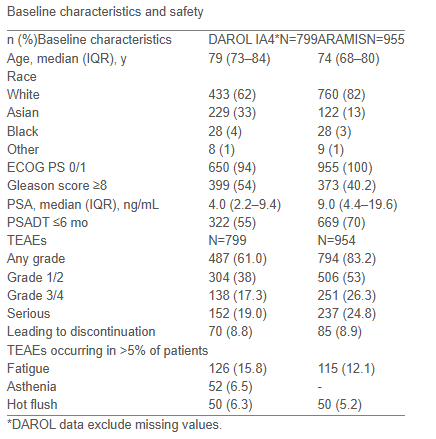
一项在中国开展的多中心、开放标签、单臂II期研究1评估了达罗他胺联合雄激素剥夺治疗(ADT)作为新辅助方案用于高/极高危局部晚期前列腺癌患者的疗效与安全性。该研究纳入53例符合NCCN指南定义的高危或极高危局限性前列腺癌患者,均未接受过新型激素治疗(NHT),且适合行根治性前列腺切除术(RP)。所有患者接受达罗他胺(600mg bid口服)联合ADT治疗最长6个月,随后进行手术。主要终点为降期率,次要终点包括病理完全缓解(pCR)或微小残留病灶(MRD)、阳性手术切缘率(PSM)、生化完全缓解率(bCR,PSA <0.1 ng/ml)及安全性。初步结果显示,在已完成病理评估的35例患者中,降期率达到62.86%(22/35),仅1例出现阳性切缘;在完成新辅助治疗的50例患者中,bCR率为68%(34/50)。治疗总体耐受良好,未见与达罗他胺相关的术中并发症,仅7.5%患者出现3级肝功能异常,最常见1-2级不良反应为潮热和肝功能异常。研究结论指出,长达六个月的达罗他胺联合ADT新辅助治疗在高/极高危前列腺癌患者中具有良好的有效性和安全性,有望成为术前治疗的新选择。基础研究表明,雄激素受体(AR)信号通路与PI3K-AKT-mTOR(PAM)通路之间存在相互负反馈调节机制,任一通路的抑制可导致另一通路的交叉激活,这可能是ARPI治疗耐药的重要机制之一。此外,升高的雄激素水平可上调PAM通路活性,其致癌性激活与前列腺癌对ADT的耐药、疾病进展及不良预后相关。因此,联合使用PAM通路抑制剂与ARPI可能在mCRPC患者中产生协同抗肿瘤效应,尤其适用于既往ARPI治疗后进展的患者。目前正在进行的一项I/II期临床试验2正在探索pan-PI3K/mTORC1/2抑制剂gedatolisib联合达罗他胺的安全性与初步疗效。I期部分采用间歇给药方案(每28天周期的第1、8、15天静脉注射gedatolisib,剂量分别为120 mg和180 mg),同时每日口服达罗他胺600 mg。截至目前,两种剂量组合的安全性均可管理,未观察到剂量限制性毒性或4/5级治疗相关不良事件。尽管尚未公布具体的疗效数据,但初步安全性结果支持该联合方案的进一步探索。这一策略为克服AR通路抑制剂耐药提供了新的临床路径,也为mCRPC后线治疗带来了新希望。尽管III期ARAMIS研究3已证实达罗他胺在nmCRPC患者中可显著延长无转移生存期(MFS)和总生存期(OS),但由于随访时间相对较短,早期ESMO-MCBS评分系统因缺乏中位OS数据而给予其较低评分。为此,一项分析旨在通过模型估算ARAMIS研究两组的中位OS,并与SPARTAN和PROSPER等其他ARPI研究进行比较。另一项真实世界研究DAROL(NCT04122976)4则前瞻性地收集了799例nmCRPC患者使用达罗他胺的临床结局。第四次预设中期分析显示,在近2年中位随访时间内,达罗他胺展现出与ARAMIS研究一致的良好有效性和安全性特征。综合分析还表明,达罗他胺联合ADT的OS结果与其他ARPI(如阿帕他胺)相当,且优于恩扎卢胺联合ADT3。这提示达罗他胺在真实世界中同样能为nmCRPC患者带来显著的生存获益,进一步支持其在临床实践中的广泛应用。图1: DAROL研究和ARAMIS研究的基线特征和安全性拓展阅读
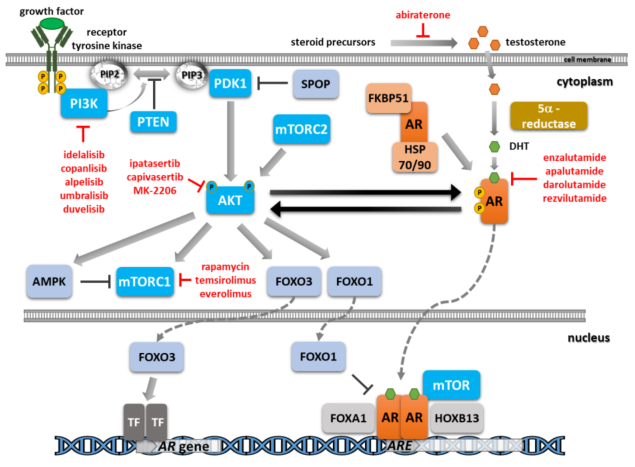
随着ARPI在前列腺癌治疗中的广泛应用,肿瘤在分子水平的适应性调节成为新的关注焦点。一项综述5通过文献整合及信号网络分析发现,前列腺癌细胞可在早期即表现出对单一通路阻断的补偿性反应,其中AR与PI3K/AKT/mTOR(PAM)为两条核心驱动轴。实验数据表明,当AR信号受抑时,PAM通路可被交叉激活以维持细胞增殖;反之抑制PAM通路又可增强AR活性,形成双向反馈调控。该研究提示,仅抑制AR通路可能不足以实现深度抗肿瘤效应,而联合靶向两条通路更可能阻断肿瘤适应性逃逸。该机制结果为包括达罗他胺在内的ARPI联合PAM通路抑制策略提供理论基础,并支持其向新辅助及早期干预阶段延伸。图2:AR和PI3K/AKT/mTOR信号通路及其相互作用的示意图
ESMO 2025公布的多项研究标志着达罗他胺的应用正从传统的nmCRPC向更广泛的临床场景延伸。新辅助治疗的积极数据为其在局部晚期前列腺癌中的应用打开了大门,若最终病理结果确认pCR率提升,或将改变当前以单纯ADT或化疗为主的术前治疗模式。同时,与gedatolisib的联合探索代表了精准治疗的方向——通过阻断关键耐药通路来增强疗效。然而,目前多数数据仍处于早期阶段,尤其是新辅助研究样本量有限,且最终数据需待2025年6月所有患者完成手术后方能完善。未来需要更大规模、随机对照研究来验证这些发现,并进一步明确生物标志物以指导个体化治疗。总体而言,达罗他胺正逐步确立其在前列腺癌全程管理中的核心地位。参考文献
1.ESMO 2025 Abstract 2476P
2.ESMO 2025 Abstract 2445P
3.ESMO 2025 Abstract 2522eP
4.ESMO 2025 Abstract 2458P
5.Raith F, et al. Int J Mol Sci. 2023;24(3):2289. Published 2023 Jan 24.
 歆语健康发布于 2周前
歆语健康发布于 2周前 收藏专家
收藏专家