弥漫性大B细胞淋巴瘤(DLBCL)属于非霍奇金淋巴瘤(NHL),占成人NHL的30%。指南推荐的DLBCL一线治疗方案是利妥昔单抗+环磷酰胺、阿霉素、长春新碱和泼尼松(R-CHOP)。我国很多DLBCL患者由于负担不起进口药的费用而没有得到很好的治疗。

2020年4月,石远凯教授团队在《Journal of hematology & oncology》上发表了题为A phase 3 study of rituximab biosimilar HLX01 in patients withdiffuse large B-cell lymphoma的文章。
研究人员通过一项多中心、随机、平行、双盲、对照Ⅲ期临床试验,比较HLX01+CHOP和利妥昔单抗+CHOP治疗DLBCL患者的结果数据,探索HLX01+CHOP作为DLBCL一线治疗的可行性。该研究证实了HLX01+CHOP的疗效及安全性。
研究方法
从2015年10月9日至2017年3月10日,纳入406例成人初治DLBCL患者,纳入标准:国际预后指数为0~2;临床Ann Arbor分期为Ⅰ~Ⅳ期;组织学证实为CD20阳性;年龄18~80岁。患者随机(1:1)分为H-CHOP组(HLX01+CHOP,n=200)和R-CHOP组(利妥昔单抗+CHOP,n=206),以21天为1个周期,共治疗6个周期。
研究终点
研究的主要终点是6个治疗周期内的ORR;次要终点包括CR、1年持续反应率、1年无事件生存率、1年无进展生存率、1年无病生存率、1年总生存率和外周血中CD19阳性B细胞的缺失。
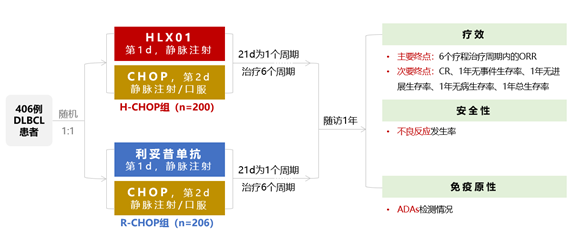
DLBCL:弥漫性大B细胞淋巴瘤;H-CHOP:HLX01+CHOP方案;R-CHOP:利妥昔单抗+CHOP方案;
CHOP:环磷酰胺、阿霉素、长春新碱和泼尼松;ORR:总缓解率;CR:完全缓解率
研究结果
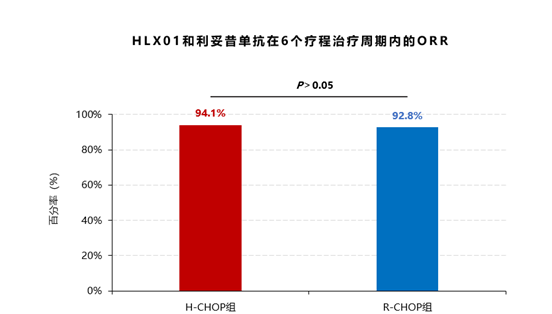
主要疗效终点:H-CHOP组6个治疗周期内的ORR为94.1%,与R-CHOP组的92.8%相比,无统计学差异(P=0.608)。
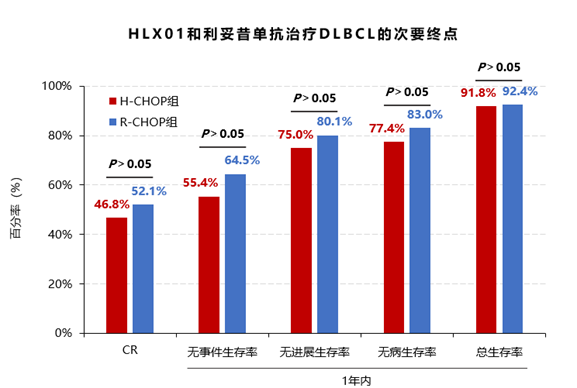
次要疗效终点:H-CHOP组CR、1年无事件生存率、1年无进展生存率、1年无病生存率、1年总生存率分别为46.8%、55.4%、75.0%、77.4%和91.8%,R-CHOP组分别为52.1%、64.5%、80.1%、83.0%和92.4%,两组均无统计学差异(P均>0.05)。
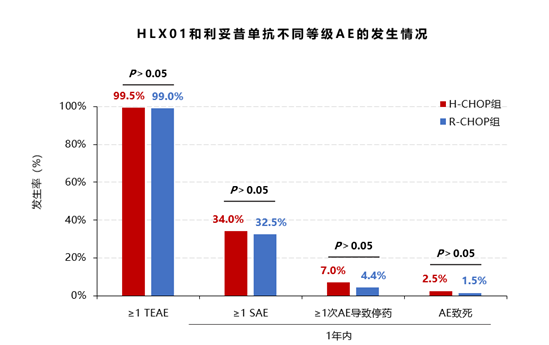
安全性:比较治疗中不良事件和严重不良事件,组间均无统计学差异(P>0.05)。
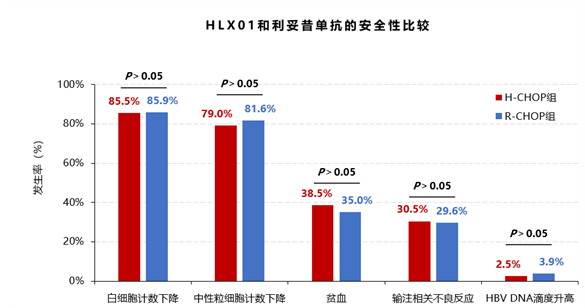
最常见的不良事件是血液学不良反应,此外,两组均有部分患者发生输注相关不良反应或乙型肝炎病毒(HBV)-DNA滴度增加,但两组均无统计学差异(P均>0.05)。
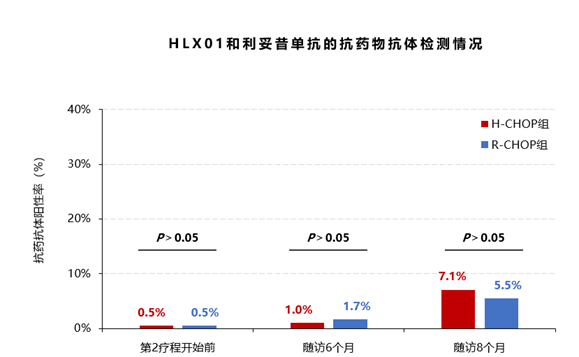
免疫原性:两组在基线和第2个治疗周期开始前均有1例患者(<1%)检测到抗药物抗体(ADAs);随访6个月,H-CHOP组出现1例ADAs,R-CHOP组出现2例;随访8个月,H-CHOP组出现7例ADAs,R-CHOP组出现6例。组间对比,均无统计学差异(P均>0.05)。
HLX01是利妥昔单抗的生物类似药。在药代动力学上与利妥昔单抗具有生物相似性。基于此,临床开始探索联合应用HLX01和CHOP作为DLBCL患者的一线治疗方案,以提高利妥昔单抗的药物可及性。HLX01的安全性和耐受性已在Ⅰ期临床试验中得到了验证。
本文介绍的Ⅲ期研究显示,与利妥昔单抗+CHOP相比,HLX01+CHOP在主要和次要疗效终点对比的分析证实,HLX01与利妥昔单抗对于DLBCL患者具有治疗等效性,因此,本研究支持HLX01+CHOP作为DLBCL患者的一线治疗。
HLX01上市在即,小编认为其出现对中国DLBCL患者意义非凡,HLX01给患者提供更多的药物选择,而利妥昔单抗注射液的市场价格局势也将发生变化。该研究证实HLX01的安全性、免疫原性均与利妥昔单抗相当,这为DLBCL患者的治疗提供了安全性依据。
END
如需文献全文,请在下方留言并提供您的邮箱












