 歆语健康发布于 1月前
歆语健康发布于 1月前 收藏专家
收藏专家造血干细胞移植(HSCT)是多种血液系统疾病的重要治愈手段。然而,移植后血小板减少症,包括持续孤立性血小板减少(PIT)和继发性血小板恢复失败(SFPR),仍是患者移植后出血的主要原因之一1,2。大量研究表明,该并发症不仅显著增加出血风险,还与移植物抗宿主病(GVHD)、移植失败以及总生存率下降等多种不良预后因素密切相关,成为制约移植疗效与长期预后的“最后一公里”难题。
近年来,随着对造血微环境重建、免疫调控及巨核细胞分化生成机制的深入认识,针对HSCT后血小板减少的干预手段不断拓展。在传统的血小板输注与支持治疗之外,促血小板生成药物,尤其是血小板生成素受体激动剂(TPO-RA),因其能够直接促进巨核细胞成熟和血小板生成,正逐渐成为该领域研究与临床应用的热点,显示出改善血小板恢复与患者预后的潜在价值。
HSCT后血小板减少症为何“难缠”,其机制与临床危害主要体现在哪里?

既往研究显示,HSCT后约30%的患者可出现PIT或SFPR2,3。更有研究指出,在接受清髓性预处理或自体干细胞“抢救性”移植的患者中,由于大剂量化疗及/或全身放疗(TBI)所致的骨髓发育不全,几乎所有患者均会经历不同程度的血小板减少4。清髓性预处理和放化疗毒性可直接损伤造血干/祖细胞,抑制其向巨核系分化;同时,移植物来源差异、急/慢性移植物抗宿主病(GVHD)、感染及病毒再激活(如CMV、EBV)等因素亦可造成骨髓微环境破坏或外周血小板加速清除,导致产板受抑与耗板增多并存的状态,使血小板恢复迟缓甚至长期不足2,3。

多元治疗选择该如何理解?在HSCT后血小板减少的评估与治疗路径上,如何把握重点?

在移植后血小板减少的治疗中,传统的血小板输注仍是急性出血或重度血小板减少阶段的基础干预措施,可迅速提升血小板计数、降低出血风险。然而,长期依赖输注容易导致抗原致敏、输注反应及感染风险增加,同时显著提高治疗成本,更重要的是,这种支持性治疗无法从根本上纠正造血系统内源性产板功能障碍的问题。
因此,临床策略正逐步从单一的“补充式治疗”转向“多元化干预”,即在多靶点、多机制的基础上,综合调控造血恢复、免疫平衡与骨髓微环境。近年来,如何通过新型药物改善造血干/祖细胞功能、修复骨髓基质与血管内皮、减少预处理相关损伤,并促进巨核系细胞的扩增与分化,成为研究和临床实践的关注焦点。
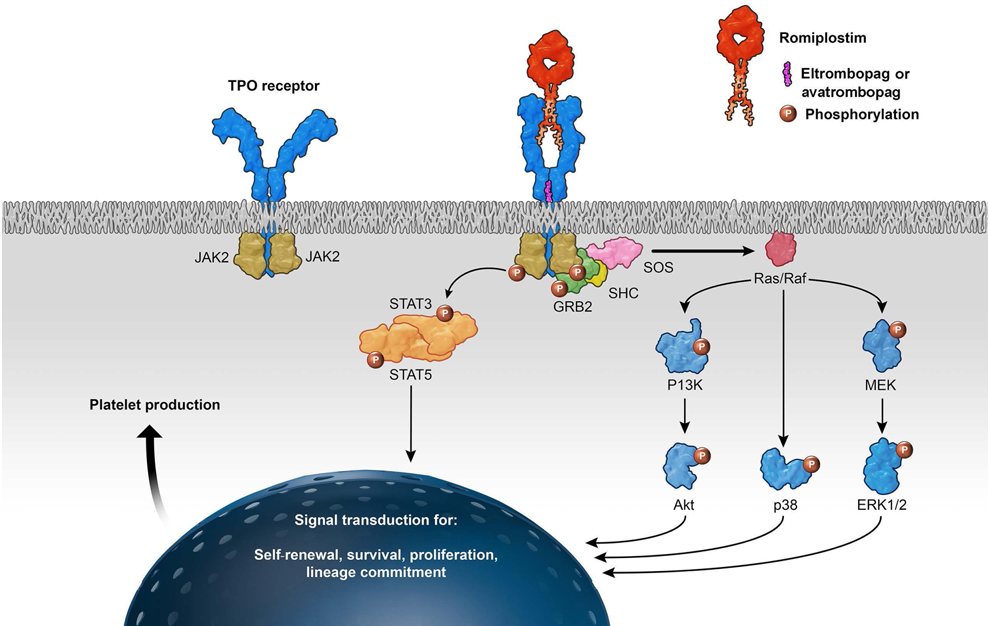
图2. 罗普司亭等TPO-RA类药物作用机制示意图
所谓“多元治疗选择”,不仅仅指药物手段的多样化,更强调不同治疗机制的协同与整合。除TPO-RA促升板外,还需联合抗感染治疗、GVHD管理、营养与造血支持以及骨髓微环境修复等措施。与此同时,多元治疗还应体现个体化原则。不同患者在移植类型、自身骨髓状态、出血风险、GVHD程度、病毒状态及其他血系恢复速度等方面存在显著差异。临床医师需基于病因学评估与动态监测,制定个体化的治疗组合与序贯策略,从而最大化疗效并降低不良反应风险。
TPO-RA在移植后血小板减少中的整体疗效与安全如何?

近年来多项系统综述与临床研究均验证了TPO-RA在HSCT后血小板减少中的疗效。2020年一项纳入了25项研究结果的系统综述显示,艾曲泊帕总体应答率(ORR)约为70%,长效TPO-RA罗普司亭的总体应答率可达82%,其中在SFPR患者中应答率更高,高达94%8。前瞻性研究进一步验证了这一结果:在24例患者(因GVHD或感染导致的血小板植入延迟 n=10;继发性血小板减少 n=14)中,共有18例实现了持续血小板水平>50×10⁹/L的反应;此外,在22例首次输注罗普司亭前血红蛋白水平<10g/dL的患者中,约有95%的患者观察到血红蛋白的改善4,9。另一项回顾性研究纳入了13例儿科患者(SFPR n=9;植入失败 n=4),患儿治疗前血小板<10×109/L,接受罗普司亭治疗1周多数患儿脱离了血小板输注依赖4,进一步支持了其在儿童HSCT后血小板减少中的可行性与有效性。
长效 TPO-RA 在 HSCT 后血小板减少中的独特优势是什么?

在多元治疗选择中,长效TPO-RA罗普司亭因其独特的药理结构与稳定的促血小板效应,在机制、疗效及临床可操作性方面均展现出一定优势。
从机制上看,罗普司亭采用Fc融合蛋白设计,能够与新生儿Fc受体(FcRn)结合,从而延长药物在体内的半衰期,这一结构优势使其具备每周一次皮下注射即可维持稳定血小板生成的能力,对移植后处于复杂恢复期、合并多药治疗或肝肾功能受损的患者尤为有利。相比之下,艾曲泊帕等口服TPO-RA受吸收速率、肝脏代谢及饮食影响较大,在肝功能受损或药物相互作用复杂的HSCT患者中管理难度更高。
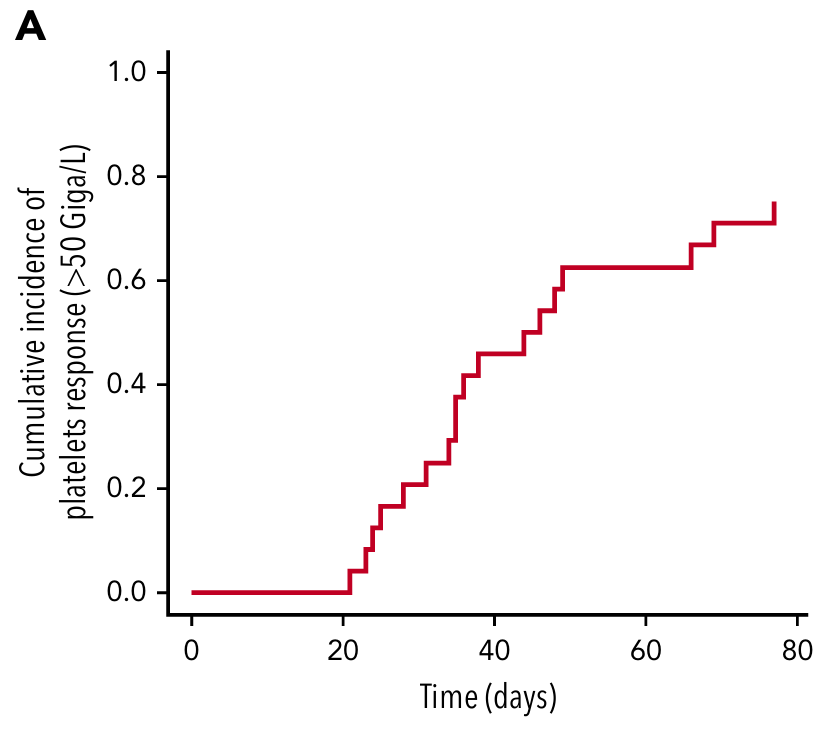
另一项开放标签研究则进一步探索了罗普司亭在自体造血干细胞移植患者中的早期干预价值,结果显示,患者自移植后第1天起以3 μg/kg/周起始剂量给药,结果显示在第15天血小板计数恢复正常,第21天平均血小板计数达211×109/L,高于既往匹配对照组(100×109/L)6,表明罗普司亭可加速移植后血小板重建并助力减少重度血小板减少持续时间。
面向临床实践,如何在多元治疗中合理定位“长效TPO-RA罗普司亭”,以期实现更优预后?

在循证证据方面,一项纳入42篇研究、涵盖1154例患者的荟萃分析,为TPO-RA在HSCT后血小板减少中的疗效与安全性提供了系统性评价。该研究对包括罗普司亭、艾曲泊帕及阿伐曲泊帕在内的7种药物进行了比较,结果显示,罗普司亭在各类干预中表现出相对最高的总体有效率——达87%(95% CI:69%–98%),明显优于艾曲泊帕(68%)和阿伐曲泊帕(73%)10。
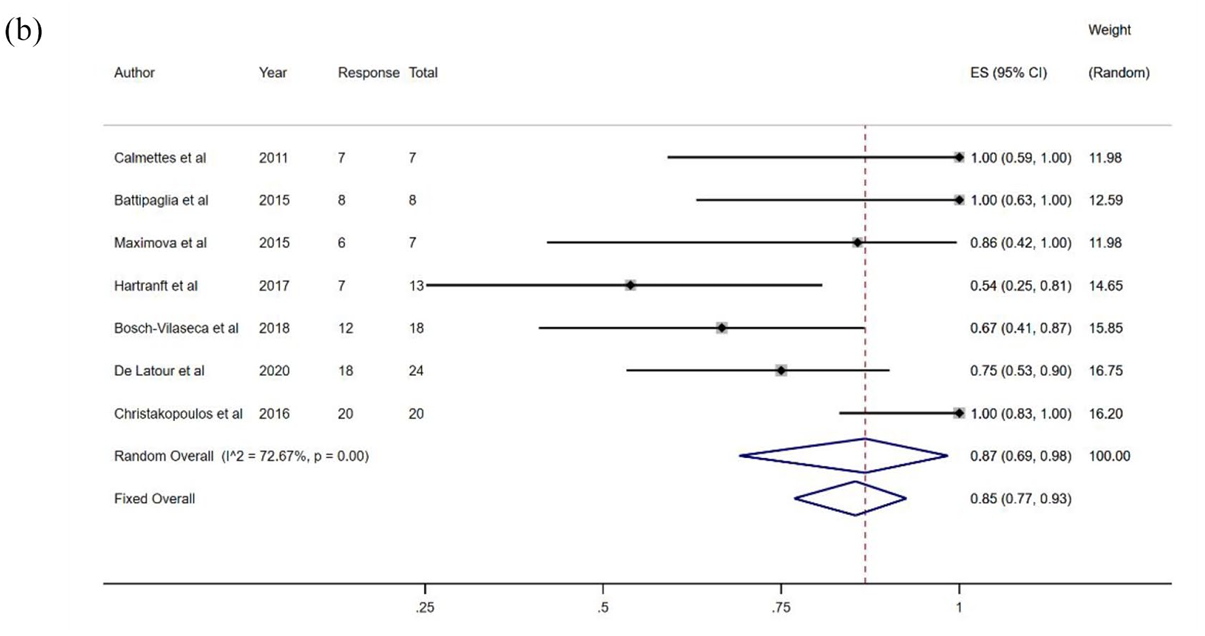
图4. 移植后血小板减少症患者接受罗普司亭治疗的反应率-森林图
而在临床实践中,HSCT后血小板减少的治疗还应遵循个体化与分层化原则:通过综合考虑移植类型、移植物来源、预处理方案及并发症特征等因素,针对不同病因与风险机制制定精准干预策略。临床决策宜由多学科团队(包括移植科、血液科、感染科及实验室专家)共同参与,结合中心经验与患者特征,建立动态调整的管理路径,以实现血小板重建与免疫稳态的双重优化。
总 结





参考文献
1.中华医学会血液学分会.中华血液学杂志,2021,42(04) : 276-280.
2.彭惜茹,等.中国实验血液学杂志,2023,31(03):916-921.
3.申彪,等.中国细胞生物学学报,2022,44(01):159-164.
4.Elsayed A, et al. Immunotargets Ther. 2024;13:461-486.
5.Wang H, et al. Front Oncol. 2022;12:940320.
6.Scordo M, et al. Blood Adv. 2023;7(8):1536-1544.
7.Bussel J B, et al. Drug design, development and therapy, 2021: 2243-2268.
8.Mahat U, et al. Biol Blood Marrow Transplant. 2020;26(3):e65-e73.
9.Peffault de Latour R, et al. Blood. 2020;135(3):227-229.
10.Hua W, et al. Ther Adv Hematol. 2025;16:20406207251353007.










