 歆语健康发布于 1月前
歆语健康发布于 1月前 收藏专家
收藏专家前列腺癌是我国男性泌尿系统最常见的恶性肿瘤之一,随着筛查普及和诊断技术提升,越来越多患者在早期接受根治性治疗。然而,仍有相当比例患者在根治术后出现生化复发(BCR),提示微小残留病灶存在,若不及时干预,可能进展为转移性激素敏感性前列腺癌(mHSPC),最终走向去势抵抗阶段,治疗难度陡增。
近年来,第二代雄激素受体抑制剂(ARi)的崛起彻底改变了mHSPC的治疗格局。瑞维鲁胺作为我国自主研发的新型AR拮抗剂,在CHART研究中已显示出优于比卡鲁胺的疗效与安全性。但在非内脏转移的高瘤负荷mHSPC人群中,其疗效是否受骨转移数量影响?对于术后BCR这类“窗口期”人群,能否通过早期强化干预实现深度缓解?这些问题在ESMO 2025大会上得到了关键数据回应。
对于转移性激素敏感性前列腺癌(mHSPC)患者而言,初始治疗方案的选择直接关系到长期预后。CHART研究是一项前瞻性、随机、III期临床试验(NCT03520478)1,旨在比较瑞维鲁胺联合雄激素剥夺治疗(ADT)与比卡鲁胺联合ADT在高瘤负荷mHSPC患者中的疗效与安全性。近期公布的该项事后分析聚焦于非内脏转移型mHSPC患者(n=520),进一步探讨基线骨转移灶数量是否影响治疗效果。
结果显示,截至2022年2月28日,瑞维鲁胺组的中位影像学无进展生存期(mrPFS)尚未达到(NR),而比卡鲁胺组仅为22.1个月(HR = 0.42,95% CI: 0.31–0.56,P < 0.0001)。在总生存期(OS)方面,瑞维鲁胺组同样表现出明显优势,中位OS未达到,而对照组为38.1个月(HR = 0.49,95% CI: 0.35–0.67,P < 0.0001)。Cox模型分析显示,骨转移数量与rPFS之间无显著交互作用(HR = 1.003),提示无论骨转移灶数量多少,患者均可从瑞维鲁胺治疗中获益。
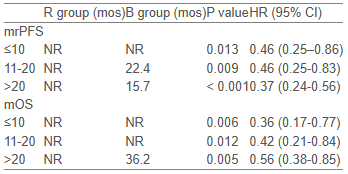
表1:按照骨转移灶数量分层的生存结果
尽管根治性前列腺切除术(RP)是局限性前列腺癌的标准治疗手段,但约20%-40%患者会在术后出现前列腺特异性抗原(PSA)升高,即生化复发(BCR),提示疾病复发风险极高。目前对于BCR患者的管理仍缺乏统一标准,尤其是是否启动系统性治疗尚存争议。
一项正在进行的多中心、开放标签、多队列II期试验2首次评估了瑞维鲁胺在RP后BCR患者中的初步疗效与安全性。其中Cohort 2纳入了拒绝或不适合接受挽救性放疗(SRT)的患者,给予瑞维鲁胺(240 mg QD)联合ADT治疗12个月,主要终点为3年生化无进展生存率。本摘要报告了已完成入组的Cohort 2的早期结果。
研究共纳入45例患者,中位年龄73岁,20.0%患者术后Gleason评分≥8,中位基线PSA为0.271 ng/mL。令人振奋的是,在可评估患者中,从3个月至12个月各时间点的不可测PSA率均维持在100%(3个月:34/34;6个月:28/28;9个月:21/21;12个月:19/19)。这一结果提示,瑞维鲁胺联合ADT能够在BCR阶段迅速且持续地抑制PSA水平,可能有效清除微转移灶或延缓影像学进展。
安全性方面,仅6.7%(3/45)患者发生3级治疗相关不良事件(TEAEs),包括高甘油三酯血症(6.7%)、丙氨酸氨基转移酶升高(2.2%)和胆红素升高(2.2%),未观察到≥4级TEAEs。良好的耐受性支持其在早期干预策略中的长期使用潜力。
瑞维鲁胺的研发路径体现了从晚期向早期拓展的战略布局。在高瘤负荷mHSPC领域,CHART研究已确立其相较于第一代ARi比卡鲁胺的显著生存优势,本次ESMO公布的事后分析进一步验证了其疗效的稳定性与广泛适用性,尤其打破了“骨转移越多、获益越少”的传统认知,增强了临床使用的信心。
与此同时,将瑞维鲁胺前移至根治术后BCR阶段,属于典型的“治疗关口前移”策略。此类患者虽无影像学可见病灶,但PSA反弹提示生物学复发,正是实施精准干预的最佳时机。当前指南对此类患者多建议观察或局部放疗,系统性药物治疗证据有限。而本II期研究显示,瑞维鲁胺+ADT可在一年内实现100%不可测PSA率,远超传统单用ADT的历史数据(通常PSA下降不完全或反弹较快),提示其更强的AR通路抑制能力。
当然,我们也需理性看待现有数据:BCR研究样本量较小,随访时间较短,尚未报告影像学进展或远处转移的发生情况。未来需更长时间随访以验证其对无转移生存期(MFS)和总生存期(OS)的影响。此外,是否所有BCR患者都需接受系统治疗,还需结合Gleason评分、PSA倍增时间、基因检测等进行个体化决策。
拓展阅读
瑞维鲁胺作为新一代雄激素受体(AR)拮抗剂,其疗效与分子特征的关系正在被不断揭示。Ⅱ期研究3纳入既往接受过阿比特龙或恩扎卢胺治疗失败的mCRPC患者,结果显示,瑞维鲁胺在既往暴露于AR通路抑制剂的患者中仍具有显著抗肿瘤活性,PSA≥50%下降率达到43.5%,部分患者获得持续的影像学缓解。进一步的亚组分析发现,即使存在AR基因扩增或TP53突变等潜在耐药标志物,瑞维鲁胺依旧展现出稳定的疾病控制能力。
该研究提示,瑞维鲁胺相较于传统AR拮抗剂,可能具有更广泛的受体结合谱和较低的交叉耐药风险。其分子设计优化了AR配体结合域(LBD)的亲和性,同时减少了血脑屏障穿透,降低中枢神经系统毒性。在分子层面,这种结构差异使瑞维鲁胺对部分突变型AR保持结合活性,从而解释了其在耐药背景下仍能维持疗效的原因。
观点评述
ESMO 2025公布的这两项研究共同勾勒出瑞维鲁胺在前列腺癌全程管理中的广阔前景:一方面,在晚期mHSPC患者中,它已成为优于传统抗雄药物的优选方案,且疗效不受骨转移负担影响;另一方面,在早期BCR阶段,其展现出前所未有的生化控制能力,提示可能改变现有治疗范式。
然而,我们也要清醒认识到,目前BCR研究仍处于II期阶段,缺乏对照组和长期终点数据。下一步亟需开展III期随机试验,比较瑞维鲁胺+ADT vs 单纯观察或SRT,明确其对转移发生率和生存结局的真实影响。同时,应建立预测模型,筛选最可能从中获益的人群,避免过度治疗。
参考文献
1.ESMO 2025 Abstract 2434P
2.ESMO 2025 Abstract 2453P
3.Peng S, et al. Front Oncol. 2025;15:1657772. Published 2025 Oct 1.










