在现代肿瘤治疗日益精准和多样化的背景下,药源性肝损伤(Drug-Induced Liver Injury, DILI)正成为影响抗癌疗效的重要临床难题。化疗、靶向治疗乃至免疫检查点抑制剂都可能引发肝脏酶学异常,严重时需减量、延迟甚至终止抗肿瘤治疗,直接影响患者的生存预后。然而,面对DILI,临床常陷入“保肝”与“抗癌”的两难抉择:是否必须停用有效抗癌药?能否提前干预以降低风险?近年来,随着对肝保护药物研究的深入,一些证据开始浮现——某些护肝药物不仅可改善肝功能指标,甚至能在不牺牲抗肿瘤疗效的前提下,帮助患者持续完成治疗方案。药源性肝损伤悄然威胁抗癌进程已成为不容忽视的临床现实
药源性肝损伤是导致药物退市的主要原因之一,而在接受抗癌治疗的患者中尤为值得关注。由于肝脏承担着绝大多数药物的代谢任务,抗癌药物及其代谢产物极易引发肝细胞损伤或胆汁淤积,表现为ALT、AST、ALP或TBIL等生化指标异常。尽管多数DILI为轻度可逆,但一旦发生中重度肝毒性,往往需要暂停或终止原定抗癌方案,进而可能影响疾病控制率和总体生存。据流行病学数据显示,DILI年发病率在不同地区介于每10万人2.7至19例之间,其中亚洲人群发病率相对更高。更令人担忧的是,在因安全性问题撤市的药物中,肝毒性占比高达27.1%,远超其他不良反应。对于正在与时间赛跑的癌症患者而言,任何治疗中断都可能是致命打击。因此,如何在保障肝脏安全的同时维持抗癌治疗的连续性,已成为肿瘤支持治疗领域的核心议题之一。主流护肝药物疗效盘点:从“被动应对”到“主动防护”传统上,DILI的处理原则是立即停用可疑药物并给予基础保肝支持。然而,越来越多的研究开始探索更具前瞻性的策略——即在启动抗癌治疗的同时联合使用护肝药物,实现“未病先防”。现有文献评估了包括腺苷蛋氨酸、双环醇、水飞蓟素(silymarin)、甘草酸制剂及熊去氧胆酸(UDCA)在内的多种护肝剂在抗癌相关DILI中的应用效果。
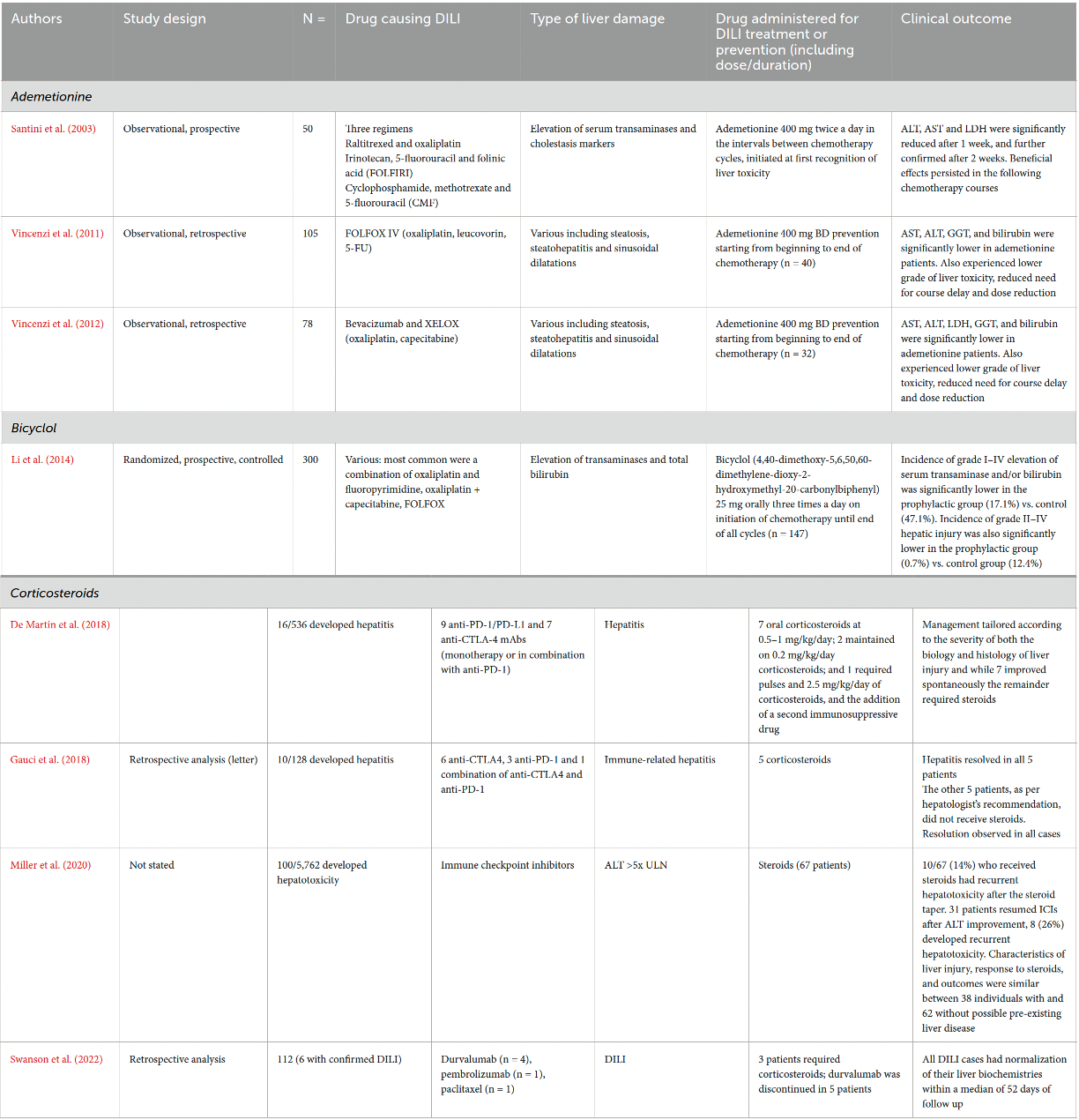
其中,腺苷蛋氨酸因其参与甲基化反应、谷胱甘肽合成及磷脂代谢,在胆汁淤积型DILI中具有理论优势。多项观察性研究显示,无论是在FOLFOX方案还是贝伐珠单抗联合XELOX治疗期间,从化疗起始即加用腺苷蛋氨酸(400 mg bid),均可降低AST、ALT、GGT及胆红素水平,并减少治疗延迟的发生率。更重要的是,已有研究表明腺苷蛋氨酸不仅不会削弱化疗疗效,反而可能通过保护正常肝细胞、减轻氧化应激来增强整体治疗耐受性。
另一类备受关注的是双环醇,一种在中国广泛用于炎症性肝损伤的合成药物。其机制涵盖稳定细胞膜、清除自由基、调节氧化应激及抑制炎症因子释放。一项纳入300名老年癌症患者(涵盖结直肠癌、肺癌、胃癌等多种实体瘤)的随机对照研究发现,在含奥沙利铂/氟尿嘧啶等方案基础上加用双环醇(25 mg tid),可使I–IV级转氨酶或胆红素升高的发生率从47.1%降至17.1%;II–IV级肝损伤的发生率也有所下降。此外,一项多中心II期试验还证实,双环醇在特异性急性DILI患者中可更快实现ALT复常,目前已推动进入III期临床验证阶段。
表1:腺苷蛋氨酸、双环醇在DILI中的临床研究进展
相比之下,其他药物如水飞蓟素和熊去氧胆酸的证据则较为有限。一项针对乳腺癌患者的三盲安慰剂对照试验显示,尽管水飞蓟素组在超声评估上有非显著趋势提示肝损伤较轻(p=0.083),但在FibroScan和肝功能检测上未见差异。而熊去氧胆酸在儿童白血病患者中的研究结果亦呈现矛盾:部分研究提示其可降低转氨酶水平,另一项开放标签试验却未观察到明确益处。走出经验主义困局:DILI管理呼唤高级别证据与精准路径尽管现有数据为腺苷蛋氨酸和双环醇的应用提供了初步支持,但该领域仍面临诸多挑战。首先,目前多数研究样本量较小,设计多为观察性或单中心试验,缺乏大规模、前瞻性、随机双盲对照研究的确证。其次,DILI的诊断依赖排除法,缺乏特异性生物标志物和标准化评分系统,导致识别和评估存在主观性。再者,不同类型抗癌药物(如传统化疗、靶向药、免疫检查点抑制剂)所致肝损伤的机制各异,是否应采取差异化护肝策略尚无共识。
值得注意的是,免疫检查点抑制剂(ICI)相关的肝炎虽归类为免疫相关不良事件(irAE),但也被纳入广义DILI范畴。此类损伤通常需使用糖皮质激素干预,部分难治病例还需联用他克莫司等二线免疫抑制剂。然而,激素本身也可能带来代谢紊乱等副作用,进一步增加管理复杂度。因此,探索在ICI治疗中是否可通过早期护肝药物介入以降低irAE发生率,将是未来值得研究的方向。拓展阅读
除了腺苷蛋氨酸和双环醇,近年来还有多种新型护肝机制进入视野。例如,N-乙酰半胱氨酸(NAC)作为谷胱甘肽前体,在对乙酰氨基酚中毒引起的急性肝衰竭中已被确立为标准解毒剂,但在抗癌药物所致DILI中的作用仍在探索中。另外,FXR激动剂如奥贝胆酸(obeticholic acid)通过调控胆汁酸代谢通路,在非酒精性脂肪性肝炎(NASH)中表现出良好前景,理论上也可能用于胆汁淤积型DILI的干预。此外,microRNA-based biomarkers(如miR-122、miR-192)作为早期肝损伤敏感指标,正在被开发用于DILI的无创监测,有望提升诊断时效性和准确性。这些新兴技术与药物的结合,或将推动DILI管理从“经验性治疗”向“精准预警+靶向干预”模式转变。特别是在高风险人群(如老年、基础肝病、多药联用)中实施分层防控策略,有望最大限度保障抗癌治疗的连续性与安全性。抗癌治疗相关药源性肝损伤是一个不容忽视的临床问题,直接关系到治疗依从性与长期预后。当前证据表明,腺苷蛋氨酸和双环醇在改善肝功能异常方面具有一定疗效,尤其是前者在多个回顾性研究中显示出减少治疗中断的优势,后者则在大型随机试验中证实可降低肝酶升高风险。更为重要的是,两者均未见干扰抗肿瘤疗效的报道,反而可能通过提升耐受性间接改善结局。然而,我们必须清醒认识到,现有证据等级整体偏低,多数结论来自非随机研究或小样本试验。未来亟需开展更多设计严谨的III期RCT,明确各类护肝药物的最佳使用时机(预防 vs 治疗)、剂量方案及适用人群。同时,建立统一的DILI诊断标准和疗效评价体系,也将有助于跨研究比较与指南制定。展望未来,随着机制研究的深入和新型生物标志物的应用,我们有望实现对DILI的早期预测、动态监测与个体化干预。届时,“保肝”将不再是被动应对的补救措施,而是贯穿抗癌全程的支持基石。参考文献
1.Vincenzi B, Yimin M, Andrade RJ, et al. Management of drug-induced liver injury associated with anti-cancer therapy. Front. Physiol. 2025;16:1541020.
2.Li X, et al. Efficacy and safety of bicyclol in the prevention of chemotherapy-induced liver injury: a randomized controlled trial. Chin J Cancer Res. 2014;26(2):231–236.
3.Moezian Z, et al. Effect of silymarin on chemotherapy-induced hepatotoxicity in breast cancer patients: a triple-blind placebo-controlled trial. Integr Cancer Ther. 2022;21:15347354221106158.
4.Saif MW, et al. Ursodeoxycholic acid for the prevention of chemotherapy-induced hepatotoxicity in children with ALL. Anticancer Res. 2012;32(8):3479–3482.
5.Chalasani N, et al. ACG Clinical Guideline: Drug-Induced Liver Injury. Am J Gastroenterol. 2021;116(5):874–897.
 歆语健康发布于 1月前
歆语健康发布于 1月前 收藏专家
收藏专家