 歆语健康发布于 1周前
歆语健康发布于 1周前 收藏专家
收藏专家导语
在肿瘤治疗的临床实践中,每一个病例都是一场兼顾疗效与安全的复杂博弈,尤其当抗肿瘤治疗遭遇严重不良反应时,更考验着诊疗策略的灵活性与精准度。晚期恶性肿瘤的治疗往往始于循证医学的指引,基于疾病分型、分子特征及指南推荐制定综合方案,力求通过多手段协同实现病灶控制。然而,治疗过程中常伴随各类不良反应,其中血液学毒性尤其是重度血小板减少,常成为阻碍治疗持续进行的关键障碍。这种由治疗引发的血小板减少,需要与其他潜在病因仔细鉴别,更需依据患者个体反应动态调整干预策略——从单一药物的初步干预,到基于作用机制差异的联合方案,每一步调整都需兼顾药物协同效应与患者耐受度。临床医生往往需要在“抗肿瘤”与“保安全”之间寻找动态平衡:既要通过及时有效的升板治疗为持续抗肿瘤创造条件,又需避免因过度干预影响原发病治疗节奏。

基本信息
患者男性,60岁
现病史:患者主诉因“乏力、嗳气1月”于2024年4月29日就诊。主要表现:老年男性,存在乏力、体重下降症状,血红蛋白(Hb)为120g/L,大便潜血试验(OB)呈阳性;血常规检查(2024年4月30日):白细胞计数8.1×109/L,红细胞5.1×1012/L,血红蛋白120g/L,血小板计数362×109/L;肿瘤标志物检查:甲胎蛋白(AFP)2.62ng/ml,癌胚抗原(CEA)3.01ng/ml,糖类抗原(CA19-9) 9.68U/ml,糖类抗原(CA125) 296.30U/ml,糖类抗原 (CA72-4) 2.48U/ml;胃镜检查:诊断意见为贲门Ca?镜下所见贲门可见不规则肿物,肿物向上累及食管下段距门齿约38cm,并累及齿状线,肿物表面糜烂,覆盖污苔;病理检查:病理结果为中-低分化腺癌。免疫组化显示PMS2(+)、MLH1(+)、MSH2(+)、MSH6(+),呈pMMR状态;Her-2(3+),Ki-67(增殖指数约70-80%),PD-L1 CPS<2。
临床诊断
1.贲门腺癌IV期(cT3N2M1)pMMR HER-2(3+)
2.胃周淋巴结继发恶性肿瘤
3.肝继发恶性肿瘤
4.前列腺钙化灶
5.高血压病(2级,中危)
治疗过程
第1-6治疗周期
2024年5月2日、5月23日进行2周期治疗,方案为奥沙利铂230mg d1+卡培他滨2g早、1.5g晚d1-14+信迪利单抗200mg+曲妥珠单抗8mg/kg首次,6mg/kg后次,Q3w;
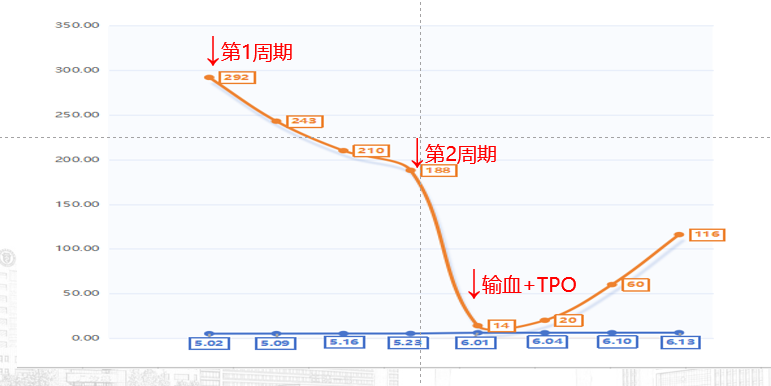
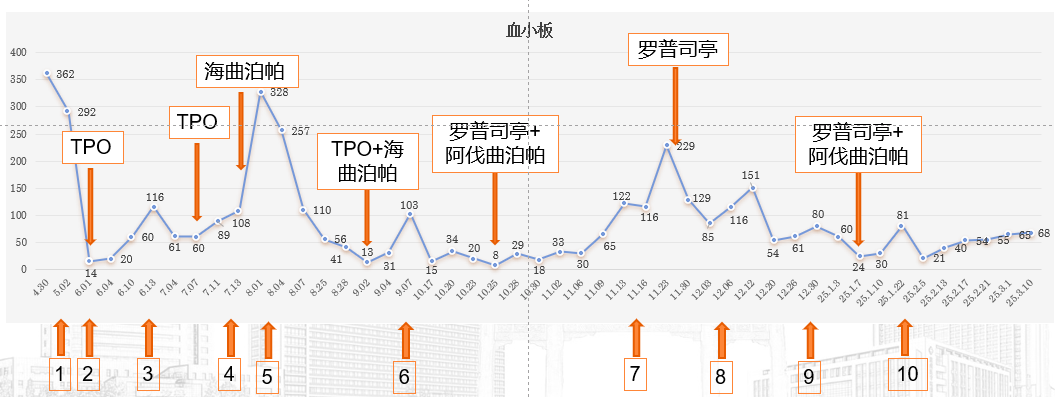
考虑为肿瘤治疗所致血小板减少症(CTIT),进行相关鉴别诊断,排除多种其他可能病因。调整治疗方案,包括化疗药物剂量减量20%,考虑二级预防使用海曲泊帕5mg/d等,但患者意见暂观察1周期;
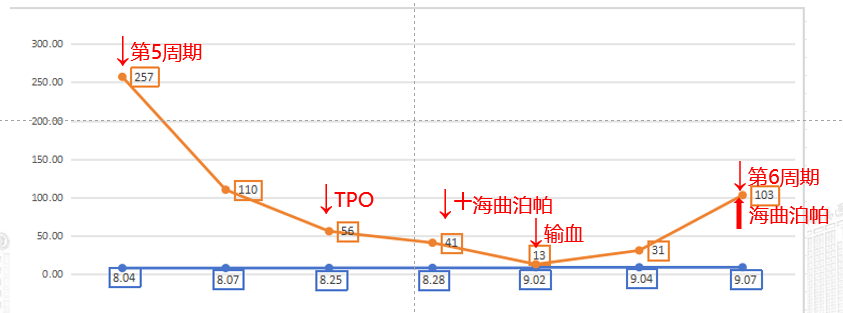
图2,第5周期后未规律二级预防,血小板不断下降
2024年10月17日,血小板计数15x109/L,予TPO15000U皮下注射;海曲泊帕7.5mg/d;输注去白细胞单采血小板;
2024年10月25日,血小板计数8x109/L,血小板计数不升反降;
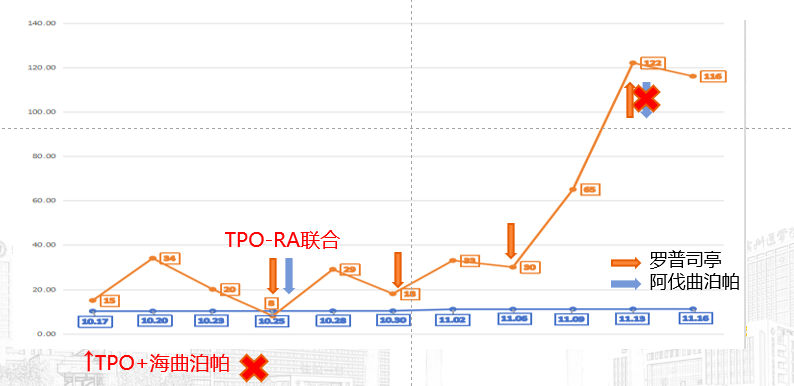
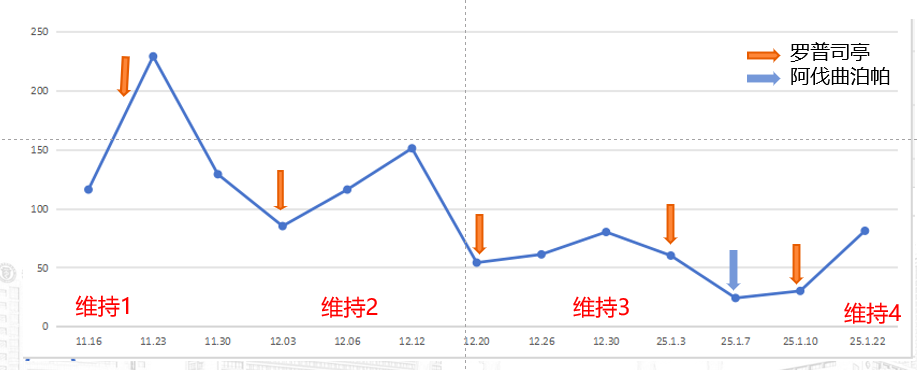
第7-10治疗周期
卡培他滨+曲妥珠单抗维持治疗;
维持治疗期间,间断给予罗普司亭N01或阿伐曲泊帕支持治疗。
治疗心得
本例患者确诊为贲门中-低分化腺癌IV期(cT3N2M1),伴肝转移及胃周淋巴结转移,免疫组化提示HER-2(3+)、pMMR、Ki-67(70%-80%),PD-L1 CPS<2。初始采用“奥沙利铂+卡培他滨+曲妥珠单抗+信迪利单抗”的靶免联合化疗方案,兼顾HER-2阳性靶点和肿瘤高增殖特性,为后续治疗奠定基础。治疗初期疗效显著,贲门病灶、胃周淋巴结及肝脏转移灶均出现退缩,但2周期后突发4级血小板减少(最低14×109/L),经系统鉴别排除假性减少、骨髓转移等因素后,确诊为肿瘤治疗所致血小板减少症(CTIT)。这一转折迫使我们将治疗重心转向“血小板保卫战”,整个过程可概括为三个策略阶段:
第一阶段为应急处理与初步调整。采用TPO联合输血快速提升血小板,同时将化疗剂量减量20%,降低骨髓抑制风险。考虑到患者前一周期血小板最低值<50×109/L,建议启用海曲泊帕进行二级预防,但尊重患者意愿先观察1周期,期间密切监测血小板波动。第二阶段为多药联合与机制互补。第4周期后规范使用海曲泊帕5mg/d,血小板逐步稳定,但因患者第5周期未规律预防,血小板再度下降。此时引入“TPO+海曲泊帕”双药方案,利用生物制品与小分子药物的协同作用,短期提升血小板至安全范围。第三阶段为精准靶向与协同增效。2024年10月血小板持续低迷,采用罗普司亭N01联合阿伐曲泊帕。依托两者不同的作用位点——罗普司亭N01结合TPO受体胞外结构域,阿伐曲泊帕作用于跨膜结构域,通过激活不同信号通路实现协同升板,最终使血小板稳定在治疗安全窗。在升板治疗的同时,抗肿瘤疗效持续向好。多次影像评估显示,贲门病灶、胃周淋巴结及肝脏转移灶逐步缩小,2025年3月疗效评估整体达到PR/CR。
这场诊疗历程,本质是一场平衡实践:在肿瘤退缩与血小板保护间找支点,在指南规范与个体差异间寻突破。最终证明,即使面对IV期肿瘤合并重度不良反应,通过精准诊疗与动态调整,依然能为患者赢得高质量的生存周期,这正是临床实践中“以患者为中心”理念的生动体现。

专家点评
化疗相关性血小板减少症(CTIT)是肿瘤治疗中的常见并发症,可导致出血风险增加、治疗延迟或剂量降低,进而影响患者生存获益1。该病例中罗普司亭N01的应用为HER-2阳性晚期胃癌患者在严重血小板减少困境中延续有效治疗提供了关键支撑,患者接受靶免化疗方案后出现4级血小板减少,常规TPO及海曲泊帕治疗未能稳定血小板水平,甚至降至8×109/L,而罗普司亭N01作为一种可结晶片段(Fc)-多肽融合蛋白,可与内源性血小板生成素(TPO)竞争性结合TPO受体,促进骨髓巨核细胞集落形成细胞的生长,从而通过JAK2和STAT5激酶通路增加血小板生成2,3,与阿伐曲泊帕等TPO-RA类药物形成协同作用,联合应用后血小板水平逐步回升,使得抗肿瘤治疗得以继续,最终实现肝脏病灶PR/CR等显著疗效,充分证明在常规升板药物效果不佳时,罗普司亭N01凭借其作用机制差异能成为突破治疗瓶颈的重要选择。

专家点评
罗普司亭N01与其他升板药物的联合应用是该病例治疗的一大亮点,而这一联合方案的确定,正是多学科协作(MDT)下精准用药的生动体现,是多学科智慧在升板治疗中的集中体现。当单一使用海曲泊帕等药物无法稳定血小板计数时,联合罗普司亭N01和阿伐曲泊帕的方案取得了显著成效。这一联合并非随意组合,而是基于它们在结合位点和作用通路的互补性。罗普司亭N01结合TPO受体胞外结构域,阿伐曲泊帕作用于跨膜结构域4,二者分别激活不同的信号通路,产生协同升板效应。这种联合策略在相关临床实践和研究中得到支持,能够有效应对难治性血小板减少,在该病例中成功使血小板计数回升至安全范围,为患者接受持续的抗肿瘤治疗提供了保障,充分证明了联合用药在应对复杂血小板减少情况时的价值。

专家点评
罗普司亭N01的应用是该病例在保障抗肿瘤效果最大化的同时,有效控制血液毒性的核心环节,患者初始治疗方案虽引发严重血小板减少,但影像学评估显示各病灶均显著退缩,放弃该方案将错失治疗良机,而罗普司亭N01的加入打破了“血小板低下-暂停治疗-疗效打折”的恶性循环,其与其他升板药物联合使用后,血小板水平足以支持卡培他滨+曲妥珠单抗维持治疗的进行,最终实现肝内病灶消失等PR/CR疗效,这一过程既遵循了临床中“优先保证有效治疗”的原则,也凸显了罗普司亭N01在维系疗效与安全性平衡中的关键作用。
参考文献:
1.中国抗癌协会肿瘤临床化疗专业委员会, 等.中华医学杂志, 2023, 103(33): 2579-2590.
2.中国临床肿瘤学会(CSCO)淋巴瘤专家委员会,等. 白血病.淋巴瘤,2024,33(9):519-527
3.Hubulashvili D, et al. P T. 2009 Sep;34(9):482–5.
4.Cheloff AZ, et al. J Blood Med. 2019 Sep 5;10:313-321.










