 歆语健康发布于 3周前
歆语健康发布于 3周前 收藏专家
收藏专家在重型再生障碍性贫血(SAA)的治疗中,标准的IST方案总体应答率不足60%,完全应答仅30%左右。随着免疫抑制疗法(IST)和造血干细胞移植(HSCT)方案的优化,以及血小板生成素受体激动剂(TPO-RA,如罗普司亭)的应用,临床疗效得以显著提升。本文通过访谈多位血液领域知名专家,探讨初治SAA的诊断评估、治疗路径和支持策略,以期为临床一线实践提供参考。
初治SAA患者在诊断阶段应重点评估哪些因素,以指导后续规范化治疗?

初治SAA 的诊断评估需全面整合临床表现、实验室检查和骨髓形态学。首先,评估患者年龄、合并症和家族史至关重要——年龄直接关联治疗方案选择,合并症需涵盖肝肾功能、甲状腺功能及病毒学检查(肝炎病毒、EBV、CMV等),排除继发性骨髓衰竭;家族史则需通过染色体断裂试验(儿童或有家族史者)筛查范可尼贫血等先天性AA,必要时检测端粒长度及端粒酶活性,排除端粒生物学异常1。这些评估是区分先天性与获得性AA、规避治疗禁忌的基础。
其次,骨髓与免疫相关指标评估是核心。需获取至少2cm髂骨骨髓活检标本,明确造血组织减少、非造血细胞增多且无网硬蛋白增加的典型表现,同时结合骨髓涂片观察增生程度(<正常25% 或25%-50% 但残存造血细胞<30%为SAA)、巨核细胞明显减少的特征1;流式细胞术需同步检测PNH克隆(CD55⁻、CD59⁻、Flaer⁺)及骨髓 CD34⁺细胞数量,PNH克隆阳性常预示 IST更好疗效,而CD34⁺细胞减少程度可反映造血储备1,2;此外,T细胞亚群(Th1/Th2 分化、Treg比例)、细胞因子(IFN-γ、IL-4 等)检测,能明确免疫介导的发病机制,为IST方案调整提供依据。

图1 与再生障碍性贫血相鉴别的先天性全血细胞减少症
对无合适供体的初治SAA成年患者,规范的治疗方案是什么,实施有何注意事项?

对于无 HLA 匹配供体的成年初治 SAA 患者,《再生障碍性贫血诊断与治疗中国指南 (2022 年版)》明确推荐以免疫抑制治疗(IST)联合促血小板生成素受体激动剂(TPO-RA)为标准方案(图2)1。IST核心为抗胸腺/淋巴细胞球蛋白(ATG/ALG)联合环孢素A(CsA),ATG优先选兔源(2.5~3.5mg・kg⁻¹・d⁻¹,连续 5 天)或猪源(20~30mg・kg⁻¹・d⁻¹,连续 5 天),CsA 口服3~5mg・kg⁻¹・d⁻¹,目标血药浓度150~250μg/L;TPO-RA 可选择罗普司亭(10μg/kg/周起始)。一项Ⅱ-Ⅲ 期研究显示,IST 联合罗普司亭治疗第 27 周血液学反应率达 84%,53周三系应答率39%3。
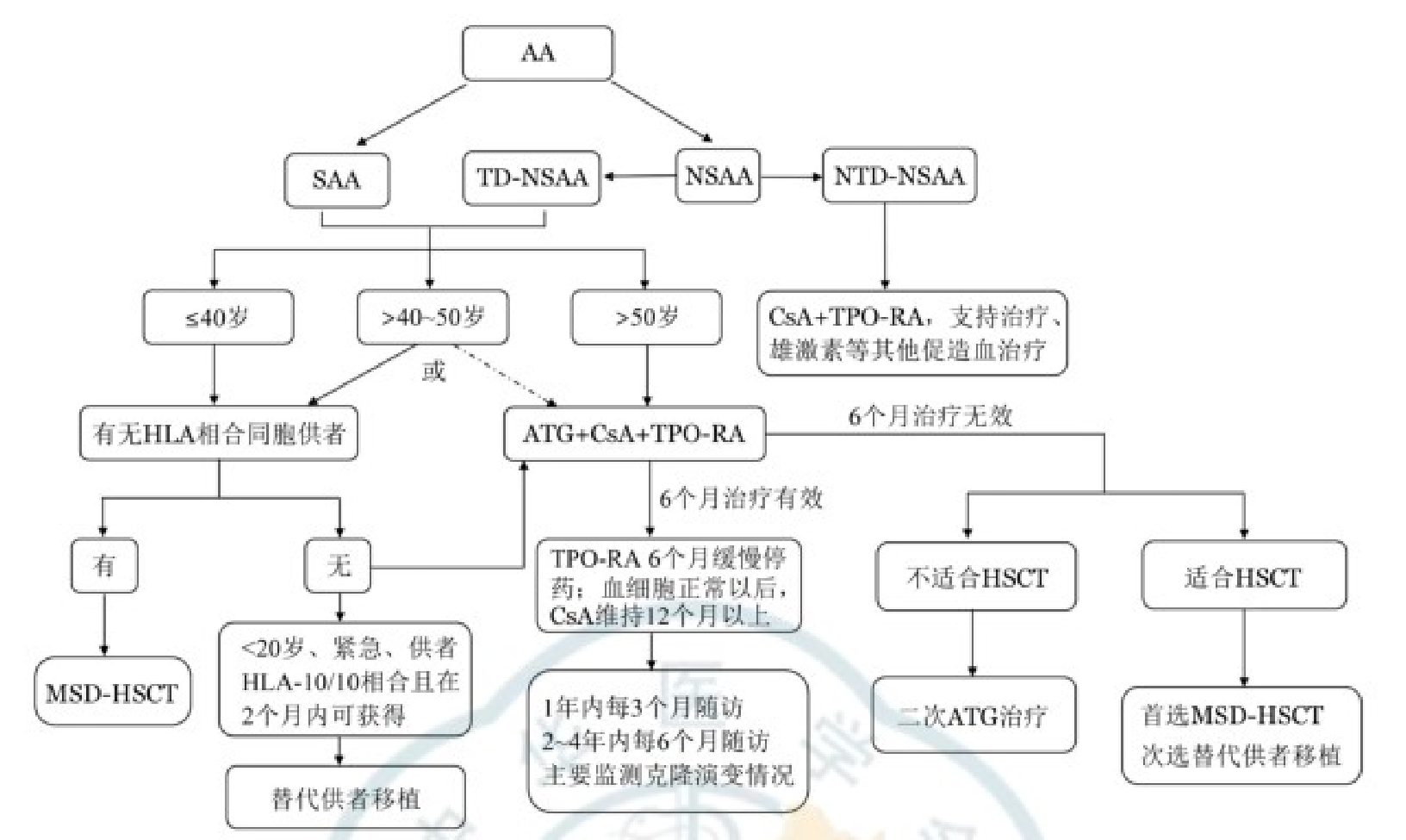
图2 再生障碍性贫血(AA)治疗路线图
初治SAA儿童患者的诊疗路径与成人有何异同,应如何规范化?

儿童与成人初治 SAA 诊疗的核心原则一致,均以 “HSCT 优先、IST 备选” 为核心,但实施细节存在显著差异。相同点在于,两者均需先评估HLA 相合同胞供体,有供体时 HSCT 为首选;无供体时均采用 IST(ATG 联合 CsA)联合 TPO-RA 方案,且需强化支持治疗(如成分输血、感染预防)1,2。差异主要体现在 HSCT 预处理:儿童多采用非放疗方案(如 Cy+ATG),可避免生长发育损伤及生育功能影响,5 年生存率达 80% 以上2;成人≤40 岁才优先 HSCT,预处理常需加氟达拉滨(Flu)或白消安(BU)1。
在 IST 与遗传筛查方面,儿童与成人差异更突出。儿童对 IST 应答率(约 75%)显著高于成人(60%-70%),且优先选择兔 ATG(减少血清病风险),而成人一线常用马 ATG1,2;儿童 CsA 目标血药浓度需酌减(低于成人150-250μg/L),并需每 3-6个月监测生长激素水平及骨龄,避免生长发育迟缓。此外,儿童必须早期开展遗传性骨髓衰竭筛查(如染色体断裂试验排除范可尼贫血、端粒长度检测)1,成人仅40岁以上或有家族史时才推荐,因儿童先天性 AA 占比更高(如范可尼贫血),漏诊会导致 IST 无效1。
规范化诊疗需紧扣儿童生理特点优化流程:一是确诊阶段,24小时内完成血常规、多部位骨髓穿刺+活检,同步开展染色体断裂试验(儿童必做)、端粒长度及相关基因突变检测(如 DKC1、TERT)1;二是治疗阶段,有供体时1个月内启动 HSCT(减毒预处理),无供体时48 小时内启动IST,TPO-RA 优先选罗普司亭(每周 10μg/kg 起始)3;三是长期监测,除按成人标准随访(3、6、12 个月测血常规、骨髓形态)外,儿童需额外每 6 个月评估生长发育、甲状腺功能及端粒长度,警惕端粒相关并发症(如肺纤维化)1,2。
初治SAA治疗中支持治疗应如何规范化,以降低并发症风险?

初治SAA支持治疗需严格遵循分层管理原则,核心是精准防控感染与科学输血。感染预防方面,确诊后应立即实施保护性隔离,有条件者入住层流病房;拟行ATG/ALG 或 HSCT 者,需预防性使用抗细菌、抗病毒及抗真菌药物(如氟康唑)1。若出现发热伴 ANC<0.5×109/L,需先予广谱抗生素,无效时加用抗曲霉药物(如伏立康唑);仅在粒细胞缺乏合并难治性感染时,短期使用 G-CSF(5μg・kg⁻¹・d⁻¹),避免常规应用1。输血管理需严格阈值:HGB<60g/L 时输注悬浮红细胞,老年或伴心肺疾病者放宽至≤80g/L;PLT<10×109/L(稳定状态)或 < 20×109/L(伴感染 / 出血风险)时输注血小板,无效者需输注HLA 配型相合血小板1。
祛铁治疗与多维度支持是降低远期并发症的关键。当患者累计输血超20U或血清铁蛋白 > 1000μg/L 时,需通过肝脏MRI评估铁过载程度,首选去铁胺(20-40mg・kg⁻¹・d⁻¹)或地拉罗司(20mg・kg⁻¹・d⁻¹)祛铁1。此外,需建立多学科协作机制:心理科介入缓解焦虑,提升治疗依从性;营养科指导高蛋白饮食,改善造血微环境。对血小板持续 < 20×109/L 且出血风险高者,可早期联用罗普司亭(10μg/kg每周皮下注射),,其可使出血事件减少 30%3,且不增加克隆演变风险,助力降低早期致命性出血风险。
初治SAA患者治疗失败后的二线策略如何规范化,避免延误?

初治 SAA 治疗失败(通常定义为 IST 或 HSCT 后 3-6 个月未达部分缓解)需先明确失败原因,优先通过骨髓形态学、流式细胞术(检测 PNH 克隆)、染色体核型及 NGS(排查 ASXL1/TP53 等不良突变)评估,排除克隆演变(如 MDS 转化)或端粒显著缩短等因素1,2。若存在 HLA 相合无关供体(MUD)或单倍体供体(Haplo),且患者年龄≤40岁、无严重合并症,应优先选择替代供体 HSCT,预处理方案推荐 Flu/Cy/ATG(氟达拉滨 120mg・m⁻²・d⁻¹+ 环磷酰胺 120-200mg・kg⁻¹・d⁻¹+ATG 10mg・kg⁻¹・d⁻¹),5 年生存率可达 57%-75%1。
无合适供体时,需调整免疫抑制与促造血方案:若初始用兔源 ATG,二线可换猪源 ALG(20-30mg・kg⁻¹・d⁻¹×5d)联合 CsA(目标血药浓度 150-250μg/L),同时加用 TPO-RA;可选择罗普司亭,按 10μg/kg 每周皮下注射,根据血小板计数调整剂量(每 4 周 ±5μg/kg),一项 Ⅱ 期研究显示罗普斯亭联合 IST 治疗难治 SAA 时,血小板反应率达55%,且三系反应率可达39%3。





参考文献
1.Guidelines for the diagnosis and management of aplastic anemia in China (2022). Chin J Hematol. 2022;43(11):881-888.
2.Scheinberg P, Young NS. How I treat acquired aplastic anemia. Blood. 2012;120(6):1185-1196.
3.Expert consensus on the clinical application of romiplostim (2024 version). J Leukemia Lymphoma. 2024;33(9):519-527.










