 歆语健康发布于 3周前
歆语健康发布于 3周前 收藏专家
收藏专家弥漫大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)作为常见的非霍奇金淋巴瘤亚型,近年来在CD19靶向的CAR-T细胞疗法推动下取得了显著进展。然而,仅有约30%-40%的患者能实现长期完全缓解,多数患者仍面临复发或原发耐药的困境。这种异质性反应的背后,涉及肿瘤细胞内在低免疫原性、T细胞耗竭以及免疫抑制性微环境等多重机制。
传统上认为,EZH2突变通过表观遗传沉默关键基因促进淋巴瘤发生发展,并抑制MHC表达以削弱抗原呈递能力。但最新研究挑战了这一认知,一项发表于《Cancer Cell》的研究1揭示,EZH2抑制不仅可逆转肿瘤免疫逃逸,还能直接增强T细胞功能,从而显著提升T细胞免疫疗法的疗效。
EZH2是组蛋白甲基转移酶,其功能获得性突变常见于生发中心来源的B细胞淋巴瘤,如FL和部分DLBCL。这类突变导致H3K27me3水平升高,进而沉默关键基因表达,使肿瘤细胞减少对T细胞帮助的依赖并逃避免疫监视。尽管EZH2抑制剂已被批准用于复发/难治性FL,但其是否影响免疫微环境尚不明确。
本研究发现,使用EZH2抑制剂处理后的淋巴瘤细胞虽未表现出直接的抗增殖效应,却显著增强了T细胞介导的杀伤作用。体外共培养实验显示,在存在T细胞的情况下,经EZH2抑制剂预处理的tFL-P6淋巴瘤细胞存活率明显下降,且CD8+T细胞数量增加、活化标志物CD44表达上调。进一步的活细胞成像证实,药物处理后淋巴瘤细胞与T细胞之间的接触时间延长,相互作用界面扩大。
转录组分析揭示,EZH2抑制广泛上调了与免疫突触相关的基因,包括黏附分子(Itgb7,Itga7)、共刺激配体(Cd86, Cd80, OX40L, ICOSL)以及趋化因子(Cxcl10, Ccl5)等。更重要的是,MHC I类和II类分子及其抗原呈递通路相关基因(如Tap1, Psmb9)也显著上调。CUT&RUN实验证实,这些基因启动子区域的H3K27me3修饰水平显著降低,表明它们是EZH2的直接靶点。
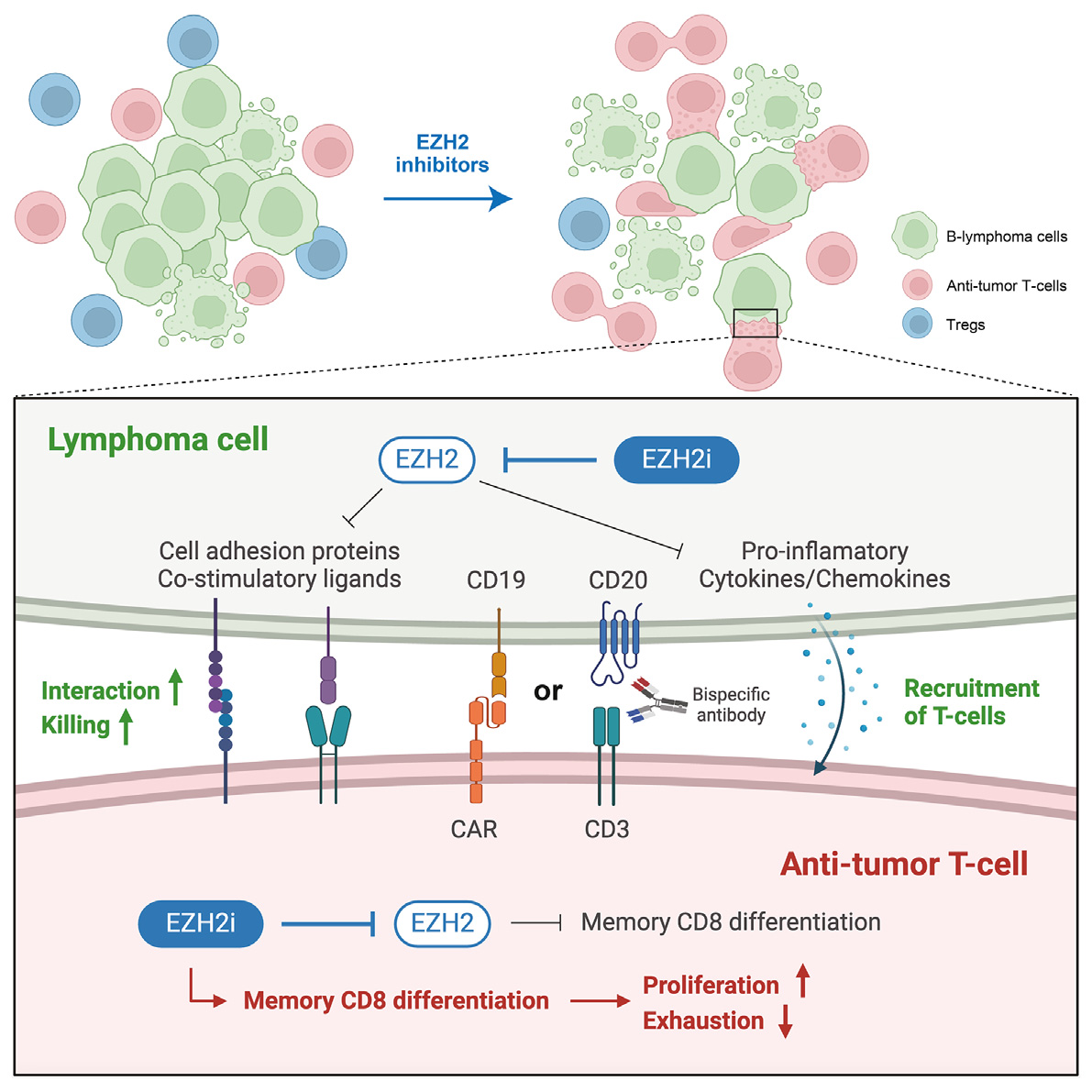
图1:EZH2抑制剂作用机制
鉴于T细胞浸润与功能状态直接影响免疫治疗效果,研究人员进一步评估了EZH2抑制剂联合CAR-T或双特异性抗体的协同潜力。结果显示,无论是在小鼠tFL-P6模型还是人源PDX模型中,EZH2抑制剂预处理均显著增强了CD19 CAR-T细胞对淋巴瘤的杀伤能力,且呈剂量与时间依赖性。
体内双光子活体成像提供了直观证据:在接受CAR-T输注的小鼠中,经EZH2抑制剂预处理的淋巴瘤微环境中,CAR-T细胞的募集数量翻倍,与肿瘤细胞的平均结合时间显著延长,接触表面指数(SEI)亦明显提高。这表明EZH2抑制不仅改变了肿瘤细胞本身,还优化了CAR-T与其靶标的物理互动质量。
此外,联合治疗在多个动物模型中展现出强大抗肿瘤活性。例如,在C57BL/6小鼠中,单独使用CAR-T或EZH2抑制剂仅延缓疾病进展,而两者联用则实现了完全生存与肿瘤排斥;在NSG小鼠携带OCI-LY7细胞的模型中,伐美妥司他(EZH1/2抑制剂)联合CAR-T也显著改善了肿瘤控制。
除了改变肿瘤微环境,EZH2抑制对T细胞自身的调控作用同样关键。已有研究表明,EZH2参与调节调节性T细胞(Treg)维持、效应T细胞扩增及CD8+ T细胞记忆分化。本研究发现,预先接受EZH2抑制剂处理的小鼠来源CAR-T细胞在体内外均表现出更强的扩增能力和持续性。
流式分析显示,经药物处理的CAR-T细胞中终末耗竭PD1+CD38+CD8+ T细胞比例显著降低,同时干细胞样前体耗竭T细胞(CXCR5+)增多,记忆/效应比值趋势上升。功能检测进一步发现,这些CAR-T细胞分泌短效效应因子(如GM-CSF、IFNγ、IL-6)减少,而与记忆T细胞相关的IL-2和TNFα分泌增加,提示其向长寿记忆表型偏移。
更为重要的是,研究者收集了7名接受EZH2抑制剂治疗的B-NHL患者治疗前后血样,发现其CD8+ T细胞中初始和记忆/效应比例显著升高,且后续CAR-T制造过程中的激活、转导效率及分化状态均未受影响。这表明临床剂量下的EZH2抑制不会损害患者T细胞功能,反而可能为其后续接受CAR-T治疗创造更有利的免疫基础。
拓展阅读
一项针对B细胞淋巴瘤的临床前研究2,旨在解决EZH2抑制剂单药治疗中部分患者响应有限、且对DLBCL疗效不佳的临床痛点。研究团队在对EZH2抑制剂不敏感的B淋巴瘤细胞系(U-698-M)中,开展了针对1387个表观调控基因的CRISPR/Cas9敲除筛选,最终锁定组蛋白甲基转移酶DOT1L为关键协同靶点,并在此基础上验证了EZH2与DOT1L抑制剂联合治疗的协同抗肿瘤作用。
机制层面,联合治疗通过三重途径起效:一是表观遗传协同调控,EZH2抑制减少H3K27me3以解除PRDM1、CD138等浆细胞分化基因抑制,DOT1L抑制减少H3K79me2以下调MYC、E2F1等细胞周期基因,同时上调CDKN1A/p21阻断增殖;二是免疫微环境重塑,激活IRF7、CIITA等干扰素通路基因,恢复EZH2突变型细胞中MHCI/II抗原呈递基因低表达,改善肿瘤免疫逃逸;三是协同诱导B细胞向浆细胞分化及肿瘤细胞凋亡。
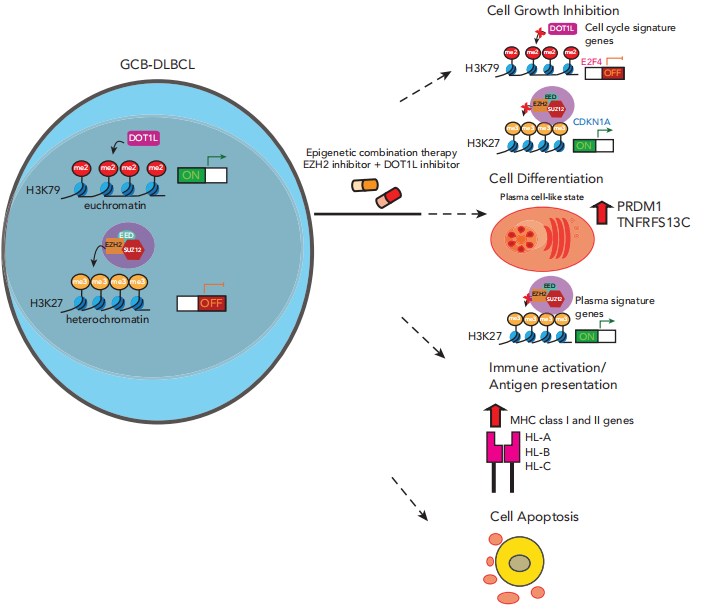
本研究系统性地揭示了EZH2抑制剂在淋巴瘤免疫治疗中的双重增效机制:一是通过去抑制免疫突触相关基因,增强肿瘤免疫原性;二是通过调控T细胞分化命运,防止耗竭并促进记忆形成。这一发现打破了“靶向药物仅作用于肿瘤细胞”的传统思维,凸显了表观遗传药物在重塑整个抗肿瘤免疫生态中的独特价值。
尤其值得强调的是,该效应独立于EZH2突变状态,意味着更多非突变患者也可能从中受益。此外,临床前数据已迅速转化为两项正在进行的临床试验(NCT05934838和NCT05994235),体现了基础研究向临床转化的高效闭环。
参考文献
1.Isshiki Y, et al. Cancer Cell. 2025;43(1):49-68.e9.










