外周T细胞淋巴瘤(PTCL)是一组罕见且异质性极强的非霍奇金淋巴瘤,在中国占比达25%-30%。尽管近年来分类体系不断精细化,如WHO-HEM 2022与国际共识分类(ICC)已定义出超过30种亚型,但其整体预后依然堪忧。长期以来,临床实践依赖于源自B细胞淋巴瘤的CHOP或CHOP-like方案,然而这类“经验性外推”的治疗策略并未带来理想疗效,反而因毒性累积和复发率高而饱受诟病。
尽管数十年来学者尝试通过在CHOP基础上叠加新药(即“CHOP-plus”策略)提升疗效,但绝大多数III期试验未能证实显著生存获益。根据文献中汇总的多项临床研究数据,包括罗米地辛-CHOP、阿仑单抗-CHOP、来那度胺-CHOP等方案,尽管部分显示出较高的完全缓解率(CR),但在无进展生存期(PFS)和总生存期(OS)方面均未实现突破性改善。
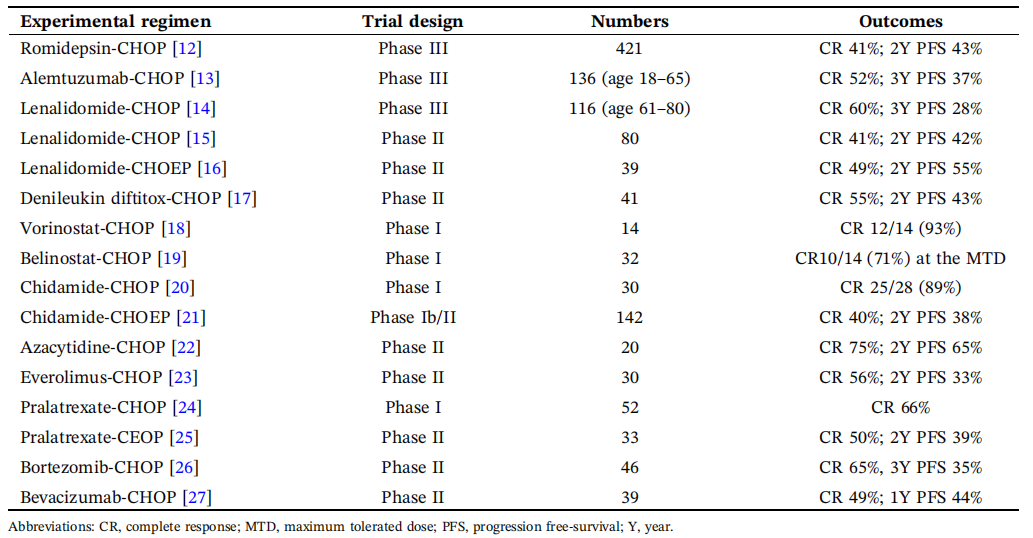
表1:CHOP-plus相关临床研究
ECHELON-2的成功不可复制?
它揭示的是精准医学的普适逻辑
相比之下,ECHELON-2试验成为少数成功的例外。该研究将维布妥昔单抗(BV)替代长春新碱,组成BV-CHP方案,用于CD30阳性PTCL患者。结果显示,相较于传统CHOP,BV-CHP显著提高总体反应率(ORR 82% vs. 72%,p=0.0032)、完全缓解率(CRR 68% vs. 56%,p=0.0066),并改善PFS与OS。
其成功的关键并非仅因药物本身,而是两大科学决策:一是精准限定人群,超过70%为间变性大细胞淋巴瘤(ALCL),尤其是ALK阳性者获益最明显;二是实现剂量完整,移除长春新碱避免神经毒性叠加,确保BV可按推荐剂量给药。这种“靶向药+去毒骨架”的设计理念,打破了“必须保留CHOP四药”的思维定式。
面对传统化疗的局限,研究者开始探索去化疗(chemotherapy-free)方案的可能性。其中,口服阿扎胞苷联合罗米地辛的组合在初治T细胞淋巴瘤患者中展现出令人鼓舞的数据:ORR达70%,CRR达50%;而在TFH来源的亚型中,ORR高达80%,CRR达67%。
更重要的是,这些疗效是在避免传统细胞毒药物的前提下实现的,意味着更低的骨髓抑制和感染风险,尤其适合老年或体弱患者。研究者指出,由于TFH相关亚型(如AITL)普遍存在表观遗传调控异常(如TET2、DNMT3A突变),因此对去甲基化药物与组蛋白去乙酰化酶抑制剂(HDACi)高度敏感,构成理想的治疗靶点。
拓展阅读
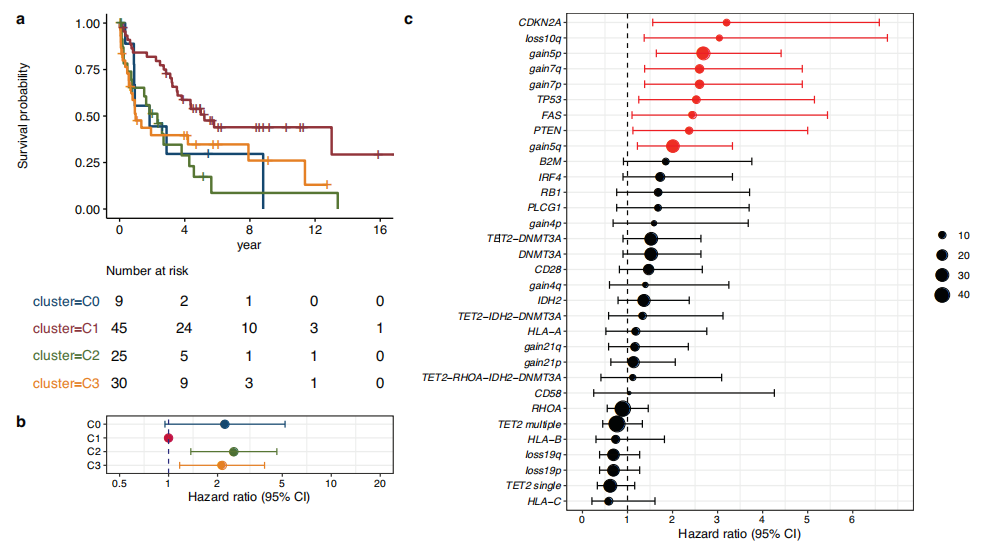
一项多组学整合研究2,针对外周T细胞淋巴瘤(PTCL)高度异质性导致的预后分层困难问题,纳入129例PTCL患者(含94例结节型T滤泡辅助细胞淋巴瘤[nTFHL,其中85例为血管免疫母细胞T细胞淋巴瘤(AITL)]、35例PTCL-非特指型[PTCL-NOS]),通过全外显子测序(WES)解析肿瘤遗传特征,结合RNA测序与CIBERSORTx技术分析肿瘤微环境(TME)中免疫细胞组成,实现了“遗传-微环境”双维度的系统分层。
研究先通过非负矩阵分解聚类,将PTCL划分为4种遗传亚型:C0(10例,无反复遗传异常)、C1(57例,84%为nTFHL,以TET2、RHOA等TFH相关突变为核心,基因组稳定,预后最佳)、C2(28例,32%为nTFHL,多为PTCL-NOS,伴CDKN2A、TP53等抑癌基因缺失及染色体不稳定,肿瘤突变负荷最高,预后最差,HR=2.52)、C3(34例,94%为nTFHL,虽含TFH相关突变,但额外携带高频IDH2突变[67.6%]及5号染色体扩增[55.9%],预后中等偏差,HR=2.14);同时基于免疫细胞比例将TME分为3型:TME1(B细胞、TFH细胞富集,几乎全为AITL)、TME2(巨噬细胞尤其M2型富集,预后最差,HR=3.4)、TME3(活化肥大细胞、原始CD4+T细胞富集,预后较好)。
关键在于,遗传亚型与TME亚型呈现高度特异性关联:预后最佳的C1中80.8%对应TME3,预后最差的C2中64.3%对应TME2,这种“不良遗传特征+不良微环境”的组合会进一步放大预后风险;此外,TET2突变的克隆结构也影响预后,TET2与RHOA突变的变异等位基因频率比≥1.55的患者,总生存期显著缩短(p=0.017)。最终研究建立“遗传亚型-TME亚型”关联框架,既揭示了PTCL预后差异的分子机制,也为临床精准分层(如识别C2+TME2高危患者)和亚型特异性治疗(如针对C3的IDH2抑制剂、针对TME2的巨噬细胞靶向干预)提供了明确依据。
PTCL的治疗正在经历一场静默革命。过去二十年的“CHOP-plus”模式虽充满探索精神,却大多止步于无效叠加。ECHELON-2的成功不是终点,而是一面镜子,映照出生物学合理性与临床设计智慧相结合的巨大价值。如今,随着分类系统日趋精细、基因检测普及、靶向药物涌现,我们已具备转向“精准医学”的条件。
然而挑战依旧严峻,疾病罕见导致大规模试验难开展;亚型众多要求多中心协作;表观遗传疗法虽前景广阔,但仍需III期证据确证其地位。正在进行的TRANSCRIPT和JCOG2210等随机研究或将明确自体移植的角色,而更多生物标志物驱动的临床试验亟待启动。
参考文献:
1.Yoon SE, et al. Hematol Oncol. 2025;43 Suppl 2(Suppl 2):e70069.












