 歆语健康发布于 1天前
歆语健康发布于 1天前 收藏专家
收藏专家在原发性免疫性血小板减少症(ITP)的治疗领域,海曲泊帕作为新型促血小板生成素受体激动剂(TPO-RA),展现出显著潜力,已被纳入权威指南推荐用药行列。但面对ITP治疗领域的两大挑战:一线治疗的应答持续性不足,以及复发/难治性患者的治疗选择有限,海曲泊帕是否能为临床提供更优解,成为关注焦点。鉴于ITP发病机制复杂,治疗时需兼顾患者个体差异、疾病严重程度以及治疗风险与效益平衡。然而,一味加大剂量虽然可能提升疗效,却也可能增加毒副作用风险,加重经济负担,造成资源浪费。因此,基于前瞻性研究数据,探讨海曲泊帕在不同ITP患者群体中的治疗获益与最优用药策略,具有重要的临床指导价值。与此同时,在即将召开的2025 EHA大会中,多项相关研究数据率先公布,这些最新数据或将为其临床应用提供更加坚实的证据支持。

新诊断ITP患者中的联合治疗新突破
在2025年EHA大会上公布了一项海曲泊帕联合大剂量地塞米松(HD-DXM)一线治疗新诊断ITP的多中心、前瞻性研究数据(摘要号:PB3678)1,这项研究共纳入19例患者,所有患者接受海曲泊帕5mg/天(当PLT≥100×109/L后逐渐减量)联合HD-DXM(40 mg/天,第 1-4天)治疗。研究结果显示,患者在治疗后第5天总体血小板应答率便高达84.2%,
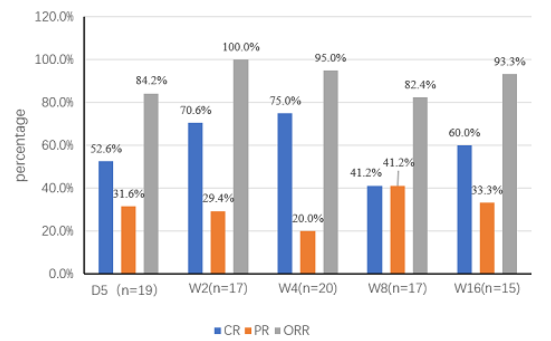
图1. 研究期间达到主要终点与次要终点的患者比例
在安全性方面,治疗期间患者无任何≥2级出血事件发生并且无血小板输注需求,亦没有观察到严重治疗相关不良反应发生,表明海曲泊帕联合传统标准一线治疗(大剂量地塞米松)还能有效降低患者治疗期间的出血风险和输注需求,为患者提供更高的临床获益。
拓展阅读:
根据海曲泊帕说明书推荐,成年ITP患者的常规起始剂量为2.5mg/天,但对于存在严重出血症状或需要快速提升血小板计数的患者,临床可考虑将起始剂量提高至5.0mg/天。并且在治疗过程中,剂量还可根据患者个体反应及血小板计数进行灵活调整,范围通常在2.5 mg至7.5 mg之间。上述研究患者便采用了5mg/天起始剂量并配合"达标减量"的剂量调整方案,以实现个体化的治疗目标。该策略不仅有助于在早期迅速达标、优化疗效,也可能在一定程度上降低停药后的复发风险。
复发/难治性ITP患者中的治疗探索
在ITP治疗中,复发/难治性ITP患者一直是最具挑战的群体之一,不仅多数难治性患者难以实现TPO-RA的成功停药,一旦停药往往还会迅速复发。因此,如何通过治疗策略的优化进一步提高TPO-RA的应答率和疗效持续时间,成为当前研究和临床关注的重点,而联合治疗策略,或许为这一目标提供了新的突破。
拓展阅读:
哺乳动物雷帕霉素靶蛋白(mTOR)是一种分子量约289 kDa、结构保守的丝氨酸/苏氨酸蛋白激酶,属于PI3K相关激酶家族。mTOR在细胞生物学中发挥多重关键作用,既能调控细胞生长、增殖和分化,又参与细胞自噬、脂质代谢及蛋白质合成等多种生命活动。mTOR的经典抑制剂——雷帕霉素(又称西罗莫司)为一种大环内酯类免疫抑制剂,除具有免疫抑制作用外,还兼具抗炎、抗肿瘤、神经保护、抗衰老、抗病毒及抗纤维化等多重药理学效应。在免疫性血液病的治疗中,西罗莫司主要通过调控淋巴细胞亚群实现免疫调节作用。根据我国相关专家共识,西罗莫司被推荐用于成人复发/难治性ITP的治疗(证据等级2b,推荐强度B);而在儿童慢性ITP患者中,西罗莫司的使用不仅可减少激素暴露,还具有良好的安全性(证据等级2b,推荐强度B)5。
TPO-RA类药物的血栓风险争议
——海曲泊帕分子结构优化、安全性更优
血栓风险一直是TPO-RA类药物广泛应用过程中的安全性焦点。TPO-RA在促进血小板生成的同时,可能增强血小板活性,从而带来潜在的血栓形成风险。值得注意的是,ITP患者本身也可能存在一定程度的血栓形成倾向,因此在治疗过程中需更加审慎权衡患者的获益与风险。2025 EHA大会中一项研究系统评估了TPO-RA类药物对血小板活化以及血栓形成的影响(摘要号:PS2268)6,研究结果显示艾曲泊帕、海曲泊帕、阿伐曲泊帕以及罗普司亭均可增强小鼠模型中血小板的活化及血栓形成功能,但并未观察到这些药物会增加动脉损伤后血管完全闭塞的风险。这一发现提示,尽管TPO-RA具有一定促凝潜力,但在一定范围内并不增加动脉血栓发生风险。
此外,基于既往的一项荟萃分析结果,海曲泊帕在同类药物中表现出相对更低的血栓风险。在总体血栓发生率方面,海曲泊帕仅为0.3%,远低于艾曲泊帕(2.1%)、阿伐曲泊帕(3%)和罗普司亭(3%)7。在动脉血栓发生率方面,海曲泊帕为0.1%,而艾曲泊帕、阿伐曲泊帕和罗普司亭分别为0.5%、0.8%和1.5%;静脉血栓发生率方面,海曲泊帕的发生率同样最低(0.1%),其他药物分别为0.8%、2.1%和1.1%。上述这些数据表明,尽管TPO-RA类药物普遍具有一定的血栓风险,但不同药物之间的安全性存在一定差异,其中,海曲泊帕在血栓风险方面更具优势,提示其或许是高风险ITP患者长期管理的更优选。
拓展阅读:
除安全性更优外,海曲泊帕在升板机制上同样具有一定优势。相较于艾曲泊帕,海曲泊帕在保留关键金属螯合区域相互作用的基础上,增大疏水性片段苯环上的取代基基团,提升亲脂性;使用呋喃环替换联苯结构中的末端苯环,增强羧酸片段酸性,进而提高药物活性。
观点评述
综合2025 EHA大会公布的最新研究数据与既往临床证据,海曲泊帕在ITP治疗中的临床应用正不断拓展并优化,逐步展现出其在个体化管理中的优势。作为一种口服TPO-RA,海曲泊帕的剂量调整具有高度灵活性,5 mg被广泛采用为标准起始剂量,同时也可根据患者的疾病严重程度和治疗反应等,在2.5 mg至7.5 mg之间灵活调整。
研究显示,5mg的起始剂量在大多数ITP患者中具有起效快、应答率高的优势,不仅可有效提升患者血小板水平、降低出血风险,同时在安全性方面也表现良好。对于复发/难治性患者,海曲泊帕联合免疫抑制剂如西罗莫司的治疗策略也显示出快速、持续的疗效,进一步体现了其在既往多线治疗失败人群中的潜在应用价值。值得关注的是,对于出血风险极高的患者,初始采用7.5mg剂量可能带来更强效且稳定的升板效果,且研究数据支持这一剂量的良好耐受性与安全性,但未来仍需结合临床研究进一步验证。总体而言,随着研究的不断深入,海曲泊帕有望在ITP治疗策略中发挥更加核心的作用。
参考文献:
1.Hua chao Zhu, et al. 2025 EHA, Abstract: PB3678.
2.中华医学会血液学分会血栓与止血学组.中华血液学杂志,2020,41(08): 617-623.
3.Mei H, et al. Ann Transl Med. 2022;10(2):30.
4.Yimei Feng, et al. 2025 EHA, Abstract:PF1253.
5.冯一梅,等.临床血液学杂志,2025,38(05):327-334.
6.Fan Zhou, et al. 2025 EHA, Abstract: PS2268.
7.Dong Y, et al. Thromb J. 2023;21(1):69.
8.Xie C, et al. J Cell Mol Med. 2018 Nov;22(11)5367-5377.










