重型再生障碍性贫血(SAA)患者面临骨髓衰竭的生死威胁,单倍体造血干细胞移植(haplo-HSCT)已成为缺乏全相合供者的救命选择。但移植后感染、移植物抗宿主病(GVHD)等并发症仍是生存的"拦路虎"——究竟哪些患者更易遭遇风险?
传统评估体系在SAA领域存在空白,而造血干细胞移植合并症指数(HCT-CI)此前多在恶性血液病中验证。北京大学血液病研究所团队首次将这一工具用于530例SAA移植患者,发现并发症评分每增加1分,5年生存率阶梯式下降:低危组(0分)达91.8%,而≥2分的高危组骤降至70.1%。
更关键的是,研究揪出两个独立风险因素:既往ATG治疗会使死亡风险增加85%,而≥40岁的供者则让无GVHD/移植失败生存率下降44%。这些发现将如何改变临床实践?今天带您深度解析这项发表于《Bone Marrow Transplantation》的重磅证据。
通过回顾性分析2006-2022年530例接受单倍体移植的SAA患者,研究者按HCT-CI评分分为三组:低危组(0分,n=343)、中危组(1分,n=126)和高危组(≥2分,n=61)。5年总生存率(OS)呈现显著阶梯差异:低危组91.8% → 中危组83.3% → 高危组70.1%(P<0.001),组间最大差距达21.7%。更严峻的是,衡量长期疗效的"无GVHD/移植失败生存率"(GFFS)同样随评分升高而降低(80.1%→71.3%→63.6%,P=0.009)。多因素分析确认:HCT-CI评分≥2分的患者死亡风险是0分者的3.47倍(HR=3.47, 95%CI 1.87-6.44)。图1.依据HCT-CI分层,低、中、高危组的OS与GFFS拓展阅读
HCT-CI评分体系的临床价值源于其精细化的合并症量化能力。该指数由Sorror等于2005年首次提出,覆盖17类移植前合并症。其中:
1分项目:心律失常、心脏病、炎症性肠病、糖尿病、脑血管病、精神障碍、轻度肝病、肥胖和感染9类
2分项目:风湿性疾病、消化性溃疡、中重度肾功能不全和中重度肺病4类
3分项目:重度肺病、心脏瓣膜病、实体瘤史、中重度肝病
本研究发现,肝病和感染是SAA患者最主要的失分项。23%高危患者存在铁蛋白≥2000 ng/ml(提示铁过载相关肝损伤),45.9%有≥40单位红细胞输注史(增加感染风险)。这些发现为优化预处理方案提供依据:研究中对HCT-CI≥3分者更多采用含氟达拉滨的减毒方案(Bu/Flu/Cy/ATG),以降低脏器毒性。
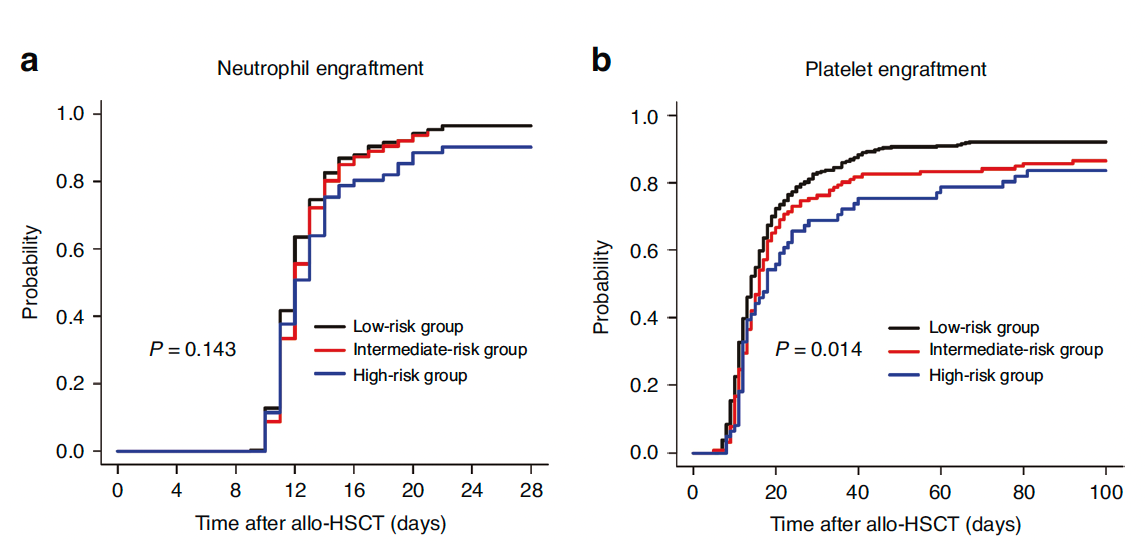
并发症负担最先体现在造血重建环节。虽然三组中性粒细胞植入率无显著差异(96.5% vs 94.4% vs 90.2%, P=0.143),但高危组的100天血小板植入率显著降低8.5个百分点(92.1%→83.6%, P=0.014)。进一步回归分析显示,HCT-CI评分≥2分是血小板植入不良的独立风险因素(HR=0.74, P=0.049),即HCT-CI≥2分使血小板植入失败风险上升26%。这种差异可能源于合并症对巨核细胞分化和骨髓微环境的损害,尤其需警惕评分≥2分患者的移植失败风险——该组移植失败相关死亡率达6.6%,显著高于低危组的1.5%(P=0.047)。图2. allo-HSCT后中性粒细胞植入(a)和血小板植入(b)情况
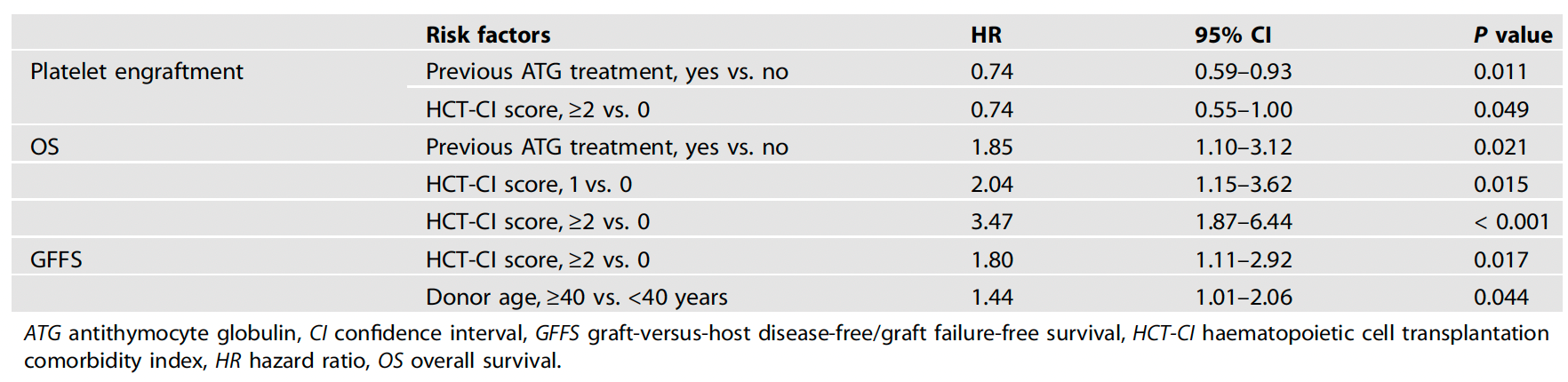
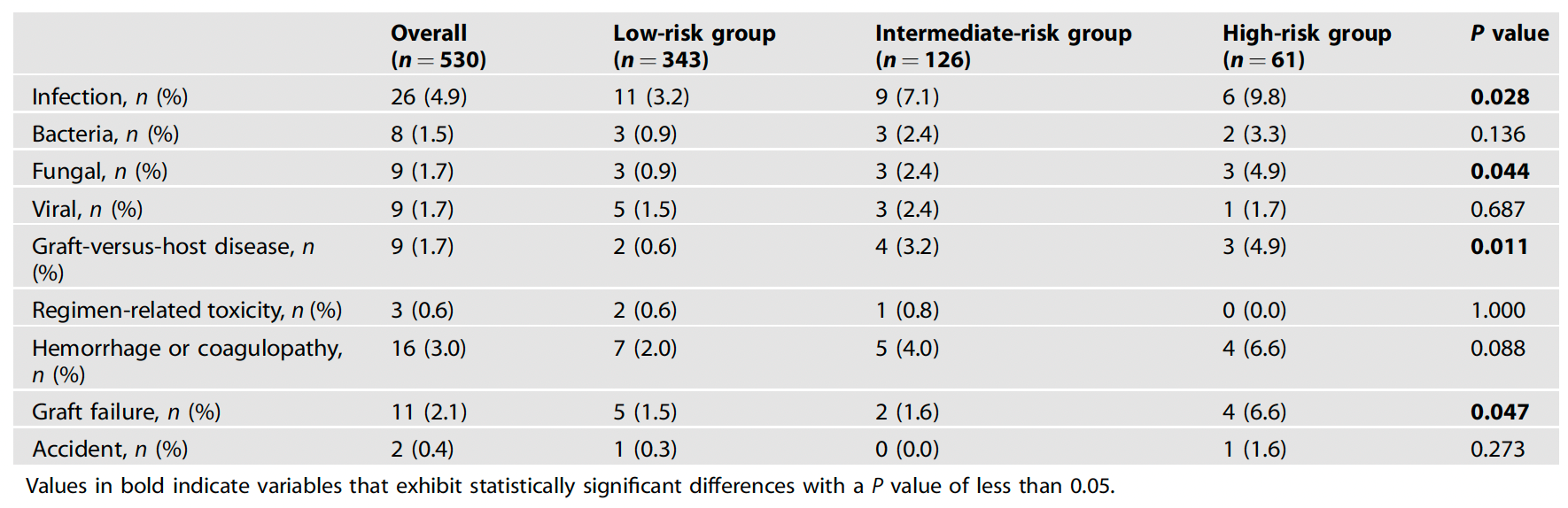
影响Haplo-HSCT的两大独立风险因子:ATG治疗史与供者年龄≥40岁除HCT-CI评分外,多变量模型锁定两个关键风险因素:既往ATG治疗史与供者年龄≥40岁。多变量分析显示,移植前接受ATG治疗的患者,死亡风险增加85%(HR=1.85, P=0.021)。该人群在高危组占比达21.3%,高于低危组的16.9%。另外,≥40岁供者导致移植失败/GVHD风险增加44%(HR=1.44, P=0.044)。这与供体造血干细胞质量下降相关,依据研究显示≥40岁供者的CD34+细胞增殖能力显著减弱。意外发现:传统关注因素如HLA错配(3个位点错配占80.4%)、ABO血型不符(47.4%)未显著影响生存。表1. 多变量分析的血小板植入、OS与GFFS的危险因素67例死亡患者中,感染占38.8%(n=26;8例细菌感染、9例真菌感染和9例病毒感染)。不仅如此,随HCT-CI评分递增,死亡率逐渐递增(低危组3.2% → 中危组7.1%→高危组9.8%, P=0.028)。更严峻的是,高危组真菌感染相关死亡率达4.9%,是低危组(0.9%)的5.4倍(P=0.044)。另外,高危组的GVHD相关死亡率观察到类似的情况(低危组0.6% →高危组4.9%,P=0.011)。本研究首次证实HCT-CI评分在SAA单倍体移植中的预后价值,其核心启示有三。首先,分层管理迫在眉睫:≥2分患者5年生存率仅70.1%,这类人群需更密集的移植后监测,尤其要防范真菌感染(占该组死亡原因的34.6%)。其次,供者选择新标准:供者年龄≥40岁使治疗失败风险增加44%,提示对高合并症负荷患者应优先选择年轻供者,挑战了传统"亲属供者优先"原则。最后,ATG治疗再审视:既往接受ATG治疗者死亡风险增加85%,或提示免疫治疗史可能影响移植耐受性。
然而,本研究仍存在一定的局限:单中心回顾性设计可能引入偏倚;28.3%患者缺失铁蛋白和输血史数据;东西方合并症谱差异(如零例肾脏疾病)可能限制评分普适性。随着单倍体移植在SAA治疗中应用日益广泛,本研究为建立风险适应性治疗策略提供了关键循证依据。未来可探索HCT-CI评分与生物标志物的联合预测模型,进一步提升预后预判精准度。参考文献:
1.Lin MH, et al. Bone Marrow Transplant. 2025 Feb 13.
2.Sorror ML, et al.Blood. 2005;106:2912–9.
3.Mo XD, et al. Am J Hematol. 2013;88:497–502.
 歆语健康发布于 2天前
歆语健康发布于 2天前 收藏专家
收藏专家