 歆语健康发布于 3天前
歆语健康发布于 3天前 收藏专家
收藏专家免疫性血小板减少症(ITP)是一种自身免疫性出血性疾病,其特点是血小板破坏增加以及生成减少。尽管目前对ITP的病理机制已有一定认识,但该疾病的异质性,即患者在发病机制、临床表现和治疗反应方面的巨大差异仍是临床和研究中的难点。肠道菌群作为新兴研究领域,正逐渐揭示其在ITP病理生理中的关键作用。本文结合最新研究证据,系统阐述肠道菌群在ITP病理机制中的潜在作用。
免疫耐受丧失是ITP发生和发展的基础
ITP的发病始于免疫耐受的丧失,表现为调节性T细胞(Tregs)、髓系抑制细胞(MDSCs)等抑制性免疫细胞功能缺陷。例如,活动性ITP患者的MDSCs数量减少且糖皮质激素受体(GR)表达降低,导致其免疫抑制功能受损。Treg缺陷进一步促进滤泡辅助性T细胞(Tfh)活化,驱动B细胞分化为产生抗血小板自身抗体(如抗GPIIb/IIIa、GPIb/IX)的浆细胞,这些自身抗体通过Fcγ受体介导血小板吞噬和补体激活,加速血小板清除。
值得注意的是,部分ITP患者缺乏可检测的自身抗体,其血小板破坏依赖CD8+T细胞的直接杀伤作用。终末分化效应记忆T细胞(TEMRA)在慢性ITP患者中克隆性扩增,通过分泌干扰素γ和颗粒酶B诱导血小板凋亡,与疾病难治性密切相关。此外,补体系统异常(如C3b包被血小板)在ITP中普遍存在,且补体激活程度与治疗应答呈负相关,提示不同亚型ITP的病理机制存在根本差异。
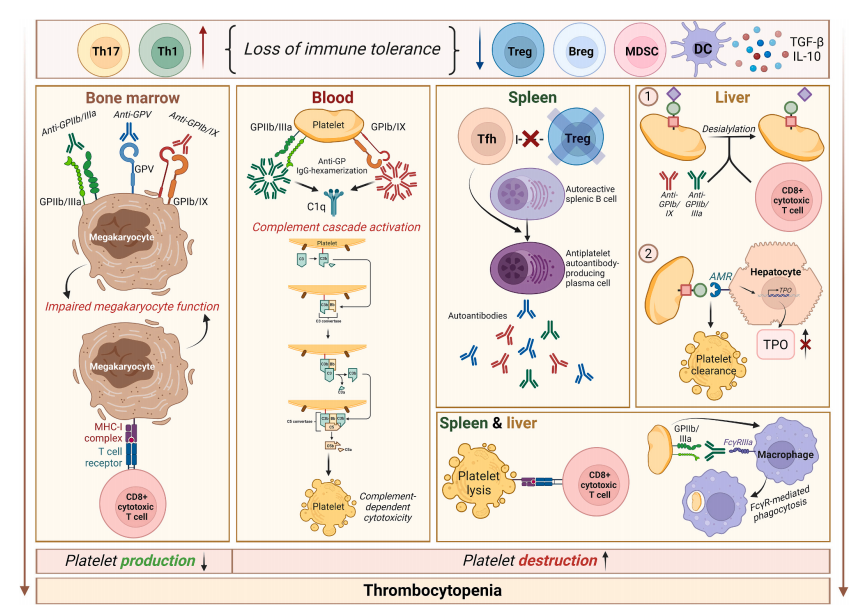
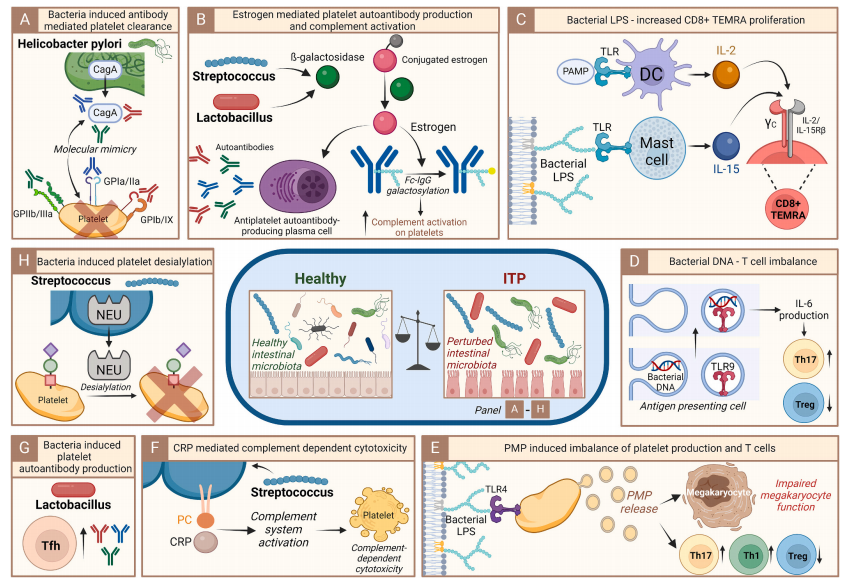
肠道菌群扰动是ITP异质性的关键驱动因素
现有研究显示,ITP患者肠道菌群呈现“有益菌减少、致病菌富集”的特征:拟杆菌门丰度下降,而变形菌门(如链球菌、假单胞菌)和厚壁菌门(如瘤胃球菌)增加。肠道菌群与免疫系统相互作用路径可能有以下几点:
1. 分子模拟与自身抗体诱导:肠道菌群通过抗原模拟触发自身免疫反应。例如,H. pylori 的CagA蛋白与血小板表面糖蛋白结构同源,激活B细胞产生自身抗体;乳杆菌属表达的β-半乳糖苷酶可促进雌激素重吸收,增强B细胞活性并诱导IgG Fc段半乳糖基化,进而通过补体依赖途径加剧血小板破坏。
2. 炎症因子与T细胞极化:革兰氏阴性菌释放的脂多糖(LPS)通过激活血小板TLR4受体,诱导血小板微颗粒(PMPs)释放。PMPs携带的miRNA和线粒体DNA可干扰骨髓巨核细胞功能,并通过诱导Th1/Th17细胞极化、抑制Treg细胞功能,破坏免疫平衡。此外,肠道致病菌通过TLR9途径诱导IL-6等促炎细胞因子分泌,驱动Th17细胞过度活化,与ITP的炎症恶性循环密切相关。
宏基因组学显示,拟杆菌属、乳杆菌属丰度与治疗应答正相关,而链球菌属、假单胞菌属与疾病活动度负相关。孟德尔随机化研究已确定7个微生物类群(如阿克曼菌、戈登氏菌)与ITP存在因果关联,有望作为风险预测标志物。结合代谢组学(如短链脂肪酸水平),可建立多维度菌群诊断模型。
现有研究多为横断面观察,缺乏纵向数据验证菌群因果性;动物模型与人类菌群差异显著,机制转化需谨慎。未来需通过多组学技术(基因组、转录组、代谢组)解析菌群-免疫-血小板相互作用的动态网络,并开展大规模临床队列研究验证菌群干预的安全性和有效性。
拓展阅读
TLR抑制剂可能成为ITP患者新的治疗选择
研究表明,ITP患者存在单核/巨噬细胞极化失衡和骨髓间充质干细胞(BMSCs)功能障碍。高迁移率族蛋白1(HMGB1)通过激活TLR4/MyD88信号通路,影响BMSCs的免疫调节功能,进一步加剧巨噬细胞向促炎性M1型的极化,导致血小板生成受损。在小鼠模型中,使用TLR4抑制剂可以恢复BMSCs的调节能力,减轻巨噬细胞极化失衡,改善血小板功能2。
TLR抑制剂虽然尚未应用于ITP的治疗,但其已经在多种自身免疫性疾病中显示出免疫调节作用的应用潜力,有望为ITP患者带来新的治疗选择。
总结
免疫性血小板减少症(ITP)的异质性长期困扰着临床医生和患者。近年来的研究逐步揭示,除传统的免疫耐受破坏、自身抗体生成和细胞毒性攻击等机制外,肠道菌群作为免疫调节的重要参与者,正在成为解读ITP复杂病理的重要突破口。菌群的失衡不仅影响T细胞极化、B细胞活性和补体系统的激活,还通过代谢通路、微粒释放、性激素调控等多个维度深度嵌入ITP的发生与进展之中。展望未来,肠道菌群或将成为ITP精准医疗的重要抓手。从诊断分型,到疗效预测,再到菌群移植、益生菌补充等干预手段的尝试,基于微生态调控的治疗策略有望为难治性ITP患者带来全新的解决方案。
参考文献
1.Schoenaker JM, et al Blood Rev. 2025 Jan;69:101252.
2.Liang Z, et al. Br J Haematol. 2024 Oct;205(4):1516-1531.










