免疫性血小板减少症(ITP)患者当前的治疗之路布满荆棘。现有的治疗方案都存在局限性,且患者异质性大,治疗反应难以预测,部分患者疗效不佳,甚至可能面临严重副作用,如糖皮质激素带来的代谢紊乱等。同时复发率高,长期治疗经济负担沉重。在此困境下,探寻新型治疗预测手段迫在眉睫。
长久以来,我们都在探索更有效的ITP治疗方案。近期发表在《British Journal of Haematology》上的一篇研究揭示了:通过血小板-单核细胞复合物(PMCs)和单核细胞IL-10分泌水平能够预测TPO-RAs治疗反应,这一发现不仅深化了我们对血小板生成素受体激动剂(TPO-RA)作用机制的理解,也为临床个体化治疗提供了新的生物标志物。
TPO-RAs在ITP治疗中优势显著且机制多样
ITP的现有治疗选择包括糖皮质激素、静脉注射免疫球蛋白(IVIG)、抗D免疫球蛋白,以及利妥昔单抗、脾切除和TPO-RAs等后续方案。然而,由于个体差异大,亟需新型生物标志物来预测治疗反应。
该研究中提出,TPO-RAs在ITP治疗中具有显著优势,其有效率可达80%,且耐受性良好,通常在用药后7-10天即可起效,且无需长期维持治疗。TPO-RAs的作用机制主要包括两方面:一是直接促进巨核细胞增殖分化,从而增加血小板生成;二是发挥免疫调节作用: TPO-RAs能够降低血小板自身抗体水平、增强调节性B细胞功能、诱导巨噬细胞向抗炎表型转化,同时还可提升循环中调节性T细胞(Treg)的活性和数量。
拓展阅读:
Treg细胞在ITP的发病及治疗中扮演着关键角色。ITP是一种由自身免疫介导的血小板破坏增加和生成减少所致的出血性疾病,而Treg作为免疫抑制性细胞,通过抑制效应T细胞和自身反应性B细胞的活化,维持免疫耐受。研究表明,ITP患者外周血及脾脏中的Treg数量及功能显著降低,导致免疫稳态失衡,进而加剧血小板破坏。
在ITP治疗中,促进Treg的增殖与功能恢复已成为潜在策略,例如,糖皮质激素、IVIG及TPO-RAs等治疗部分通过上调Treg数量与功能发挥作用。此外,新兴的免疫调节疗法如低剂量IL-2、雷帕霉素等,直接靶向Treg扩增与功能增强,显示出良好的临床前景。未来研究需进一步明确Treg在ITP动态循环中的调控机制,并优化以Treg为核心的个体化治疗策略,从而为难治性ITP患者提供更有效的治疗方案。
单核细胞-血小板复合物作为艾曲泊帕治疗反应的预测标志物
Osuna-Gómez等人的研究探讨了单核细胞-血小板复合物作为ITP患者艾曲泊帕临床应答预测指标的潜力。研究发现,艾曲泊帕治疗后,血小板计数的升高伴随着外周血中血小板与淋巴细胞、单核细胞及中性粒细胞结合比例的上升。通过回归树模型分析,治疗前及治疗2周时血小板结合的单核细胞百分比被确定为持续反应的预测指标。此外,与无反应者相比,反应者的血小板结合单核细胞中抗炎细胞因子IL-10的表达显著增加,而TNF-α等促炎因子未见类似变化。
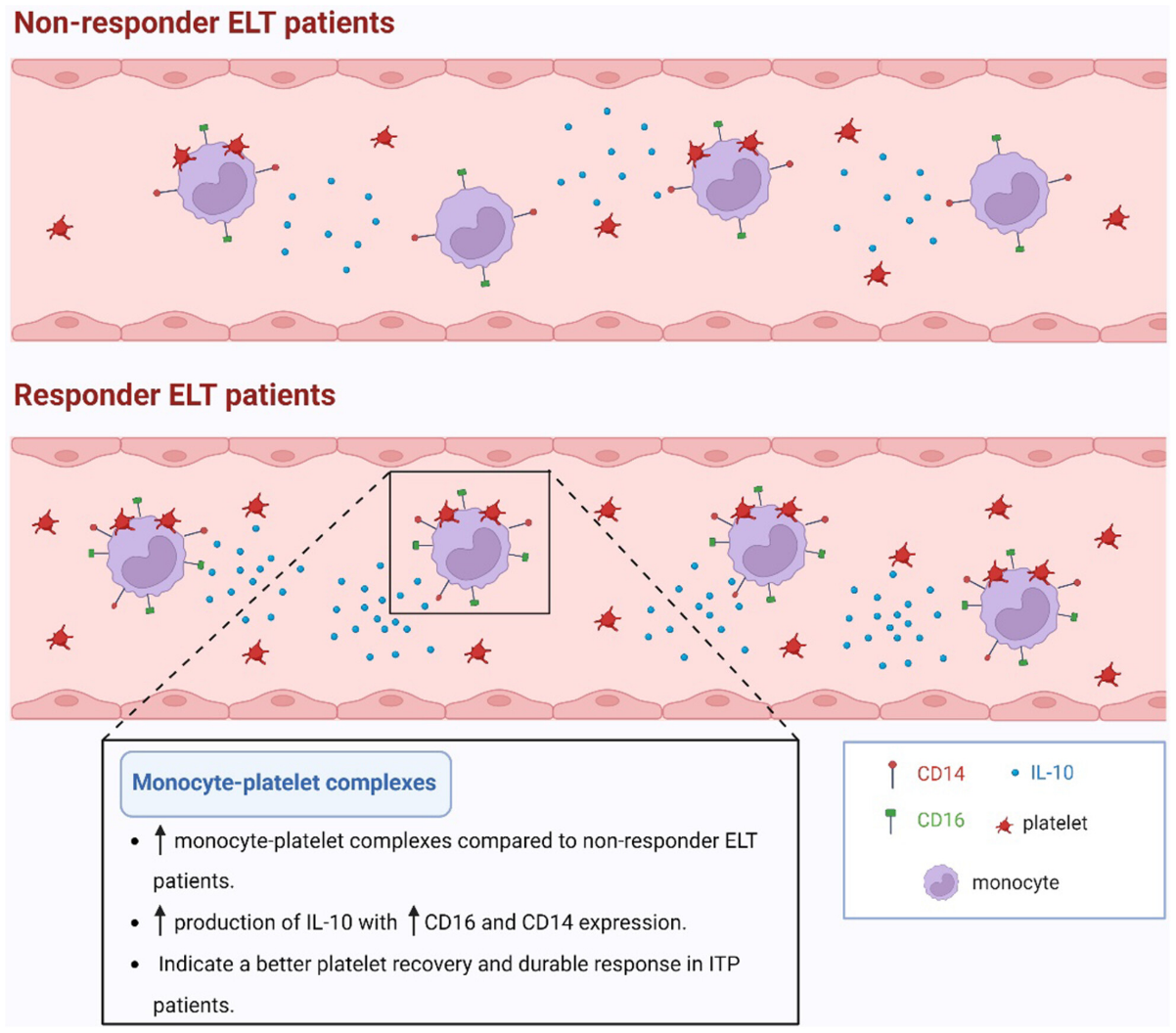
图1.在对艾曲波帕有反应的ITP患者的外周血中,与无反应患者相比,具有结合血小板 (PLT)的单核细胞的百分比更高。与没有结合PLT的单核细胞相比,这些具有结合PLT的单核细胞显示出L-10产生增加,CD16和CD14表达升高。这表明ITP患者的血小板恢复更好,反应更持久
观点评述
近年来ITP治疗领域正经历着革命性变革。循环单核细胞-血小板复合物的检测有望成为预测艾曲泊帕疗效的无创工具,但其临床应用仍需后续研究支持。未来工作应聚焦于血小板介导的免疫调节网络,尤其是其对免疫耐受重建的作用,以优化ITP的个体化治疗策略。
目前,ITP治疗已从传统的激素、静脉注射免疫球蛋白等非特异性免疫抑制,逐步转向靶向性更强、机制更明确的精准治疗模式,TPO-RAs已成为临床上的重要选择。随着对ITP发病机制认识的深入,陆续有针对新靶点的治疗药物进入临床,我们不仅要掌握这些药物的适应症,还得在治疗中平衡疗效与安全性,特别是关注血栓风险、肝功能异常等不良反应,为每位患者制定最优化的治疗方案。

参考文献
1.Kapur R, et al. British journal of haematology, 2025,206(4):1253–1255.
2.Osuna-Gómez R, et al. Br J Haematol. 2025;206(4):1200-1212.
3.Semple JW, et al. Curr Opin Hematol. 2020;27(6):423-429.
4.Nelson VS, et al. Cells. 2021;10(11):3235.












