免疫性血小板减少症(ITP)长期以来被视为免疫系统紊乱引发的疾病,其典型特征是血小板数量降低以及出血倾向加剧。ITP发病机制涉及自身抗体生成以及T细胞介导的免疫紊乱。近年研究发现,在免疫攻击下,部分与血小板相关的细胞通过基因转变获取“生存之道”,试图维持血小板功能。但这种转变利弊兼具,短期内或许能缓和病情;然而,从长期来看却可能导致患者因基因不稳定引发新状况,让病情更复杂。临床上众多ITP患者体内细胞存在隐匿的基因改变,这不仅造成了ITP患者临床表现的异质性,还干扰药物疗效,进而影响治疗成败与患者预后。
在2025年的一篇综述中系统总结了T细胞在ITP中的关键作用,重点探讨了CD4+和CD8+T细胞亚群的异常及其分子机制。并深入探讨目前已出现的针对T细胞的新疗法,为ITP治疗提供了理论支持和潜在的有效治疗途径。
ITP的发病机制与CD4+T细胞介导的免疫失调密切相关,主要表现为Th1/Th2、Th17/Treg、Th22、Th9及Tfh细胞的异常。Th1/Th2比例升高(以Th1极化为主)促进炎症反应,通过IFN-γ上调巨噬细胞FcγR表达,增强血小板吞噬作用,同时刺激B细胞产生抗血小板抗体。Tregs数量减少且功能受损(如FOXP3、CTLA-4、IL-10和TGF-β表达降低),导致对自身反应性T细胞的抑制不足,加剧免疫耐受缺陷。Th17细胞扩增与Tregs减少共同导致Th17/Treg比例失衡,其机制涉及IL-6、IL-21等细胞因子及PD-1/PD-L1通路异常,进一步促进炎症和自身抗体产生。Th22细胞通过分泌IL-22(与AhR高表达相关)协同Th1细胞参与疾病进展,而Th9细胞异常(IL-9及相关转录因子升高)可能通过调控Th17功能影响血小板破坏。
此外,Tfh细胞数量及功能亢进(伴随IL-21、Bcl-6、c-Maf和CXCL13/CXCR5轴上调)驱动生发中心B细胞活化,增加抗血小板抗体分泌。治疗上,糖皮质激素、脾切除术或靶向药物(如地西他滨、HDAC抑制剂)可通过纠正上述细胞亚群失衡(如恢复Treg功能、降低Th1/Th17比例或抑制Tfh细胞)改善临床症状。
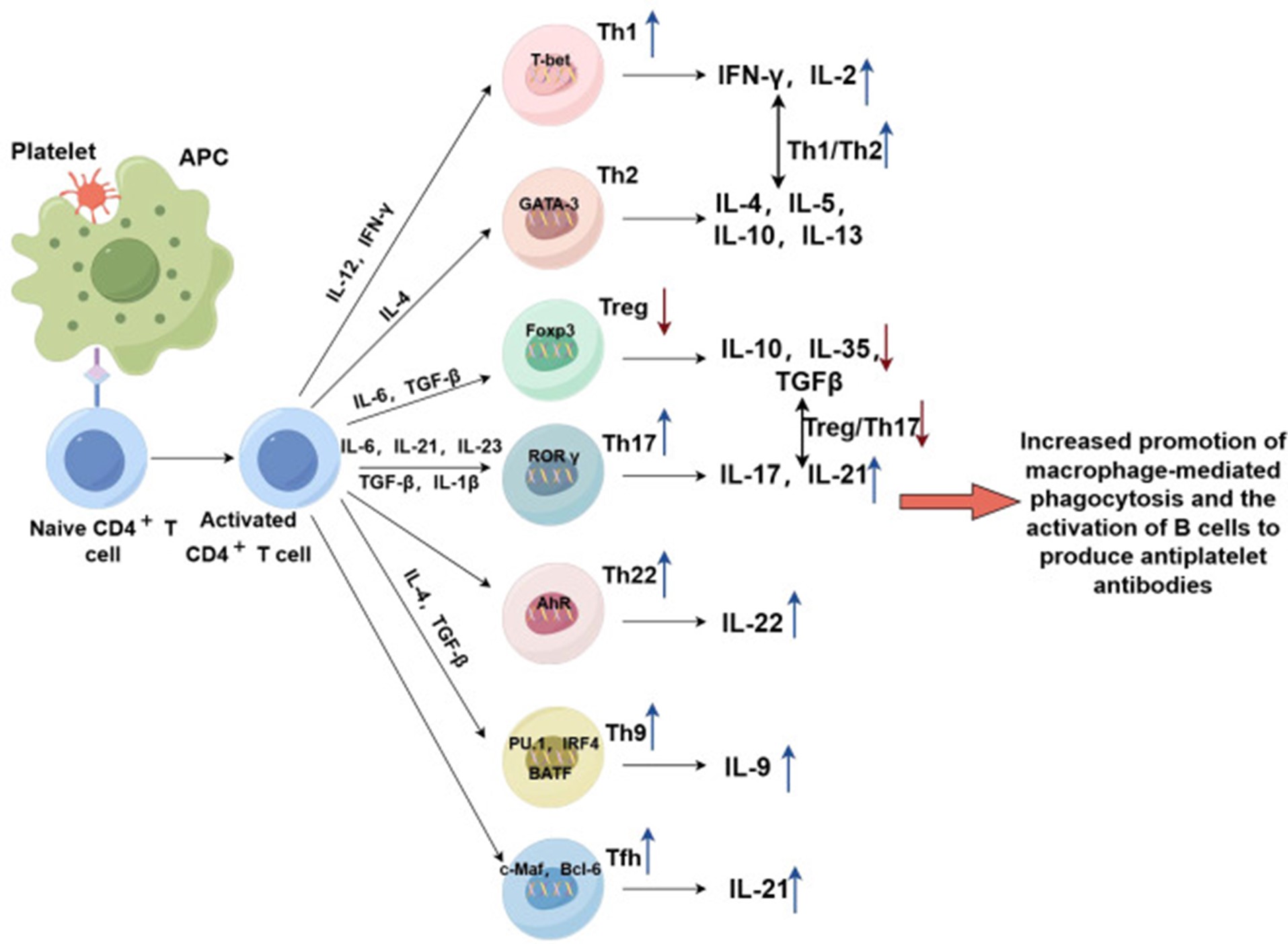
图1.初始CD4+T细胞通过与抗原呈递细胞的相互作用,分化为多种活化的CD4+T细胞,分泌不同的细胞因子,参与针对血小板的免疫反应。在ITP中,这种CD4+T细胞的免疫失调是疾病特征。Th1、Th9、Th17和Th22细胞促进巨噬细胞吞噬、B细胞激活和细胞毒性T细胞(CTL)的毒性作用。Tfh细胞的过度活化导致生发中心(GC)扩大和浆细胞增多,增加抗血小板抗体分泌。Tregs的减少减弱了对免疫反应的控制,降低自我耐受,增强自身免疫反应,促进抗血小板抗体的产生。
CD8+T细胞
在ITP发病机制中的多重作用及治疗潜力
在ITP的发病机制中,CD8+T细胞通过多种途径参与血小板的破坏和生成障碍。除经典的抗体介导机制(如脾脏巨噬细胞吞噬抗体包被的血小板)外,约50%的ITP患者还存在非抗体依赖的病理过程。
研究表明,ITP患者的CD8+T细胞呈现Tc1型极化(表现为Tc1/Tc2比率升高),同时伴有IFN-γ和TNF-α水平增高以及Treg细胞减少,从而形成促炎微环境。这些细胞通过以下机制发挥作用:
1. 直接细胞毒性作用:通过穿孔素-颗粒酶途径及Fas/Fas-L系统诱导血小板凋亡,该过程受KIR家族负调控;
2. 促进血小板去唾液酸化:增强肝脏AMR受体介导的血小板清除;
3. 抑制巨核细胞成熟:通过MHCI类分子抑制巨核细胞成熟,导致血小板生成减少;
4. 免疫抑制失衡:CD8+Treg功能缺陷,进一步加剧免疫调控异常。
拓展阅读:
CD8+T细胞作为细胞免疫的核心效应细胞,在抗感染、抗肿瘤及免疫调节中发挥关键作用。其通过识别MHC-I分子呈递的抗原肽,直接杀伤感染或恶性细胞,并分泌IFN-γ、TNF-α等细胞因子增强免疫应答。然而,如何高效激活CD8+T细胞并克服其功能耗竭,一直是免疫治疗领域的挑战。
近期研究在CD8+T细胞介导的免疫调控方面取得重要进展。一项研究开发了一种新型疫苗佐剂SABER,通过靶向STING蛋白,促进抗原从细胞质向内质网的递送,显著提升了CD8+T细胞对肿瘤抗原的识别效率,为肿瘤治疗性疫苗的设计提供了新策略。此外,IL-21被发现能重塑PD-1+CD8+T细胞的功能,逆转其耗竭状态,并通过激活STAT1/STAT3信号通路增强抗肿瘤活性。这一机制为联合免疫检查点抑制剂(如PD-1单抗)提供了理论依据,有望改善黑色素瘤等难治性肿瘤的治疗效果。
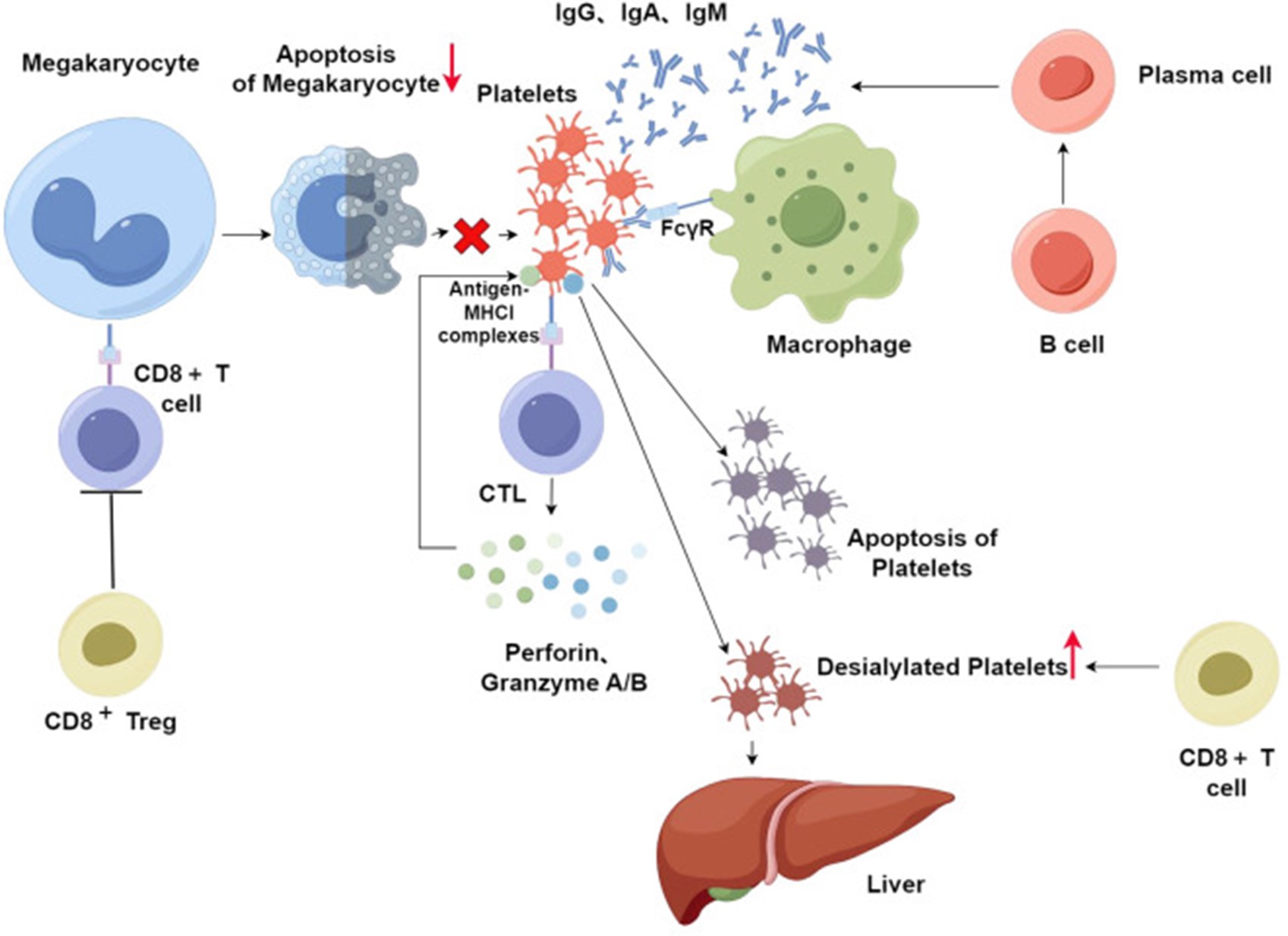
图2.在免疫性血小板减少症(ITP)中,血小板破坏主要通过两种机制:抗体介导:自身抗体结合血小板后被脾脏巨噬细胞清除;以及T细胞直接杀伤:CD8+T细胞通过细胞毒性(穿孔素/颗粒酶)或促进肝脏清除去唾液酸化血小板。此外,CD8+T细胞抑制巨核细胞功能,减少血小板生成,而CD8+Tregs的缺失进一步加剧免疫失衡。部分患者即使抗体阴性,仍因T细胞介导的破坏导致血小板减少
ITP的遗传易感性与治疗差异
遗传因素显著影响原发性ITP的发病机制和治疗反应。研究表明,ITP患者存在TLR4、S100A8等基因表达异常,且T细胞共刺激/抑制分子(如CD28、PD1、CTLA-4)和细胞因子(如IFN-γ、IL-17)的基因多态性与疾病风险、严重程度及治疗敏感性相关。
例如,CTLA-4低表达变异导致Treg功能失调,而IFN-γrs2430561TT基因型与Th1/Th2失衡相关。CARD9rs4077515则可能通过促进Th2分化恢复免疫耐受。这些发现为ITP的精准筛查和个体化治疗提供了依据。
观点评述
ITP的发病原因错综复杂:一方面是自身抗体破坏血小板,另一方面当T细胞的数量异常也会导致T细胞功能失调,这样身体原本能耐受自身细胞的机制就会被破坏,血小板也就被更多地破坏掉。现在,ITP治疗方面也新出现的一些针对T细胞的治疗手段,像间充质干细胞、CTLA4-Ig这些,已经显示出治疗的潜力。另外,检测与T 细胞有关的基因,能帮助我们提前知道病情会怎么发展,也能指导治疗方案的制定。
虽然大家都知道 T 细胞在ITP发病里起了很重要的作用,但但仍有许多机制尚未完全了解。不过,只要研究一直做下去,T细胞相关的研究结果肯定能帮我们提前判断ITP的风险,给患者定制专属治疗方案,还能研发出更有针对性的新药,让ITP的诊疗迈向“量体裁衣”的方向发展 。

参考文献
1.Bu,Siyuanetal.“The function of T cells in immune thrombocytopenia.”Frontiers in immunology vol.161499014.21Feb.2025.
2. Malik A, Sayed AA, Han PP, Tan MMH, Watt E, Constantinescu-Bercu A, et al. The role of CD8+ T-cell clones in immune thrombocytopenia. Blood. (2023) 141:2417–29.
3. Grozovsky R, Begonja AJ, Liu K, Visner G, Hartwig JH, Falai H, et al. The Ashwell-Morell receptor regulates hepatic thrombopoietin production via JAK2-STAT3 signaling. Nat Med. (2015) 21:47–54.
4.Qiu J, Liu X, Li X, Zhang X, Han P, Zhou H, et al. CD8(+) T cells induce platelet clearance in the liver via platelet desialylation in immune thrombocytopenia. Sci Rep. (2016) 6:27445.












