免疫性血小板减少症(ITP)是一种复杂的自身免疫性疾病,既往对ITP发病机制的相关研究大多集中在免疫系统的异常激活方面,尤其是T细胞或B细胞的异常活化1。而随着对体液免疫和细胞免疫失调的深入研究,越来越多的证据表明,表观遗传学在ITP的发生发展中同样扮演着不可忽视的角色。近年来,表观遗传调控机制在ITP发病中的作用逐渐成为研究热点。2025年发表的一篇综述性文献系统总结了DNA甲基化、组蛋白修饰和非编码RNA等关键表观遗传机制在ITP发病中的调控作用,并深入探讨了其在疾病诊断与治疗中的潜在应用价值,为未来ITP的临床研究和精准干预提供了理论支持和研究方向。
DNA甲基化作为研究最深入、最具代表性的表观遗传调控机制之一,在ITP的发病过程中发挥着尤为突出的作用,尤其在T细胞功能的调控方面。有研究表明,ITP患者外周血CD4⁺ T细胞中整体DNA甲基化水平明显降低2。此外,在诸如PD-1和FOXP3等关键免疫调节基因的启动子区域,甲基化异常尤为明显。其中,FOXP3是调节性T细胞(Treg)维持免疫耐受的核心转录因子,其启动子区域高甲基化可能导致FOXP3表达下调,从而造成Treg细胞数量减少或功能缺陷,破坏机体对自身抗原的耐受机制。研究还发现,CD70基因启动子的低甲基化与其在ITP患者体内的异常高表达密切相关,这种表达增强可促进T细胞与B细胞之间的异常活化,从而推动自身抗体的产生,加剧免疫系统对血小板的攻击。
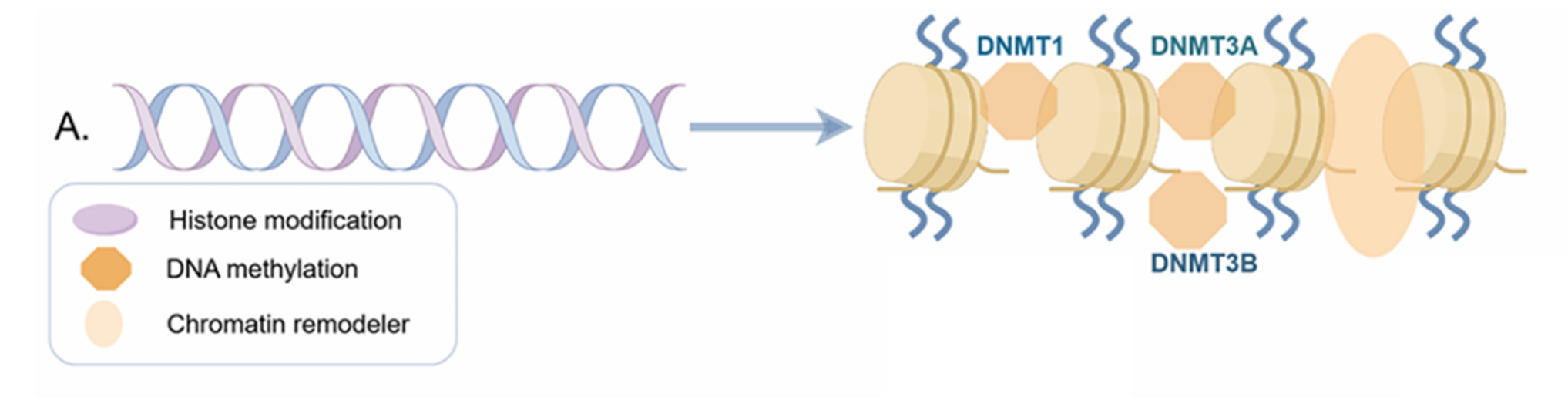
图1,通过DNA甲基化的表观遗传调控
DNA甲基转移酶(DNMT1、DNMT3A 和DNMT3B)将甲基基团添加至DNA上,这一过程与组蛋白修饰相互作用,共同调节基因表达。
拓展阅读:
异常的DNA甲基化可在不改变核苷酸序列的情况下影响基因表达,并且已被证实与多种自身免疫性疾病的发生密切相关,包括系统性红斑狼疮(SLE)和ITP等1。在正常生理状态下,DNA甲基化通常抑制基因转录,而去甲基化则激活基因表达,一旦这种平衡被打破,便可能引发免疫系统的紊乱。
在ITP中,DNA甲基化异常不仅影响T细胞的功能,还可能深度参与B细胞介导的免疫调控过程3。研究发现,人类B细胞中存在两种CD5基因的转录本:经典型CD5-E1A以及融合型CD5-E1B。后者的5'端包含了人类内源性逆转录病毒(HERV)序列,其表达受到该区域启动子(5´LTRU3)甲基化状态的调控。具体而言,5´LTRU3区域DNA甲基化水平的下降会上调CD5-E1B的表达,并且能与CD5-E1A结合,抑制其向细胞膜转运过程,从而使CD5分子负向调控BCR信号通路的作用减弱,使B细胞过度活化促进自身免疫反应的发生。
DNA甲基化水平的异常下降不仅上调了与免疫异常密切相关的基因表达,还促进了具有自身反应性的B细胞的形成,从而可能诱发并维持自身免疫反应。这一机制在ITP等自身免疫性疾病中的潜在作用揭示了甲基化调控的病理意义,也同样为靶向表观遗传机制的免疫干预策略提供了理论支持。
组蛋白的乙酰化与甲基化是染色质状态和基因活性的经典调节机制,在自身免疫病理中具有重要作用。除此之外,一系列新型组蛋白翻译后修饰方式在ITP发病中的作用也逐渐被揭示,包括乳酸化修饰、瓜氨酸化、巴豆酰化和琥珀酰化修饰等。
例如,在ITP患者中,CD8+T细胞发生乳酸化修饰,这种修饰可能通过改变血小板表面糖蛋白的结构特征,促进其在肝脏中的清除;此外,乳酸化还能影响巨噬细胞的极化状态,从而进一步调节免疫系统对血小板的识别与清除。瓜氨酸化修饰则主要与组蛋白H3的修饰有关。研究显示,ITP患者血浆中瓜氨酸化组蛋白H3(CitH3)水平显著升高,并且这一变化还与疾病的严重程度和死亡率呈正相关,提示可作为一种潜在的预后标志物。巴豆酰化则可调节T细胞的活化和分化,从而影响抗血小板的免疫应答,这可能也是ITP血小板破坏的原因之一。
这些新型组蛋白修饰的发现和深入研究不仅拓展了我们对ITP表观遗传调控的理解,也为未来开发靶向性更强、机制更明确的治疗策略提供了新的靶点,针对特定组蛋白及其修饰酶的激活剂或抑制剂,可能成为ITP个体化治疗的新方向。
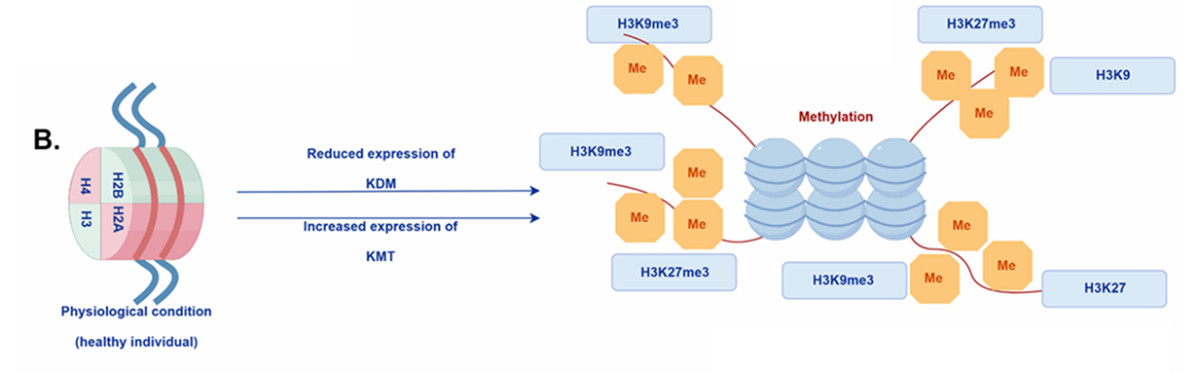
图2,健康个体中组蛋白修饰的模式
组蛋白去甲基化酶(KDM)表达减少,而组蛋白甲基转移酶(KMT)表达增加,这些变化影响了抑制性组蛋白标记(如H3K9me3和H3K27me3)的水平。
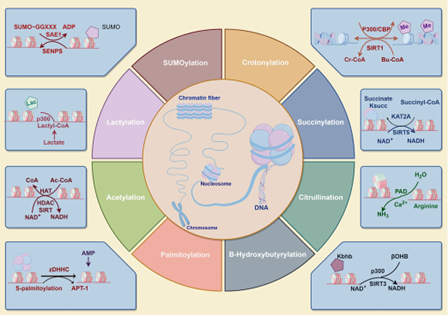
图3,组蛋白翻译后修饰的代谢途径示意图
组蛋白修饰是与主要代谢途径密切相关的复杂过程:葡萄糖、脂肪酸和氨基酸作为主要代谢底物,在细胞内产生各种中间产物,这些中间产物为蛋白质的共价修饰提供必需的酰基基团,包括乳酸化、乙酰化、琥珀酰化、瓜氨酸化、巴豆酰化、SUMO化,2-羟基异丁酰化和棕榈酰化。
非编码RNA主要包括微小RNA(miRNA,又称微核糖核酸)和长链非编码RNA(lncRNA),在免疫系统中发挥着重要的转录后调控功能。它们可以通过调节靶基因的表达,影响免疫细胞的发育、分化、活化及免疫耐受的维持,在炎症的消退和自身免疫反应的发生中均具有关键作用。几乎所有类型的免疫细胞,如T细胞、B细胞、巨噬细胞和树突状细胞,都会受到非编码RNA调控的影响。
miRNA在维持免疫系统平衡以及免疫细胞发育和激活的过程中发挥关键作用。大量研究表明,ITP患者体内存在多种miRNA表达水平的显著改变。例如,miR-155-5p在ITP患者中表达显著上调,可通过靶向抑制SOCS1,进而促进Th17细胞的激活、抑制Treg细胞的免疫抑制功能,从而增强炎症反应。类似地,miR-146a的表达升高也被发现与炎症反应的加剧密切相关,提示其可能参与ITP慢性炎症状态的维持。lncRNA则是免疫应答的关键调节因子,可以通过充当竞争性内源RNA(ceRNA)抑制miRNA,减弱miRNA对其靶mRNA的抑制作用,从而在mRNA水平上进一步影响靶基因的表达。此外,还有研究表明在ITP患者中miR-302 c-3 p、miR-483- 5 p、miR-410、miR-302 a-3 p、miR-223 - 3 p和miR-597的表达水平增加,而miR-544 a的表达降低,这些异常的表达可能会破坏Th 1/Th 2细胞之间的平衡,并且通常与难治性ITP相关。
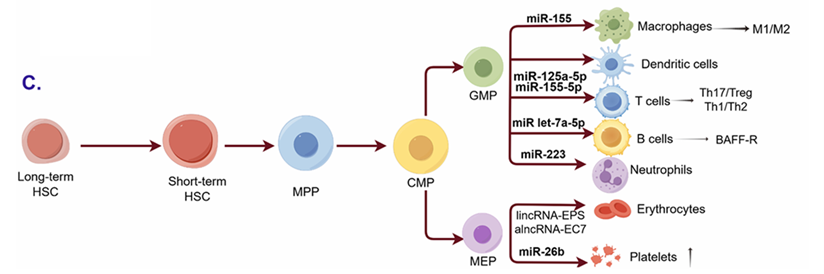
图4,非编码RNA在ITP免疫细胞中的作用
从长期造血干细胞(HSCs)分化为多种免疫细胞谱系(如巨噬细胞、树突状细胞、T细胞、B细胞、中性粒细胞、红细胞和血小板)的分化路径,突出了非编码RNA在该过程中调控免疫功能的作用。
拓展阅读:
除了在ITP发病初期发挥重要作用外,表观遗传变异同样可能深度参与疾病的慢性化和难治性进程。这些变异可能通过调节免疫调控和血小板生成,进一步推动疾病的慢性化和难治性发展。循证显示,约有10%的ITP患者在接受常规治疗后疗效不佳甚至无反应,最终发展为难治性ITP。越来越多的证据表明,特定的表观遗传学异常,如基因甲基化状态异常或非编码RNA表达失衡,可能与治疗无效密切相关。例如,PD-1基因的rs36804233位点多态性与难治性ITP显著相关,而PTPN22基因的变异则影响患者对免疫调节治疗的敏感性。
观点评述
表观遗传学为理解ITP的发病机制提供了全新的视角。这篇综述不仅系统性地揭示了DNA甲基化、组蛋白修饰和非编码RNA在免疫失调中的重要作用,深入拓展了我们对ITP病理生理基础的理解,还为开发新型诊断工具和治疗策略提供了研究方向和可干预的潜在靶点。然而,当前关于表观遗传机制的多数研究仍停留在基础实验和动物模型阶段,缺乏大样本、多中心的临床验证。此外,作为生物标志物在稳定性、特异性以及检测方法标准化等方面尚存在诸多挑战。因此,广泛应用于临床诊疗仍需更多循证支撑。但毫无疑问,表观遗传学已经成为理解和治疗 ITP 不可或缺的重要领域,值得我们持续关注和深入探索,也期待未来继续开展对表观遗传学在ITP患者不同病程中的深入分析和研究,为ITP的精准诊断和治疗提供更多循证依据和可能。

参考文献:
1.邹雅倩,等.生命的化学,2021,41(09):1950-1954.
2.Zhou X, et al. Mol Biol Rep. 2025;52(1):257.
3.赵曼君,等.中国免疫学杂志,2022,38(01):124-128.
4.夏雯洁,等.现代免疫学,2022,42(01):64-71.












