免疫性血小板减少症(ITP)是一种由自身免疫机制引起的疾病,主要特征为血小板(PLT)数量显著减少及血小板破坏加速。ITP的发病机制较为复杂,涉及免疫系统的多重失调,巨噬细胞的活化和吞噬作用在其病理过程中起着关键作用。尽管糖皮质激素和免疫抑制剂等现有治疗手段能够有效控制患者的症状,但存在疗效不稳定和副作用较大等问题,限制了其临床应用。近年来,寄生虫抗原对免疫系统的调节作用逐渐被发现,其在ITP治疗中的潜力愈加受到关注。其中,细粒棘球绦虫(Eg)中的抗原B(AgB),已经被证明能够调节巨噬细胞的功能,这一发现为ITP的治疗提供了新的研究视角。细粒棘球绦虫抗原B(AgB)
可改善多种免疫性疾病
近年来,越来越多的研究揭示了细粒棘球绦虫(Eg)及其抗原B(AgB)在免疫调节中的潜力。细粒棘球绦虫作为一种人畜共患寄生虫,通过分泌包括AgB在内的免疫逃逸因子,有效逃避宿主的免疫监视,从而在宿主体内长期生存。这些研究表明,AgB不仅在寄生虫免疫逃逸过程中发挥作用,还可能为治疗各种免疫性疾病提供新的思路1,2。已有大量研究表明,Eg感染能够调节宿主免疫反应,改善多种免疫性疾病的症状。例如,在炎症性肠病小鼠模型中,注射Eg感染的巨噬细胞显著减轻了小鼠的肠道炎症。细粒棘球蚴感染还可通过提高抗炎性细胞因子白细胞介素(IL)-10的水平,同时下调促炎性细胞因子IL-5和IL-17A,成功缓解哮喘症状。这些发现支持了寄生虫感染在调节免疫反应、减轻免疫性疾病中的潜在治疗作用。此外,Eg囊液中的AgB作为免疫调节分子,也已被证明能够通过调节巨噬细胞,显著减轻炎症性肠病小鼠体内的炎症。然而,尽管这些初步研究显示了AgB在治疗免疫性疾病中的潜力,具体的免疫调节机制仍然不完全明了2,3。拓展阅读:
ITP是一种以血小板计数(PLT)显著减少为主要特征的自身免疫性出血性疾病,发病机制复杂,主要涉及B细胞、巨噬细胞、T细胞等免疫细胞的异常活化。正常生理状态下,血小板数量的维持依赖于血小板的产生与清除之间的动态平衡4。然而,ITP患者的巨噬细胞通常处于过度活化状态,进一步加剧了血小板的破坏,导致PLT显著下降。此外,ITP患者的巨噬细胞极化失衡也是疾病加重的重要因素。研究表明,ITP患者体内M1型巨噬细胞增多,而M2型巨噬细胞减少1。这种极化失衡导致促炎因子如肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)和诱导型一氧化氮合酶(iNOS)的释放,从而可能进一步加剧免疫反应,恶化ITP症状。Eg感染患者巨噬细胞吞噬能力显著下降
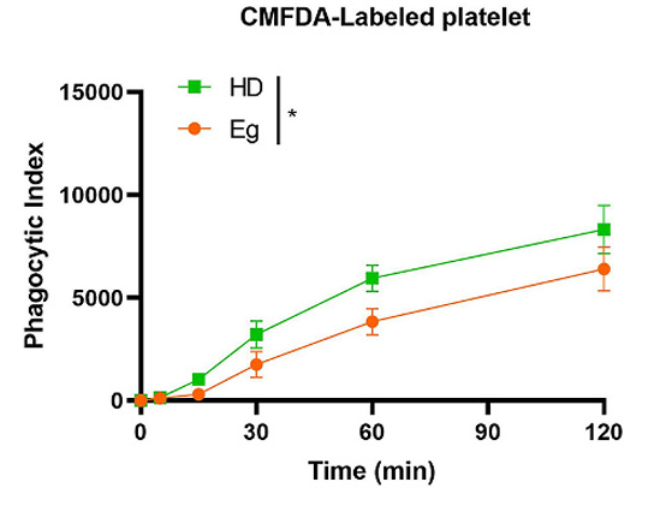
研究者首先纳入了6例粒棘球绦虫感染患者(Eg)与6名健康对照人群(HD),旨在评估Eg感染是否影响人巨噬细胞功能。通过分析从上述患者的外周血样本中分离出的单核细胞衍生的巨噬细胞对血小板的吞噬能力,研究发现,Eg感染患者的巨噬细胞吞噬能力显著低于健康对照组。图1,Eg感染患者与健康对照组的巨噬细胞吞噬能力比较注:CMFDA,5-氯甲基二乙酸荧光素;*p<0.05,表示存在统计学差异
此外,流式细胞术分析结果显示,与健康对照组相比,Eg感染组的M1型巨噬细胞数量明显减少。同时,Eg组巨噬细胞中IRF5、CD80、IL-1β、IL-6、IL-12和TNF-α的mRNA表达水平显著降低。这些结果表明,Eg感染可能通过调节巨噬细胞的分化和功能,进而影响其免疫反应。
抗原B(AgB)是细粒棘球绦虫(Eg)囊液中的主要分泌蛋白,而Toll样受体4(TLR4)则是巨噬细胞表面重要的免疫受体之一,在多种免疫反应中发挥关键作用。为了进一步探讨AgB对巨噬细胞的调节机制,研究者进行了深入研究。结果表明,AgB能够显著抑制M1型巨噬细胞的极化,并减少其对血小板的吞噬作用。此外,AgB还通过Fcγ受体抑制了巨噬细胞的吞噬活性。在分子机制层面,AgB通过抑制核因子κB(NF-κB)和干扰素调节因子3(IRF3)的活化,减少了炎性细胞因子的生成,进一步证实了其免疫调节作用。
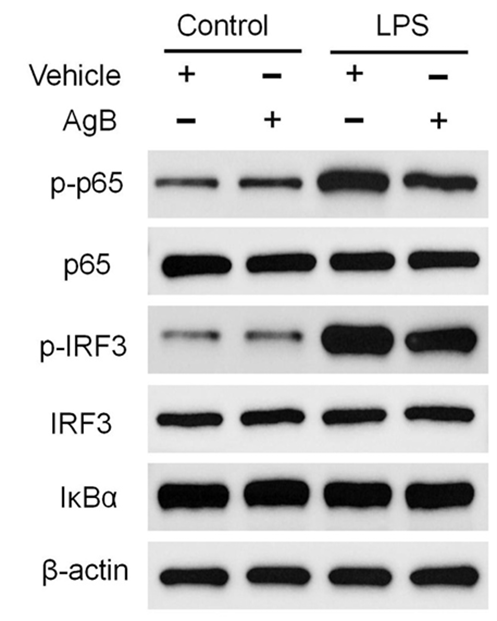
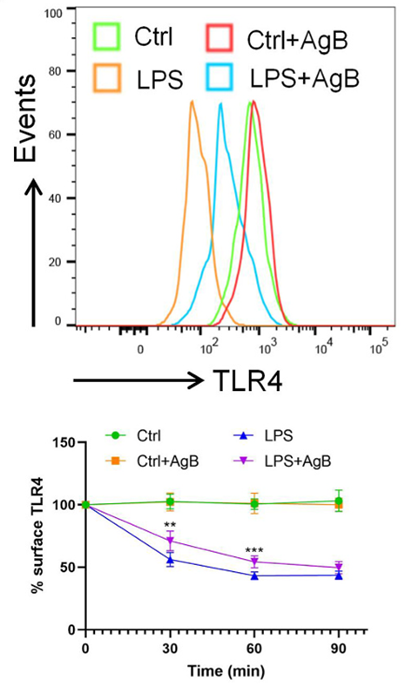
与此同时,研究者还发现,AgB能够显著抑制脂多糖(LPS)诱导的TLR4内吞作用,降低巨噬细胞的免疫反应。这一过程通过调控TLR4的内吞和CD14的回收,抑制了巨噬细胞的激活,进而减少了其对血小板的吞噬作用。总而言之,AgB通过多种机制调节巨噬细胞的功能,展现了其在免疫调节中的重要作用。图3,AgB显著抑制TLR4内吞
注:**p<0.01,***p<0.001,表示存在统计学差
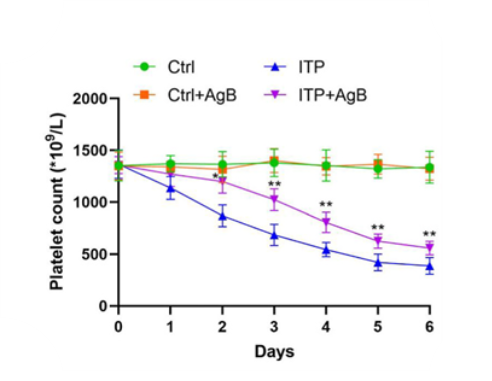
Toll样受体4(TLR4)是巨噬细胞表面表达的先天免疫受体,它能够识别病原体相关分子并激活核因子κB(NF-κB)信号通路,促进巨噬细胞向M1型极化,增强炎性反应,在巨噬细胞的免疫反应中起着关键作用。因此,抑制TLR4的过度激活可能有助于调节巨噬细胞功能,减轻ITP症状,并为ITP的治疗提供新的策略。基于上述结果,研究者进一步探索可AgB在ITP治疗中的潜力,将分离出的AgB应用于ITP小鼠模型。与对照组相比,ITP小鼠的PLT显著更低,而在给予AgB后,ITP小鼠的PLT得到了显著提高。注:*p<0.05,**p<0.01,表示存在统计学差
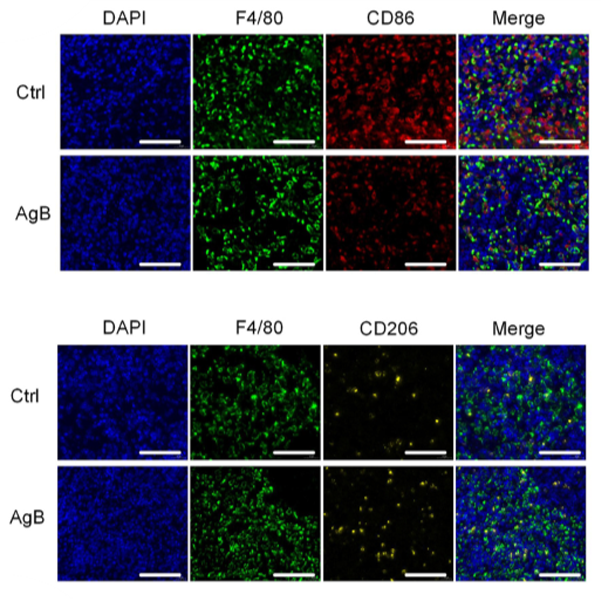
免疫荧光分析进一步揭示,ITP小鼠接受AgB后,细胞内M1型巨噬细胞数量明显减少,同时M2型巨噬细胞数量增加,提示AgB通过调节巨噬细胞的极化,抑制M1型巨噬细胞相关的吞噬活性,促进抗炎性M2型表型的形成,从而降低血小板的破坏并提高血小板数量。这一结果为AgB作为ITP治疗的潜在候选药物提供了有力的支持。图5,ITP小鼠脾脏内M1和M2巨噬细胞的免疫荧光图注:F4/80+、CD86+代表M1巨噬细胞;F4/80、CD206+代表M2巨噬细胞
上述研究证实了细粒棘球蚴抗原B通过抑制TLR4内吞作用增加ITP小鼠PLT的机制,除此以外,国内另一项动物实验还进一步探讨了AgB与钙结合蛋白1(CBP1)在ITP小鼠中的TLR4/NF-κB/NLRP3信号通路的保护作用2。该项研究结果同样证实了AgB和CBP1可提高ITP模型小鼠的血小板计数,研究表明,其机制可能与抑制TLR4/NF-κB/NLRP3通路、抑制巨噬细胞向M1型极化以及下调下游炎症因子水平有关。然而,这项研究同样仅限于动物实验,并且使用的AgB为天然来源蛋白,可能存在天然抗原免疫原性的作用,因此,后续还需继续使用重组AgB进行研究,以明确重组蛋白的作用并排除天然蛋白可能带来的免疫原性影响,这将为AgB作为治疗ITP的新型免疫调节剂提供更加坚实的科学依据。
观点评述
Yunfei Zhang等学者的研究结果证实了Eg抗原B(AgB)在ITP中的治疗潜力,为未来ITP的治疗策略提供了新的研究方向。AgB能够通过调节巨噬细胞的激活状态、抑制TLR4的内吞作用以及抑制炎性细胞因子的生成,有效地提高ITP小鼠的血小板计数。这一发现不仅丰富了我们对AgB免疫调节机制的理解,也为ITP的治疗提供了新思路。然而,目前的研究仍处于机制探索阶段且仅限于动物模型研究。因此,未来亟需更多临床研究来验证AgB在ITP患者中的疗效。除了对巨噬细胞的作用外,未来的研究还应深入探索AgB与宿主免疫系统其他分子,特别是T细胞和B细胞的相互作用。这有助于进一步了解AgB对免疫系统的长期影响及潜在副作用,为其临床应用提供更加全面的数据支持。整体而言,AgB作为潜在的免疫调节剂,能够通过独特的免疫逃逸机制调节巨噬细胞的吞噬功能,进而改善ITP的症状,具有临床应用前景。
1. Zhang Y, et al. Chemico-Biological Interactions, 2025, 406: 111350.
2. 杨雪花,等.中国寄生虫学与寄生虫病杂志,2024,42(05):566-572+581.
3. 焦红杰,等.中国病原生物学杂志,2022,17(10):1170-1174.
4. 王瑶,等.现代检验医学杂志,2019,34(03):161-164.