再生障碍性贫血(AA)是一种由骨髓造血功能衰竭(BMF)引起的血液系统疾病,主要特征是外周血全血细胞减少,临床通常以贫血、出血以及感染为主要表现1。AA对患者造血功能的严重损害,使其成为临床上备受关注的重要疾病之一。然而,尽管目前临床上已有多种针对AA的治疗方法,包括造血干细胞移植(HSCT)、免疫抑制治疗(IST)联合促血小板生成素受体激动剂(TPO-RA)等2,但对于部分患者,尤其是对既往治疗无效的病例,治疗方案的优化仍然是临床实践中的重要课题。近年来,罗普司亭作为一种新型治疗药物,已经显示出了治疗此类患者的良好前景。在2024年的ASH大会上,相关研究成果成功入选并报告,研究显示了罗普司亭在既往其他TPO-RA治疗失败的难治性AA患者中的良好疗效并且为临床应对难治性AA提供了新的治疗思路与参考。AA发病机制复杂
IST等传统治疗疗效有限
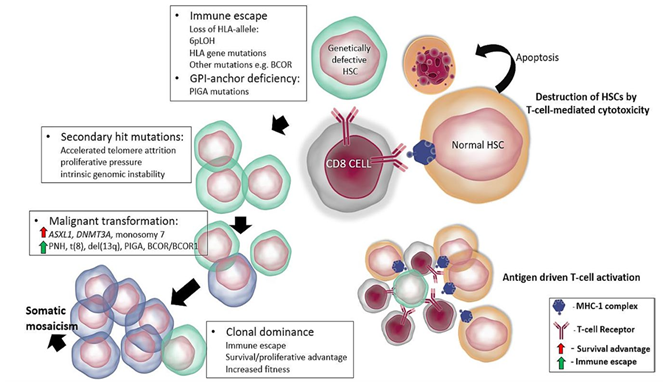
AA可分为先天性与获得性,而绝大多数患者属于获得性AA。基于目前的相关研究与循证,大部分学者认为T淋巴细胞异常活化、功能亢进造成骨髓损伤在原发性获得性AA的发病机制中占主要地位,新近研究显示辅助性T细胞亚群Th1/Th2分化偏移、调节性T细胞(Treg)及NK细胞调节功能不足、Th17、树突状细胞(DC细胞)以及巨噬细胞等功能异常甚至某些遗传背景都参与了AA的发病2,3。图1,获得性再生障碍性贫血的免疫逃逸和克隆进化机制3
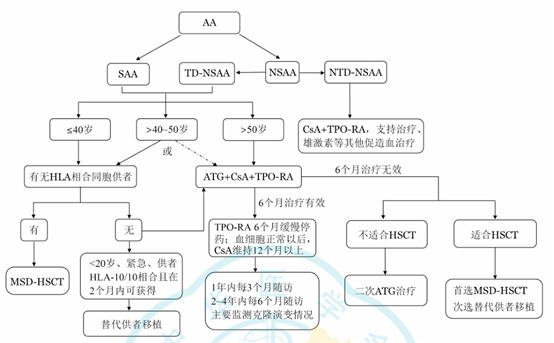
基于AA复杂的发病机制,临床上对于AA的治疗选择也相应的较为丰富,临床一般根据患者的疾病严重程度及其自身因素进行治疗选择,包括HSCT与IST联合TPO-RA等一线治疗方案及成分血输注等支持治疗2,3。
注:SAA:重型再生障碍性贫血;NSAA:非重型再生障碍性贫血;TD-NSAA:输血依赖非重型再生障碍性贫血;NTD-NSAA:非输血依赖非重型再生障碍性贫血;HLA:人类白细胞抗原;ATG:抗胸腺细胞球蛋白;CsA:环孢素A;TPO-RA:促血小板生成素受体激动剂;HSCT:造血干细胞移植;MSD-HSCT:同胞全相合HSCT整体而言,骨髓移植和免疫抑制疗法在AA治疗中占据重要地位。然而,免疫抑制剂和激素治疗等传统治疗方法在部分患者中的疗效却较为有限,循证医学证据显示,30%的患者对IST治疗无反应并且约1/3的患者可能复发或需要长期接受CsA治疗4。与此同时,部分患者经IST治疗后还可能出现克隆进化从而导致骨髓增生异常综合征、急性髓系白血病及溶血性阵发性夜间血红蛋白尿等多种疾病风险1。针对这些免疫治疗无效的患者即“难治性”AA患者,艾曲泊帕是使用最为广泛的替代疗法5,然而临床使用期间同样面临着治疗无效的困境,基于此,第二代TPO-RA罗普司亭在AA临床应用中表现出的积极疗效及其在这类患者中的治疗潜力格外引人瞩目。拓展阅读:
AA属于BMF,即骨髓造血衰竭综合征,全血细胞减少与骨髓细胞减少是AA的标志,临床诊断时需要注意与低增生性骨髓增生异常综合征等其他多种BMF类疾病进行区分与鉴别诊断2,6。例如,先天性无巨核细胞性血小板减少症、先天性角化不良症及范可尼贫血等先天性全血细胞减少症以及低增生性MDS/AML、自身抗体介导的全血细胞减少或大颗粒淋巴细胞(LGL)白血病等其他获得性/继发性全血细胞减少症。
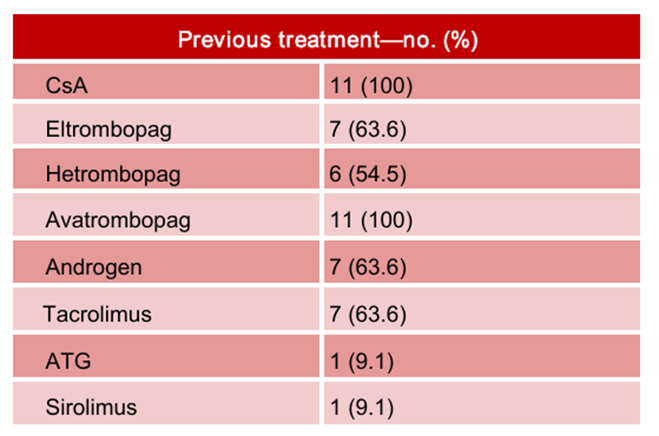
罗普司亭作为第二代TPO-RA,属于TPO肽类模拟物,主要可通过抑制JAK-STAT信号通路调节免疫反应和造血细胞分化发挥作用1,7。在2024年的ASH大会中,我国研究人员公布了一项回顾性研究数据,对罗普司亭在既往其他TPO-RA治疗失败的难治性AA中的疗效与安全性进行了分析5。这项单中心、回顾性研究共纳入了11例难治性AA患者,中位年龄54岁,所有患者既往IST和至少两种其他TPO-RA治疗无效,研究期间,所有患者连续接受罗普司亭20μg/kg/周治疗至少3个月,中位随访时间8个月。中位随访1个月时,患者缓解率高达72.7%(8/11),中位随访2.5个月时,54.5%(6/11)的患者完全缓解,27.3%(3/11)的患者实现三系缓解(血小板、红细胞与中性粒细胞反应)。拓展阅读:
上述研究显示出了罗普司亭治疗既往其他TPO-RA难治性AA的良好疗效,与此同时,另有一项小样本量研究表明大剂量罗普司亭还可加速艾曲泊帕难治性AA患者的血液学恢复8。该项研究纳入了21例艾曲泊帕难治性AA患者,所有患者经大剂量罗普司亭(20 μg/kg)治疗3个月后缓解率可达76%(16/21,定义为在至少一个谱系中达到了血液学反应),并且50%的患者治疗后脱离了血小板(n=2)或红细胞(n=3)输注依赖。罗普司亭在青少年群体中同样疗效优异,一项单臂、开放标签、干预性试点研究,纳入10例确诊为重度AA或骨髓增生异常综合征(MDS)的青少年患者,患者中位诊断年龄9.2岁9。所有患者实现中性粒细胞、红细胞和血红蛋白细胞反应的中位时间分别为7.9周、11.9周和9.0周。治疗24周时,实现中性粒细胞、红细胞和血红蛋白细胞三系缓解的患者比例高达70.4%。罗普司亭不仅可有效缓解既往IST及多种TPO-RA治疗失败的难治性AA患者的血液学反应,而且还具有良好的安全性。随访期间,所有患者未发生任何导致剂量减少或治疗中断的严重治疗相关不良反应。而在青少年群体中同样不会导致克隆进化、骨髓纤维化或死亡等严重不良反应,与艾曲泊帕相比,罗普司亭还具有无血栓形成风险增加的安全优势1,9。拓展阅读:
在长期安全性方面,罗普司亭同样表现优异。Kinuko Mitani等研究人员对一项为期52周的开放标签、II/III期研究进行前瞻性分析时发现,难治性AA患者接受罗普司亭(起始剂量为10 μg/kg,最大剂量为20 μg/kg)治疗长达3.5年的长期安全性良好,最常见的不良反应为头痛且发生率为7.4%,仅1例患者出现3级的体重增加,并且无4/5级不良反应10。
观点评述
传统治疗方法如免疫抑制治疗(IST)虽然可以有效缓解AA患者的全血细胞减少,但对部分患者而言治疗效果有限,且存在一定的治疗中断和剂量减少等问题。罗普司亭作为二代TPO-RA,在治疗既往其他TPO-RA难治性AA中已经展示出了令人瞩目的疗效。根据2024年ASH大会的回顾性研究数据,罗普司亭的缓解率高达72.7%,完全缓解率为54.5%,为临床应对TPO-RA难治性AA患者提供了新的治疗思路。罗普司亭通过促进血小板生成素受体的激活,不仅可显著改善患者的血液学指标,降低免疫反应带来的负面影响,而且在安全性方面同样表现良好。目前,罗普司亭作为全球首款长效TPO-RA,已获批用于IST疗效不佳的AA患者,与此同时,国内首款TPO-RA罗普司亭N01也已经国家药品监督管理局批准顺利上市,期待随着更多临床数据的积累,罗普司亭/罗普司亭N01能够成为治疗难治性AA的重要选择,进一步改善患者治疗预后。此外,未来研究应着眼于探索罗普司亭可能作用的新型治疗靶点,以便为AA患者提供更为有效和安全的治疗策略。
本文由广州市第一人民医院的王顺清教授担任点评专家,文章以非商业研究及教育为目的,不用作商业用途,欢迎阅读、分享!


参考文献:
1. 李洋洋,等.疑难病杂志,2024,23(04):504-508.
2. 中华医学会血液学分会红细胞疾病(贫血)学组.中华血液学杂志,2022,43(11) : 881-888.
3. Boddu P C, et al. European journal of haematology, 2019, 102(2): 103-110.
4. 张研,等.实用临床医药杂志,2023,27(23):144-148.
5. Lin X, et al. Blood, 2024, 144(Supplement 1): 4077-4077.
6. Kulasekararaj A, et al. Br J Haematol. 2024;204(3):784-804.
7. 中国临床肿瘤学会(CSCO)淋巴瘤专家委员会,等.白血病·淋巴瘤,2024,33(9):519-527.
8. Hosokawa K, et al. Leukemia. 2021;35(3):906-909.
9. Sharathkumar A, et al. J Pediatr Hematol Oncol. 2024;46(5)252-261.
10. Mitani K, et al. Blood Adv. 2024;8(6):1415-1419.