我国是再生障碍性贫血(AA)大国,发病率是全球其他地区的2~3倍。AA可分为重型AA和非重型AA(NSAA),其中,输血依赖性NSAA(TD-NSAA)占比高,并发症较多,单用环孢素A(CsA)反应差,易进展为SAA,故临床专家认可TD-NSAA应采取与SAA一致的治疗策略。近10年来,促血小板生素受体激动剂(TPO-RA)是AA治疗领域的最大突破,坚实的循证证据已经表明TPO-RA联合IST可提高AA患者的血液学缓解速度和强度,有望更好地满足患者的治疗需求。因此,进一步了解TPO-RA在TD-NSAA中的治疗潜力,对提升该类人群的预后至关重要。
标准IST治疗模式下
仅56%的TD-NSAA患者5年后仍存活
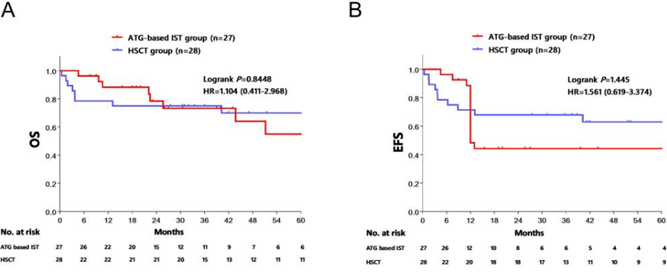
随着研究者对TD-NSAA患者临床特征的深入研究,发现该类人群面临着极高的疾病进展风险,以中国数据为例,回顾性研究显示,高达58.5%的TD-NSAA患者进展为SAA,中位进展时间为24个月1。虽然造血干细胞移植(HSCT)始终被认为可治愈AA的手段,但是在中国,由于供体、医疗资源以及经济原因导致只有少数患者可从HSCT中获益,药物治疗仍是主流2。既往临床治疗TD-NSAA多采用以CsA为主、输血支持及促造血治疗为辅的治疗方案,治疗效果欠佳。近年来,ATG联合CsA的标准IST方案逐步投入TD-NSAA应用,早期的血液学缓解率明显提升,可达60%~70%,但是长期预后数据却鲜有报道3,4。近期,中国学者开展了一项单中心、回顾性研究,共分析了55例TD-NSAA患者,其中27例接受基于ATG的IST治疗,28例接受同种异体HSCT4。研究结果显示,IST组的5年总生存率(OS)为56.5%,HSCT组为70.3%(p>0.05)。而IST组的5年无事件生存率(EFS)为35.9%,也就是说,近七成患者在5年内经历了疾病进展、复发以及治疗无效等事件。此外安全性分析中,IST组的血清病发生率为37.0%。综合来看,标准IST方案无法满足TD-NSAA患者的治疗需求,长期预后尚待提升。图1.IST与HSCT治疗TD-NSAA患者的5年OS(左)和5年EFS(右)TPO-RA联合IST协同增效
改善TD-NSAA患者预后
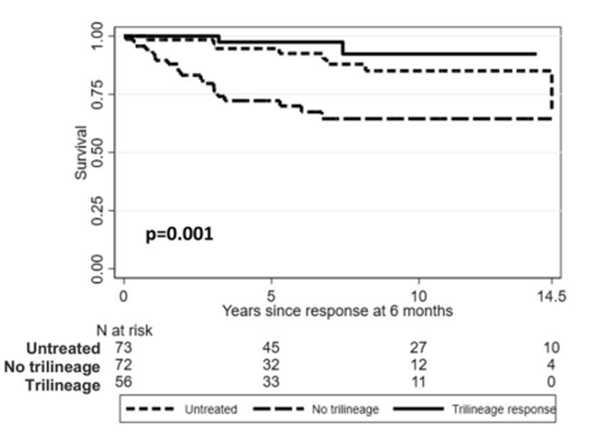
在AA中,免疫系统异常攻击骨髓中的造血干细胞,导致全血细胞减少。而TPO-RA被证实可以刺激造血干细胞数量的增加和功能的提高,且内源性血小板生成素水平的高低并不会影响TPO-RA刺激造血的能力,故其在AA治疗中的应用具有理论支持5。基于此,TPO-RA与IST联合方案已在AA领域开展了多项研究,联合方案覆盖了AA发病机制的多维度因素,已被证实能够提高AA患者的血液学缓解速度和强度,减少输血需求。2023年,欧美学者开展了一项多中心、观察性研究,旨在评估259例NSAA患者的的临床特征、治疗需求以及生存结果6。该研究队列的中位年龄为50岁,其中127名患者依赖输血。入组患者接受的治疗包括单独使用CsA(n=84),CsA与ATG联合使用(n=44),CsA与TPO-RA联合使用(n=20)、单用TPO-RA(n=10)或其他治疗(n=25)。结果显示,相较于其他治疗方式,接受CsA联合TPO-RA的患者有更高的三系反应率(63% vs 37%,p=0.02)。而生存结果分析中,与未接受治疗以及未实现三系反应的NSAA患者相比,实现三系反应患者的长期生存率显著更高(P=0.001)。综合来看,这一研究证实TPO-RA联合CsA可以提升TD-NSAA患者的血液学反应质量,进一步改善预后。图2.实现三系反应与未实现三系反应NSAA患者的总生存期拓展阅读:
024年,中国学者开展了一项回顾性研究,比较了在单中心接受治疗的48例AA患者的数据,23例AA患者接受了IST±TPO-RA,25例患者接受了匹配的同胞供体或半相合HSCT7。IST±TPO-RA组中18例联合了TPO-RA,包括海曲泊帕、艾曲泊帕和阿伐曲泊帕,另外5例仅使用IST。结果显示,IST±TPO-RA组和HSCT组在6个月时的ORR无差异(95.5% vs 81.8% P = 0.342),此外,两组的2年OS和2年无失败生存率相似(OS:95.7%和88.0%,P=0.338;FFS:79.3%和71.4%,P=0.378)。而经济性分析显示,HSCT组的首次住院费用远高于IST±TPO-RA组(P=0.002)。
海曲泊帕联合IST治疗新诊断TD-NSAA的
血液学缓解率达90%以上
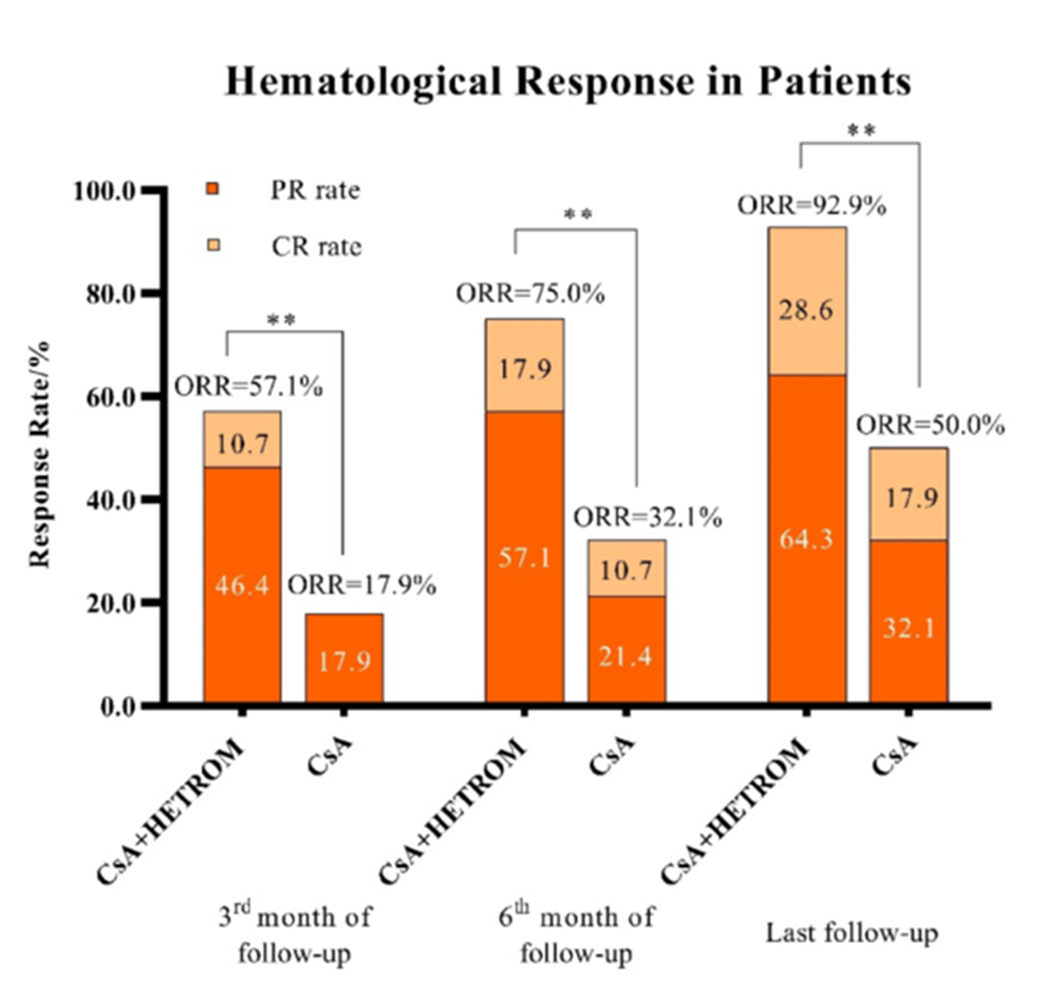
海曲泊帕是我国首个获批AA适应证的TPO-RA类药物,它于2021年获得国家药品监督管理局(NMPA)批准在我国用于对IST疗效不佳的成人SAA患者,并成功纳入医保目录,减轻患者医疗负担。此外,海曲泊帕分子结构中含有铁离子螯合基团,可降低铁过载AA患者的血清铁蛋白水平8。基于其理想的药物学特点,研究者已经在TD-NSAA的一线治疗中探索其疗效。2024年,中国学者开展了一项单中心、前瞻性II期研究,纳入了28例在6个月内被诊断为TD-NSAA且未接受过治疗的患者9。入组患者接受海曲泊帕联合CsA,海曲泊帕的开始剂量为每天10mg,最高剂量未超过15mg。研究者采用了具有相同基线特征且使用CsA单药治疗的历史队列作为对照组。结果显示,治疗3个月后,海曲泊帕组的总缓解率(ORR)显著高于CsA对照组(57.1% vs. 17.9%,P=0.001)。6个月后,海曲泊帕组的ORR也高于对照组(75.0% vs. 32.1%,P<0.001),最后一次随访时,海曲泊帕组的ORR仍然显著更高(92.9% vs. 50.0%,P<0.001)。安全性分析显示,仅1例患者报告3级不良反应,该患者的每日用药剂量减少至5mg,其余患者均未减量或停止使用海曲泊帕,此外,两组的克隆进化的发生率无统计学差异。图3.TD-NSAA患者接受CsA联合海曲泊帕或CsA单药治疗的TD-NSAA患者在3个月、6个月和随访结束时的血液学反应
值得注意的是,海曲泊帕联合CSA用于初治NSAA的注册III期临床试验已获得NMPA批准,相信在未来,随着研究结果的公布,海曲泊帕有希望进一步扩展其适应证,为更多TD-NSAA患者实现临床获益。随着研究者对AA疾病认知的深入,逐步意识到TD-NSAA是一类面临高进展风险且预后不佳的患者群体,基于此,国内指南也提升了对于TD-NSAA治疗的重视。目前现有的药物虽已为TD-NSAA患者提供了较为可观的缓解率,但因经济负担较重、安全性风险尚存、以及疗效提升空间有限等因素的制约,仍无法全面满足患者的治疗需求。以海曲泊帕为代表的TPO-RA联合IST方案在提升TD-NSAA早期血液学反应方面的临床价值已经被充分证实,预示着AA的管理已经进入了TPO-RA时代。展望未来,TPO-RA治疗策略在改善长期预后方面也已经显示出了良好的潜力,相信随着随访时间的延长,未来更多研究将会进一步关注TPO-RA联合IST治疗后患者的生存结果以及生活质量。
参考文献
1. Zhang Y, et al. Front Immunol. 2023 Jul 11;14:1197982.
2. 李燕娟,.等 器官移植, 2023, 14(3): 442-448.
3. 宋琳,等. 中华血液学杂志, 2016, 37(11) : 946-951
4. Shen Y, et al. Ann Med. 2023;55(2):2271475.
5. 傅晨,等.基础医学与临床, 2024, 44(5):719-723.
6. Fattizzo B, et al. Leukemia. 2023 Dec;37(12):2479-2485.
7. Zhao R,et al. Int J Gen Med. 2024 Sep 13;17:4025-4036.
8. 中华医学会血液学分会血栓与止血学组.中华血液学杂志2023,44(07):535-542
9. Shen S, et al. Ann Hematol. 2024 Oct;103(10):4247-4249