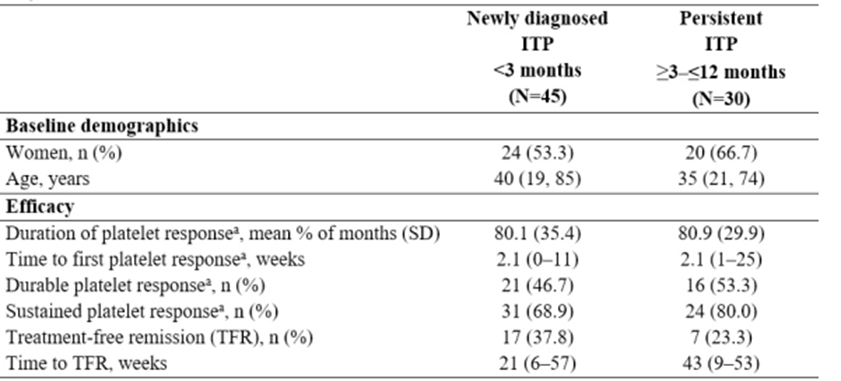
促血小板生成素受体激动剂(TPO-RA)已经成为了原发免疫性血小板减少症(ITP)目前标准的二线治疗,尽管血小板反应良好,但大多数患者需要持续给药才能保持疗效,这对治疗依从性提出了高要求,此外患者的经济负担同样不容小觑。值得关注的是,近年来,罗普司亭的相关研究中已经陆续报道了部分患者即使在停止治疗之后仍能持续缓解,这无疑让临床看到了治愈ITP的曙光。随着进一步的探索,研究者证实了这与罗普司亭额外的免疫调节作用密切相关。基于此,深入了解这类药物的作用机制对未来进一步优化当前治疗策略至关重要。罗普司亭是一种可结晶片段(Fc)-多肽融合蛋白,可与内源性血小板生成素(TPO)竞争性结合TPO受体,激活下游信号通路,最终增加外周血液循环中的功能性血小板。在III期研究中,罗普司亭表现出卓越的升板能力,总体血小板应答率高达95.5%1。自罗普司亭上市后,一个令人出乎意料而又倍感欣喜的发现就是,在不同研究中,部分患者即使停药后仍能实现持续缓解。2016年,国外学者开展了一项前瞻性研究,该研究评估的主要终点就是ITP患者接受罗普司亭的无治疗缓解(TFR)率。在该研究中,治疗时间不超过6个月的ITP患者使用罗普司亭治疗长达一年,观察到32%的缓解率,缓解定义为血小板计数≥50×109/L且24周内无需ITP治疗2。事后分析显示,新诊断患者的TFR率(38%)高于持续性ITP患者(23%),且新诊断患者比持续性ITP患者更快达到TFR3。表1.罗普司亭治疗新诊断ITP和持续性ITP的基线和疗效比较
2019年,一项观察性研究表明,慢性ITP患者若以罗普司亭作为首选TPO-RA治疗且没有切换至其他TPO-RA,则共计44.8%患者实现了TFR,且在3.3年后实现TFR的概率达50%。2023年,瑞士的研究者开展了一项前瞻性研究,分析了罗普司亭对ITP患者免疫系统的影响,在该项研究中,46%患者在研究结束时处于停药后完全持续缓解(SROT)状态。且研究者观察到,在SROT患者中,罗普司亭剂量滴定较低,血小板计数反应更快、更强、更稳定4。
拓展阅读:
2024年EHA大会上,国外研究者公布了一项原发性ITP停用TPO-RA的长期随访研究结果 5。结果显示,TPO-RA停药后,血小板反应(PR)的中位持续时间为230周(最长可达9.5年)。在数据分析时,59%的患者仍保持PR,其中,在停用罗普司亭组中的比例为60%,在停用艾曲泊帕组中的比例为59%。研究显示,治疗线数与PR的维持情况密切相关。相较于既往接受2-4线治疗的ITP患者,仅接受1线治疗的患者在停用TPO-RA后维持PR的生存率显著更高(p=0.011)。
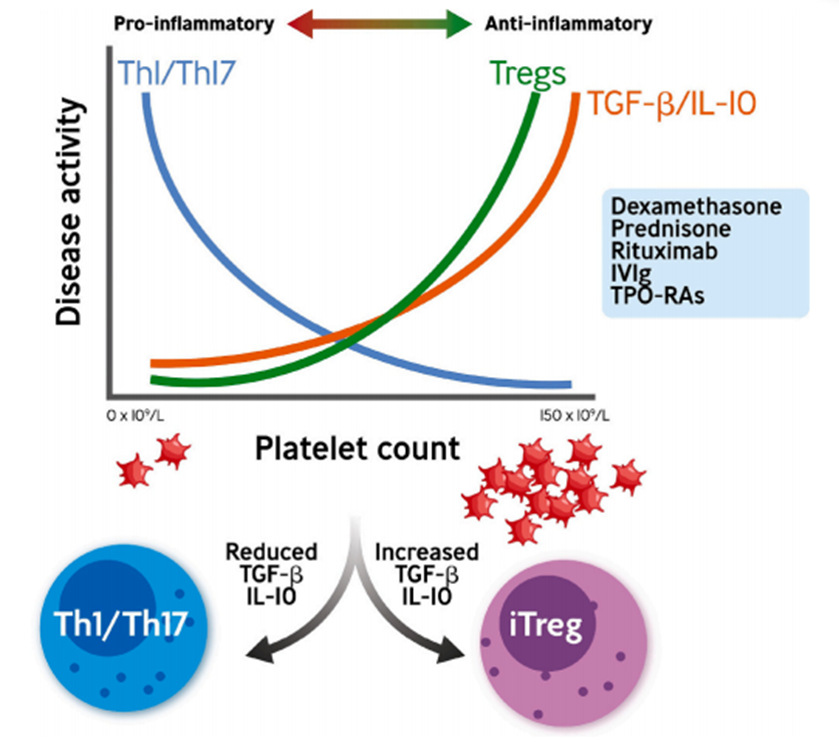
促炎与抗炎之间的失衡存在于大多数自身免疫性疾病中,包括ITP。多种T淋巴细胞亚群参与ITP的发病进程。其中,核心机制是Th1/Th2细胞比例失衡,向Th1增多转变,促使ITP中的自身反应性B淋巴细胞分化产生更多自身抗体,增强血小板的破坏作用,并且导致细胞毒性T淋巴细胞数量增加及过度活跃,从而加速血小板清除速度。有研究发现ITP患者的T淋巴细胞相关细胞因子,如IFN-γ、IL-6、IL-12水平升高,T淋巴细胞相关调节性细胞因子,包括IL-10、IL-27、IL-33、IL-35、IL-37和TGF-β的水平显著降低6。此外,Treg细胞在维持免疫耐受中发挥至关重要的作用。Treg细胞通过分泌IL-10和TGF-β抑制IL-17的表达,进而发挥免疫抑制作用。既往研究研究发现,与健康对照组相比,ITP组Th17细胞数量增加,IL-17水平升高,Treg细胞数量和功能下降,表明炎症反应增强及免疫抑制功能减弱,说明Treg/Th17细胞比例失衡同样参与了ITP的发病进程。图1.ITP患者血小板计数与促炎和抗炎过程之间的关联罗普司亭可以通过调节关键免疫细胞水平
恢复机体耐受
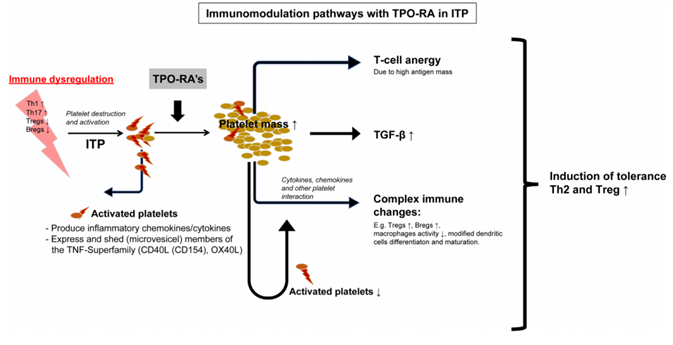
罗普司亭在既往研究中取得较高的无治疗缓解率激发了研究者探寻其背后的原理,近些年,多项研究初步明确了这一现象与罗普司亭所介导的多重免疫调节作用相关。首先,较为关键的作用就是罗普司亭可以增加Treg细胞的数量。iROM研究是一项多中心、开放标签、单臂研究,分析了罗普司亭对ITP患者免疫系统的影响4。研究显示,在停药后完全持续应答的患者中,Treg细胞计数增加,FOXP3(Treg)、GATA3(Th2)mRNA表达增加,TGF-β水平升高。值得注意的是,TGF-β水平每增加一个单位,血小板计数就会增加约0.5(p<0.001)。基于此,研究者认为大多数细胞因子水平的降低以及TGF-β水平和Treg计数升高可能与治疗前6周内血小板质量的快速增加有关。另一方面,研究者指出罗普司亭治疗导致的血小板增加会让身体暴露于更多的抗原,而高剂量抗原可以诱导T细胞进入“无反应”状态,从而抑制机体对血小板的免疫攻击。
此外,不同于其他TPO-RA,罗普司亭属于TPO肽类模拟物,该融合蛋白由1个IgG1 Fc载体结构域和4个对TPO-R具有高亲和力的多肽序列组成的TPO-R结合域组成,这一结构特点也被证实与免疫调节作用存在潜在联系7。Fc片段对FcγRIIb具有抑制作用,而FcγRIIb是B细胞、单核细胞和树突状细胞选择性表达的抑制性受体,其结合可能减少自身抗体的产生8。拓展阅读:
2024年4月,我国研发的首个罗普司亭生物类似物——罗普司亭N01获得国家药品监督管理局的上市批准,该批准许可则是基于罗普司亭N01开展的III期研究。该研究是一项多中心、随机、双盲、安慰剂对照研究,结果显示,治疗24周时,罗普司亭N01组有61.8%的患者产生持续性血小板反应,安慰剂组无患者产生持续性血小板反应,两者具有显著性差异(P< 0.0001)。此外,罗普司亭N01组和安慰剂组之间的治疗引起的不良反应发生率相当。综合来看,国内研发的罗普司亭N01在成年慢性ITP的治疗中显示出良好的疗效,不良反应可控,为ITP治疗提供了新选择。观点评述
对于ITP患者来说,无治疗缓解是一种理想状态,也契合了近年来提出的以改善患者生活质量为目标的治疗模式。从当前研究数据来看,以罗普司亭为代表的TPO-RA确实具有实现短期用药的可能性,但是,未来仍需要设计良好的前瞻性队列研究进一步明确合理减停的合理方案,也需要更多地评估预测无治疗缓解的临床因素。从治疗机制来看,当前研究普遍认可罗普司亭的免疫调节作用包括增加调节性T细胞和其他调节性免疫细胞数量以及改善其相应功能,而非仅仅促血小板生成,这一发现也为罗普司亭应用于疾病的早期阶段提供了良好的理论基础,未来值得进一步探讨以罗普司亭为基础的治疗方案在一线治疗的潜力。
参考文献
1. Shirasugi Y, et al. Int J Hematol. 2011 Jul;94(1):71-80.
2. Semple JW,et al. Blood Rev. 2024 Sep;67:101222.
3. Adrian C.et al. Blood 2021; 138 (Supplement 1): 3157.
4. Schifferli A, et al. Br J Haematol. 2023 Oct;203(1):119-130.
5. EHA 2024 ABSTRACT P2241
6. 徐小凡 ,等.检验医学与临床,2024,21(9):1332-1335,1340.
7. Bussel JB, et al.2021 May 26;15:2243-2268.
8. Chen F, et al. Expert Opin Biol Ther. 2021 Nov;21(11):1383-1393
9. Zhou H, et al. J Transl Int Med. 2023 Dec 20;11(4):423-432. D