作者导语
骨髓衰竭性疾病以骨髓造血功能严重受损为特征,包括再生障碍性贫血(AA)、骨髓增生异常综合征(MDS)等一系列临床表现相似的全血细胞减少症候群,在临床诊疗过程中,骨髓衰竭性疾病缺乏鉴别诊断的特异性指标且治疗手段有限。异体造血干细胞移植(HSCT)是多数骨髓衰竭性疾病的唯一根治性疗法,但仅有部分患者能够从HSCT中获益;对于以免疫介导的骨髓损伤为主要病理机制的骨髓衰竭性疾病,免疫抑制治疗(IST)是首选治疗方案之一,但这一治疗策略面临着初始疗效较差、复发率较高的挑战。近年来,TPO-RA在血小板减少症领域取得了突破性进展,大量研究表明,TPO-RA激活血小板生成素受体(c-MPL)后不仅能够促进血小板生成,还能够促进红细胞及白细胞的恢复,实现了三系血细胞的同步提升,或许,TPO-RA能够为骨髓衰竭性疾病患者提供新的治疗选择。
骨髓衰竭性疾病病理机制与分类
骨髓衰竭是指造血干细胞(HSC)的稳态和功能受到破坏,导致患者体内HSC耗竭,累及一系或多系血细胞,引起骨髓衰竭的病理因素包括HSC的种系突变、获得性体细胞突变以及免疫失调1。
骨髓衰竭性疾病主要分为先天性和获得性骨髓衰竭,先天性骨髓衰竭包括Fanconi贫血(FA)、先天性角化不良(DKC)等,获得性骨髓衰竭包括阵发性睡眠性血红蛋白尿症(PNH)、MDS、AA等多种疾病2。
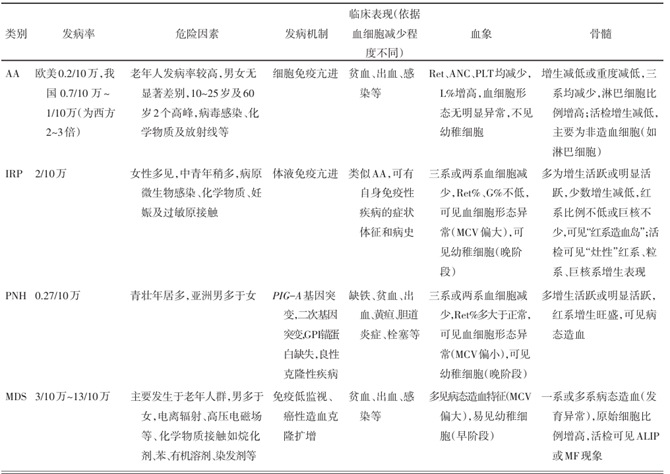
表1. 主要骨髓衰竭性疾病2
绝大多数AA均为获得性骨髓衰竭,辅助性T细胞亚群Th1/Th2分化偏移、Treg及NK细胞功能异常、Th17、树突细胞及巨噬细胞异常等多种免疫失调与遗传因素均与AA发病相关3。HSC及造血祖细胞被T细胞破坏是AA患者发病的主要原因,因此,能够抑制T细胞功能的IST可以为AA患者提供一定的临床获益。

近年来骨髓衰竭性疾病病理机制研究进展缓慢,且这类疾病有相似的临床表现,在临床中极易被误诊。尽管MDS与AA同属于原发性获得性骨髓衰竭性疾病,但细胞毒性T细胞介导的造血细胞破坏是AA的主要病理机制,而MDS则多因体细胞突变引起的克隆性造血与骨髓衰竭导致,尽管这两种病理机制可能同时存在于MDS与AA中,但IST对多数MDS患者无效5,因此,临床中需对MDS与AA做出鉴别诊断,以免错过最佳治疗时机。
骨髓衰竭性疾病中TPO-RA的治疗机制
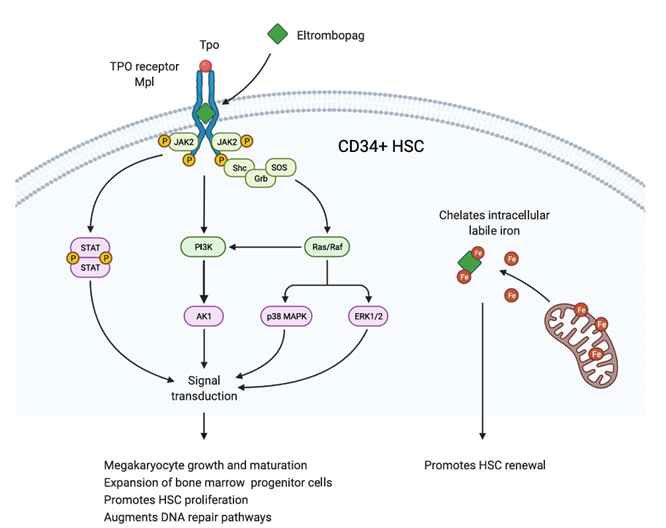
图2. TPO-RA在HSC中的作用机制1
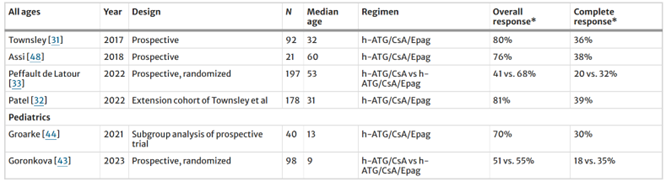
在国内上市的小分子TPO-RA中,阿伐曲泊帕尚未有SAA适应症获批,而海曲泊帕与艾曲泊均已获批用于难治性SAA的治疗。海曲泊帕在艾曲泊帕的基础上优化了疏水性片段与酸性片段,显著提高了药物活性与安全性。在海曲泊帕针对标准一线IST难治SAA患者的II期研究中,接受海曲泊帕治疗的患者血液学应答率为49.1%,持续应答率达到了83.9%8。
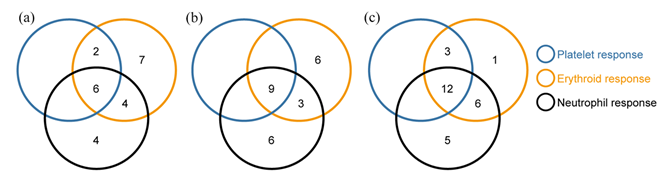
上文中提到,AA患者IST治疗失败的原因之一是患者体内残存HSC不足,因此,改善HSC数量与功能成为了提升IST治疗效果的可行策略之一。在一项前瞻性研究中,国内研究人员对比了海曲泊帕联合IST与IST标准方案在SAA患者中的有效性与安全性。研究数据显示,海曲泊帕起效更快,两组6个月时总应答率分别为68.7%与50.0%,而治疗组完全应答率为34.4%,显著优于对照组的14.6%,证实了海曲泊帕联合IST在SAA一线治疗中的有效性9。
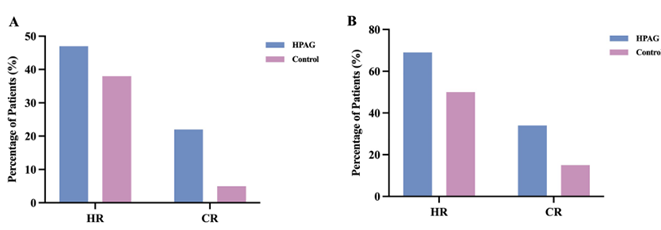
图4. 海曲泊帕联合IST一线治疗SAA有效性数据
目前,TPO-RA联合IST的治疗策略已得到了国内外权威指南推荐,为SAA患者一线治疗标准方案。
观点评述

参考文献:
1. Kapoor S, et al. Best Pract Res Clin Haematol. 2021 Jun;34(2):101274.
2. 付蓉. 骨髓衰竭症的精准鉴别[J]. 中国实用内科杂志, 2022, 42(10): 824-830.
3. 中华医学会血液学分会红细胞疾病(贫血)学组. 中华血液学杂志, 2022, 43(11) : 881-888
4. Shallis RM, et al. Eur J Haematol. 2018 Dec;101(6):711-720.
5. Zang M, et al. J Clin Lab Anal. 2022 Oct;36(10):e24677.
6. Evangelia Vlachodimitropoulou, et al. Blood 2017; 130 (17): 1923–1933.
7. Scheinberg P. Int J Hematol. 2024 Mar;119(3):248-254.
8. Peng G, et al. Ther Adv Hematol. 2022 Mar 30;13:20406207221085197.
9. Yang W, et al. Exp Hematol Oncol. 2023 Feb 1;12(1):16.
10. Shen S, et al. Ann Hematol. 2024 Aug 23.












