骨髓纤维化(MF)是预后较差的一种骨髓增殖性肿瘤(MPN),确诊后中位生存期约5年。JAK-STAT信号通路异常激活是MF发生的主要分子机制,随着JAK抑制剂的临床应用,尽管接受该类药物治疗的MF患者可有改善疾病症状负担等方面的获益,但仍无法逆转疾病进程,部分病人治疗耐受性差、药物选择有限等问题仍然是MF临床治疗的挑战。近年来,随着研究者的持续探索,MF治疗迎来了更多新型药物,为未来治疗变革的发展奠定了良好基础。JAK抑制剂治疗MF面临多重瓶颈,临床亟需更优选择
芦可替尼于2017年3月在中国获批上市,是首个应用于临床的Janus激酶(JAK)抑制剂,适用于IPSS中、高危MF患者。多个临床试验已经证实了芦可替尼对MF患者具有缩小脾脏、改善MF相关症状、提高患者生活质量等积极作用。然而,芦可替尼并不能特异性抑制突变型JAK2的酶活性,而是无差别地抑制所有JAK激酶,这也就导致芦可替尼对机体的正常造血功能不可避免地存在抑制作用,可引起贫血、血小板和中性粒细胞减少等多种不良反应。在芦可替尼治疗的前8周内,约一半的患者因3/4级血小板减少需要调整剂量或暂时中断治疗,同时合并出血的发生率较高1。临床研究的长期结果显示,只有25%的MF患者在用药5年后继续接受芦可替尼治疗,停止治疗的原因包括疾病进展、药物不良反应和疗效不佳2。而停药后患者预后极差,中位生存期仅为14个月3。此外,芦可替尼由于抑制JAK1而减少了炎症细胞因子的产生,如果突然中断治疗,细胞因子风暴的急性反弹可导致出现停药综合征,其临床表现极为多样,从疾病相关症状的急性复发、脾脏体积迅速增大、细胞减少症恶化到更严重的并发症,如急性呼吸窘迫综合征、弥散性血管内凝血、脾梗死和肿瘤溶解样综合征4。芦可替尼治疗失败后,可供选择的治疗方案有限,包括化疗、其他JAK抑制剂、异基因造血干细胞移植或再次重启芦可替尼。有研究报道,97例对芦可替尼耐药的MF患者采用非德替尼治疗6个周期后,46例(55%)患者脾脏体积较基线缩小≥35%,23例(26%)患者症状总评分下降≥50%4。然而,非德替尼常见的血液学不良反应仍为贫血和血小板减少,在该药物的关键III期研究中,接受治疗后出现3/4级贫血的患者比例为52%5。综合而言,MF患者在疗效与安全性俱佳的药物选择上存在尚未满足的需求,这促使研究者开始研发更多高效低毒的小分子药物。
以JAK抑制剂为基础的联合策略崭露锋芒,助力MF治疗模式变革近年来,除了JAK-STAT通路之外,BCL-2、BET、PI3K和XPO-1等信号通路的异常也被证实在MF的发病和耐药机制中扮演重要角色。基于这一发现,JAK抑制剂与其他通路抑制剂的联合治疗策略被投入研究之中。BET蛋白家族通过细胞因子上调和由此产生的促炎状态、巨核细胞生成失调和BM纤维化来增强促MF发生基因的表达。临床前研究数据显示,同时抑制BET和JAK可协同降低MPN疾病负担,从而为后续的联合研究提供了强有力的依据6。MANIFEST-2是一项全球性、随机、双盲、对照的III期研究,探讨了Pelabresib(一种BET抑制剂)联合芦可替尼与安慰剂联合芦可替尼在未经JAK抑制剂治疗的MF患者中的疗效和安全性7。在第24周时,Pelabresib联合治疗组有65.9%的患者实现了脾体积减少≥35%(SVR35),而芦可替尼组的这一比例为35.2%,差异具有统计学意义(P<0.001)。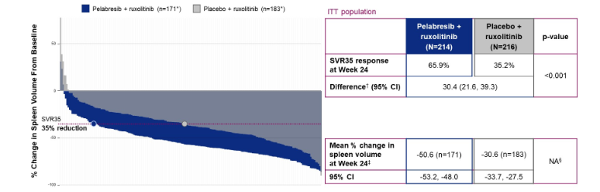 图1.Pelabresib联合治疗组和芦可替尼组24周时实现SVR35的应答率
图1.Pelabresib联合治疗组和芦可替尼组24周时实现SVR35的应答率
血红蛋白(Hb)反应在10.7%(23/214)和6.0%(13/216)的患者中出现,在贫血患者中(基线血红蛋白<10 g/dL),血红蛋白反应分别为16.4%和14.1%。骨髓纤维化程度改善≥1级的患者在Pelabresib联合治疗组和芦可替尼组分别为38.5%和24.2%,差异具有统计学意义(P=0.019)。在接受安全性评估的患者中,最常见的治疗相关不良事件在Pelabresib联合治疗组与芦可替尼组分别为贫血(43.9% vs 55.6%)、血小板减少症(32.1% vs 23.4%)、血小板计数下降(20.8% vs 15.9%)和腹泻(23.1% vs 18.7%)。这一研究结果的公布显示了芦可替尼联合Pelabresib治疗的良好疗效,且与单药相比未增加不良反应风险,支持将MF患者潜在的治疗模式转变为联合治疗。但是,该研究随访时间尚短,联合治疗能否改善中、晚期MF患者远期预后这一问题仍需更多研究结果来回答。除了BET抑制剂之外,较为热门的联合治疗药物还包括BCL-2抑制剂Navitoclax和XPO1抑制剂塞利尼索。Navitoclax的随机、双盲、对照的III期试验比较了Navitoclax联合芦可替尼与芦可替尼联合安慰剂在初治中高危MF成年患者中的安全性和有效性8。结果显示,主要终点达成,24周时Navitoclax联合治疗显著改善了SVR35(63.2% vs. 31.5%,p < 0.0001)。然而,研究未能在次要终点上显示出显著的优越性,在第24周时,Navitoclax联合治疗组的TSS相对于基线的平均变化为-9.7,而芦可替尼组为-11.1(P=0.2852)。在XPORT-MF-034试验的I期研究阶段,评估了塞利尼索与芦可替尼联合方案在初治MF患者中的疗效和安全性9。24例患者接受了每周一次40mg(n=10)或60mg(n=14)塞利尼索,芦可替尼的起始剂量基于血小板水平,结果显示,在60 mg组中,SVR35和TSS50的比例更高,分别为79%和58%,相比之下40mg组为38%和25%,且安全性特征无显著差异。在有反应的患者中,观察到了驱动突变负荷的减少、促炎细胞因子水平的降低以及骨髓中红细胞CD71+细胞数量的增加10。因此,60mg每周一次的塞利尼索被选为该研究双盲、随机、安慰剂对照III期研究的推荐剂量。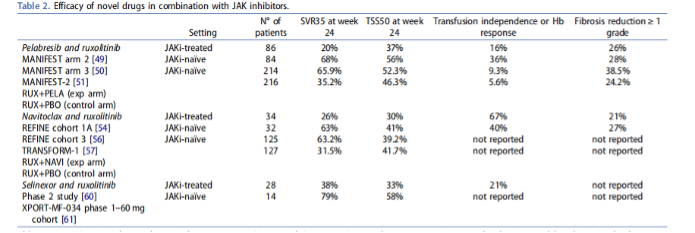 图2.JAK抑制剂不同联合治疗策略的疗效
图2.JAK抑制剂不同联合治疗策略的疗效
回顾这些鼓舞人心的临床研究,不难发现,联合治疗取得的SVR35是芦可替尼单药治疗两倍左右。更重要的是,联合治疗与活动性生物标志物相关,如突变负荷和炎症细胞因子表达水平的下降、骨髓纤维化的程度逆转和贫血的改善,这也预示着联合治疗具有改变疾病进程的潜力,进而有望为患者改善长期生存10。拓展阅读:
2023年EHA大会上公布了一项多中心前瞻性队列研究11,该研究在真实世界中评估了塞利尼索联合芦可替尼方案治疗MF的疗效。患者的中位治疗持续时间为154天(26~372天)。在可评估脾脏的患者中,6/13(46%)达到SVR35或通过触诊评估的脾脏缩小。15例有可用数据且接受了至少8周治疗的患者中,13/15(87%)的症状得到缓解。最常见的治疗不良反应是恶心(55%)、呕吐(40%)、食欲下降(30%)和贫血(25%)。这项研究显示塞利尼索联合芦可替尼方案具有治疗MF的良好潜力,且安全性较好,期待未来随机对照研究结果的公布,为MF患者带来更多联合治疗选择。
尽管近几年在发病机制、诊断和治疗方面取得了重大进展,但MF目前仍是一种具有重大挑战的疾病。临床医生需密切关注患者的临床需求,如随着疾病进展患者贫血、疲劳等症状逐渐恶化时,应及时调整治疗策略,为患者提供个体化治疗,比如相较于芦可替尼,莫洛替尼在缓解MF相关贫血方面更具优势。近年来,临床工作者认识到JAK抑制剂本身不足以实现延缓MF疾病进展和提高患者生存的治疗目标,联合疗法已经在各项临床研究中显示出了良好的疗效,在改善贫血和骨髓纤维化方面具有巨大潜力,可谓是有望突破当前JAK抑制剂单药的治疗瓶颈,成为未来治疗模式的风向标。然而,现有研究招募的人群特征不同,未来需进一步明确的问题是,JAK抑制剂与其他药物联合治疗的最佳获益人群;此外,目前新型药物联合的JAK抑制剂多为芦可替尼,尚缺乏其他JAK抑制剂的数据,这也是未来可进一步开展的研究方向。

参考文献:
2.Wang Z, et al. Ann Hematol. 2024 Mar 18.3.Newberry KJ, et al. Blood. 2017 Aug 31;130(9):1125-1131.4.王晓慧,等.临床医药实践, 2022(005):031.5.Pardanani A, et al. JAMA Oncol. 2015 Aug;1(5):643-51.6.Rippel N, et al. Expert Opin Pharmacother. 2024 Jul 1:1-12.7.Raajit Rampal, et al.ASCO 2024 Abstract 65028.Pemmaraju N,et al. Blood (ASH Annual Meeting Abstracts). 2023;142 (Suppl Supplement 1):6209.Ali H,et al. J Clin Oncol. 2023;41 (16 Suppl):7063.10.Tiribelli M, et al. Expert Opin Pharmacother. 2024 Apr;25(6):743-754.11.Minghui Duan,et al.EHA 2023.Abstract P1052
 图1.Pelabresib联合治疗组和芦可替尼组24周时实现SVR35的应答率
图1.Pelabresib联合治疗组和芦可替尼组24周时实现SVR35的应答率 图2.JAK抑制剂不同联合治疗策略的疗效
图2.JAK抑制剂不同联合治疗策略的疗效











