弥漫性大B细胞淋巴瘤(DLBCL)具有高度侵袭性,在非霍奇金淋巴瘤(NHL)中占比约30~40%。在利妥昔单抗+环磷酰胺+阿霉素+长春新碱+泼尼松(R-CHOP)方案成为标准治疗方案后,约50~60%的DLBCL患者可治愈,然而部分患者对R-CHOP方案不敏感。约10%的DLBCL为原发性难治性疾病,30~40%的DLBCL最终会发展为复发性DLBCL。常规治疗用于早期复发或难治性(R/R)DLBCL患者的效果较差。尽管许多药物单用时显示出有效性,然而它们很少引起疾病的深度缓解或治愈,仅在某些分子亚型的患者中偶尔出现较为理想的缓解情况。随着遗传和功能基因组学研究的深入,DLBCL的发生机制逐渐明确,不断推动相关靶向药物的开发,为患者提供新的治疗选择。研究背景
既往针对DLBCL的研究表明靶向药物联合使用具有协同作用,因此研究者假设同时抑制多条通路可治愈某些分子亚型的DLBCL。活化B细胞(ABC)亚型DLBCL的生存途径可被某些靶向药物阻断,包括布鲁顿氏酪氨酸激酶(BTK)抑制剂伊布替尼(靶向B细胞受体(BCR)依赖的核因子(NF)-κB活化)、糖皮质激素(靶向近端BCR信号)、B细胞淋巴瘤2(BCL2)抑制剂维奈克拉和来那度胺(间接靶向Ikaros、Aiolos和干扰素调节因子4(IRF4))。临床前研究表明,这些药物联合使用可协同杀伤DLBCL细胞系。因此,一项发表于新英格兰医学期刊的研究探索了上述药物联合方案用于DLBCL患者的临床价值1。拓展阅读:
一篇2014年发表于Proc Natl Acad Sci U S A的研究表明,伊布替尼可与多种药物产生协同作用,例如磷脂酰肌醇3激酶-蛋白激酶B(PI3K-AKT)通路抑制剂、其他B细胞受体通路抑制剂、BCL-2家族抑制剂及若干用于DLBCL的化疗药物2。另一篇2012年发表于Cancer Cell的研究表明,来那度胺通过促进干扰素β(IFNβ)生成并对IRF4等因子进行调节,杀死 DLBCL细胞。伊布替尼阻断BCR信号通路,也可减弱IRF4的调节作用。来那度胺与伊布替尼具有协同作用3。这提示多种药物的联合使用可能会对患者体内复杂的信号通路发挥叠加的调节作用,未来的科研人员可针对更多药物进行尝试,确定更适合患者的治疗方案。
一项Ⅰb/Ⅱ期研究纳入60例R/R B细胞淋巴瘤患者。Ⅰb期研究纳入20例患者(其中10例为DLBCL患者),Ⅱ期研究纳入40例CLBCL患者。在Ⅰb期研究中,患者于每个周期的第2~14天分别使用4个剂量水平(200、400、600、800 mg)的维奈克拉,于第1~14天每天使用560 mg伊布替尼,于第1~7天每天使用100 mg泼尼松,于第1~2天每天使用1000 mg奥妥珠单抗,于第1~14天每天使用15 mg来那度胺(见图1)。Ⅰb期研究旨在探索维奈克拉的Ⅱ期研究推荐剂量。Ⅱ期研究纳入各20例生发中心B细胞(GCB)和非GCB DLBCL患者,根据推荐Ⅱ期剂量(RP2D)使用上述联用方案(ViPOR方案,每个周期21天,共6个周期)直至疾病进展或出现不可耐受的毒性。患者于治疗前接受全外显子组学和转录组学测序分析。研究于基线、治疗和随访期间对患者进行计算机断层扫描(CT)、氟脱氧葡萄糖正电子发射断层扫描(FDG-PET)和骨髓活检(见图1),并进行药代动力学(PK)分析。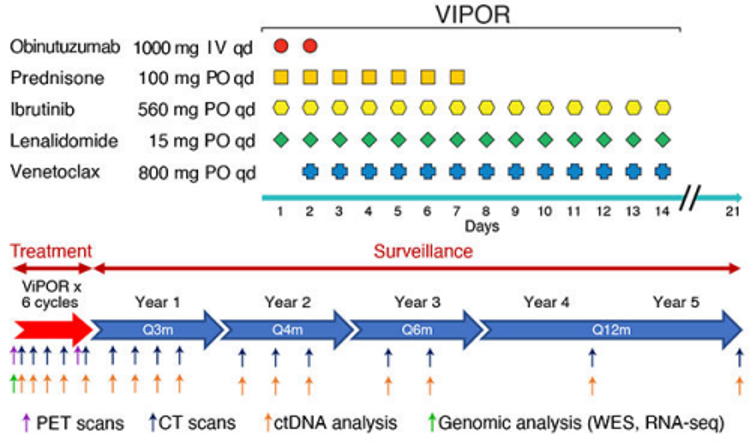 图1. ViPOR治疗方案和治疗后的指标监测
图1. ViPOR治疗方案和治疗后的指标监测
Ⅰb期研究中,维奈克拉的RP2D为800 mg。超过三分之二的患者出现血液学不良事件(见图2),出现≥3级中性粒细胞减少症、血小板减少症和贫血的周期分别占比24%、23%和7%。唯一发生率≥10%的≥3级非血液学不良事件为低钾血症(28%),然而任意级别低钾血症的发生率为67%,需要更换电解质。其他非血液学不良事件包括腹泻(68%)、恶心(45%)、皮疹(35%)和乏力(33%)。42%的患者发生严重不良事件,以非中性粒细胞减少性发热最为常见。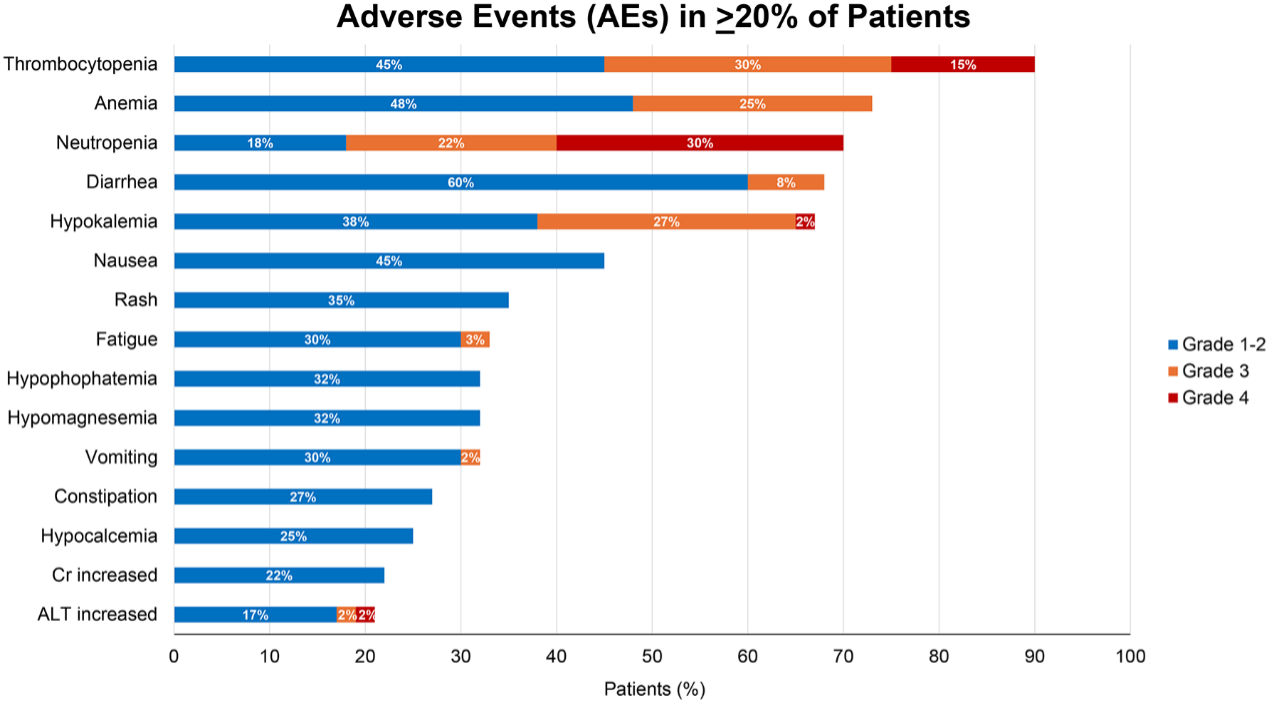 图2.研究中出现的不良事件
图2.研究中出现的不良事件
分别有17%和25%的患者因药物毒性进行剂量调整和治疗延迟。5例患者由于出现不可耐受的不良事件或并发症而停止治疗。维奈克拉、伊布替尼和来那度胺的PK分析结果与已发表的单药数据相当,表明没有明显的药物相互作用。ViPOX方案起效迅速,半数患者达到缓解且缓解可持续48例DLBCL患者可评估疗效。总体缓解率(ORR)为54%(26/48),完全缓解率为38%(18/48)(见图2)。达到缓解的中位时间为0.66个月。在达到完全缓解的患者中有72%的患者其缓解可持续,患者未接受巩固治疗。各亚型中,非生发中心B细胞弥漫性大B细胞淋巴瘤非特指型(非GCB DLBCL(NOS))、高级别伴MYC和BCL2重排的双打击B细胞淋巴瘤(HGBCL-DH-BCL2)、伴MYC和BCL6重排的双打击B细胞淋巴瘤(HGBCL-DH-BCL6)、富含T细胞/组织细胞的大B细胞淋巴瘤(THRLBCL)、生发中心B细胞弥漫性大B细胞淋巴瘤非特指型(GCB DLBCL(NOS))的完全缓解(CR)率分别为62%、53%、33%、20%、0%(见表1)。中位随访时间为40个月。所有DLBCL患者的2年无进展生存率为34%(图3)。在出现缓解的患者中,缓解持续2年的患者占比65%,这部分患者在完全缓解和部分缓解的患者中分别占比78%和38%。各亚型中,非GCB DLBCL(NOS)、HGBCL-DH-BCL2、HGBCL-DH-BCL6、THRLBCL、GCB DLBCL(NOS)患者的2年无进展生存率分别为39%、47%、33%、40%、8%。接受ViPOR方案二线治疗的DLBCL患者与接受ViPOR方案三线或后线治疗的患者相比,无进展生存(PFS)得到改善(风险比(HR)0.33(95%置信区间(CI):0.17-0.66))(见表1)。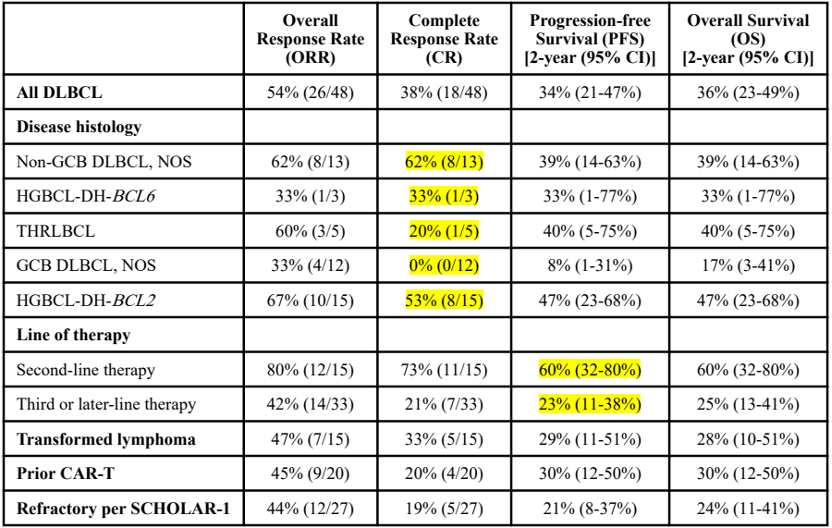 表1.治疗缓解率和患者生存率
表1.治疗缓解率和患者生存率
PET影像学结果和循环肿瘤DNA(ctDNA)水平与患者预后相关与治疗结束时多维尔评分为1~4的患者相比,多维尔评分为5分的患者PFS(HR 0.22(95% CI:0.10-0.48))和总生存(OS)(HR 0.19(95% CI:0.08-0.43))较差。此外,与基线时总代谢肿瘤体积(TMTV)、病变糖酵解(TLG)基线时低于中位数的患者相比,高于中位数的患者实现完全缓解的可能性较小,PFS和OS较差。患者接受ViPOR方案治疗后,ctDNA浓度迅速下降,所有患者中有33%、PET完全缓解患者有93%的在治疗结束时无法检测到ctDNA。基线ctDNA浓度升高≥2.5 log10 hGE/mL与治疗后PFS和OS较差相关,而与可检测到ctDNA的患者相比,在第1、2周期或治疗结束时未检测到ctDNA与PFS和OS改善相关。ViPOR方案药物具有协同作用,EZB-MYC+细胞系对维奈克拉敏感性更高研究使用ABC细胞系模型(n=4)对药物进行高通量筛选,以双剂量反应滴定的方式测量4种小分子ViPOR药物的细胞毒性,并对药物的协同作用进行量化。虽然所有药物的二联组合都观察到协同细胞毒性,但协同模式有所不同。例如,泼尼松的活性代谢物泼尼松龙与维奈克拉联合使用在其中2种ABC模型中具有协同作用,而泼尼松龙联合来那度胺在另外2种模型中具有协同作用,泼尼松龙+伊布替尼在所有四种模型中都具有协同作用(图3)。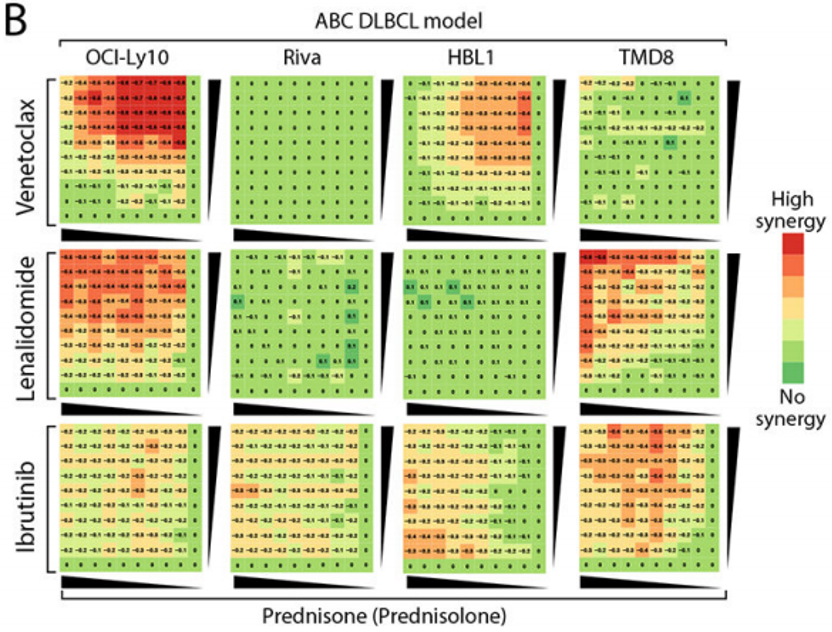 图3. ViPOR方案中双药组合在4个ABC DLBCL细胞系中的协同作用热图
图3. ViPOR方案中双药组合在4个ABC DLBCL细胞系中的协同作用热图
研究通过定量测定2~24 h内的细胞凋亡,单独测试了每种ViPOR药物,并将4种药物组合进行了测试。在两种ABC模型中,4种药物联合比任何单药都能产生更快、更显著的细胞凋亡(图4)。因此,虽然单个DLBCL模型对ViPOR方案的双药反应不同,但所有四种ViPOR药物的组合克服了这种功能异质性。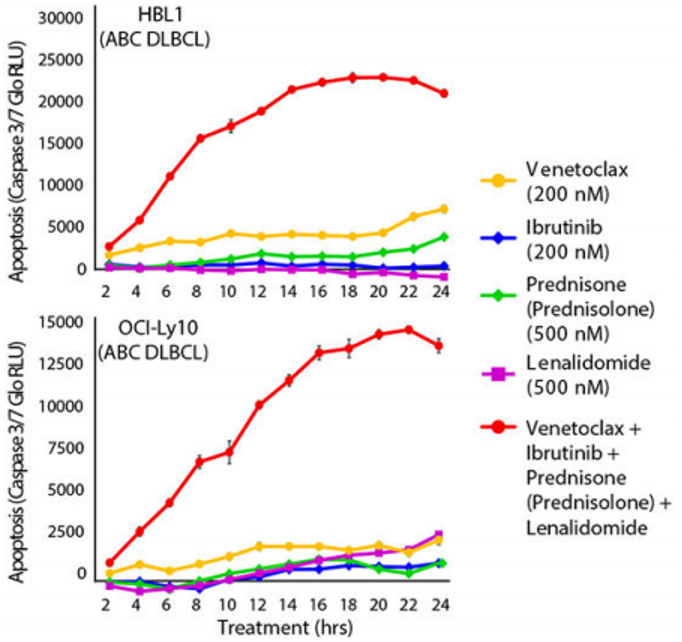 图4. ABC DLBCL细胞系与ViPOR方案药物(单药或联合)共培养2~24 h内的细胞凋亡
图4. ABC DLBCL细胞系与ViPOR方案药物(单药或联合)共培养2~24 h内的细胞凋亡
接受ViPOR方案治疗的患者其肿瘤样本的全外显子组和RNA测序结果显示,MCD亚型患者的ORR(83%)明显高于所有其他亚型的DLBCL患者(22%)和所有非MCD患者(32%)(图5)。此外,1例N1型DLBCL患者也获得了完全缓解。在各基因表达亚型中,ABC(57%)和未分类DLBCL(38%)患者的完全缓解率最高,GCB DLBCL患者最低(27%)。结果表明,MCD和可能的N1遗传亚型ABC DLBCL患者可能从ViPOR方案治疗中获益,因为这些亚型与BCR依赖的NF-κB活化相关性更高。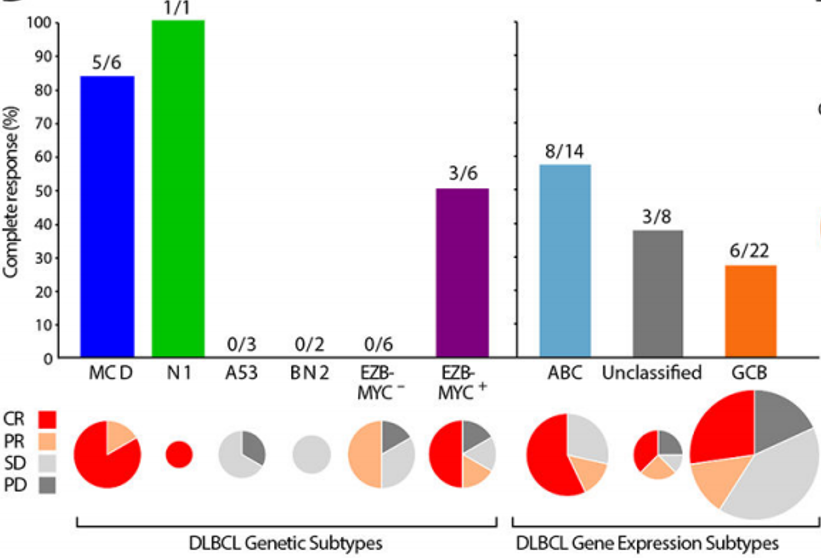 图5.接受ViPOR方案治疗的各亚型患者的缓解率
图5.接受ViPOR方案治疗的各亚型患者的缓解率
HGBCL-DH-BCL2患者在接受ViPOR方案治疗后具有较高的持久完全缓解率。这些肿瘤在DLBCL遗传学分类中属EZB-MYC+,而其他GCB DLBCL属EZB-MYC-、ST2和BN2亚型(见图6)。EZB-MYC+组的完全缓解率(50%)高于EZB-MYC-组(0%),这表明MYC和BCL2的双重易位可能赋予了肿瘤对ViPOR方案的敏感性。验证实验结果表明,EZB-MYC+细胞系对维奈克拉的敏感性明显高于EZB-MYC-或其他GCB模型,而这些细胞系与其他ViPOR药物的差异并不一致(图6)。这一发现表明,维奈克拉对BCL2的抑制可能是EZB-MYC+ DLBCL患者对ViPOR治疗产生持久完全缓解的重要因素。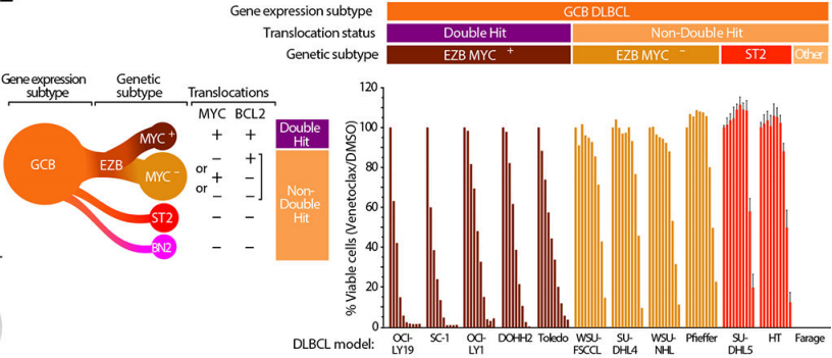 图6. BCL2抑制剂维奈克拉溶液(0.01~10.0 μM)处理后GCB DLBCL细胞系的正常细胞活力
图6. BCL2抑制剂维奈克拉溶液(0.01~10.0 μM)处理后GCB DLBCL细胞系的正常细胞活力
拓展阅读:
2023年一篇发表于国际输血及血液学杂志的临床研究纳入23例R/R DLBCL患者,使用伊布替尼+维奈克拉联合方案对其进行治疗。中位6个周期的治疗后,患者的ORR达39.1%,其中26.1%患者达CR、13%患者达PR。单因素分析结果显示,P53突变阳性患者的中位PFS及OS期均显著短于P53突变阴性者(中位PFS期:4.4个月 vs. 7.0个月,P=0.012;中位OS期:4.6个月 vs. 8.9个月,P=0.007]4。这提示伊布替尼+维奈克拉联合方案用于某些特定亚型的患者可能疗效更优。未来可深入探索这两种药物的相关作用机制并对患者群体进行更加细致的划分,进一步改善有效性。
本研究揭示了BTK抑制剂伊布替尼、BCL2抑制剂维奈克拉、免疫调节剂来那度胺等药物的联合方案用于DLBCL患者可表现出协同作用,Ⅱ期研究6个周期ORR达54%,且MCD亚型患者的ORR高达83%,大幅高于其他亚型患者。结果表明不同靶点药物的联合方案,与单药方案相比有效性更佳,且联合方案似乎更适用于某些亚型的患者。此外,针对R/R DLBCL,目前有多种药物正在进行研究,例如靶向药物中的分子通路抑制剂、单克隆抗体、抗体-药物偶联物、表观遗传修饰药物,免疫疗法中的免疫调节剂、免疫检查点抑制剂、嵌合抗原受体(CAR)-T细胞治疗药物,相信随着科技的快速发展,更多更加有效的药物不久后即可问世。这提示研究者未来可针对更多靶点进行发掘并探索药物的详细作用机制,建立明确的用药方案,并根据患者体内的分子标志物更细致地划分适用人群,进一步提升治疗的有效性。联合用药在本研究中显示出了令人欣喜的疗效,然而,多种药物联合使用可能对安全性提出挑战。希望临床医生在为患者选择治疗方案时,还需考虑到各个药物的安全性、使用便利性及患者的经济水平甚至患者本人的意愿,综合各方面因素,提升患者的用药依从性,最终改善患者结局。
1.Melani C, Lakhotia R, Pittaluga S, et al. Combination Targeted Therapy in Relapsed Diffuse Large B-Cell Lymphoma. N Engl J Med. 2024 Jun 20;390(23):2143-2155.
2.Mathews Griner LA, Guha R, Shinn P, et al. High-throughput combinatorial screening identifies drugs that cooperate with ibrutinib to kill activated B-cell-like diffuse large B-cell lymphoma cells. Proc Natl Acad Sci U S A. 2014 Feb 11;111(6):2349-54.
3.Yang Y, Shaffer AL 3rd, Emre NC, et al. Exploiting synthetic lethality for the therapy of ABC diffuse large B cell lymphoma. Cancer Cell. 2012 Jun 12;21(6):723-37.
4.王新华,杨延昕,梁远征,等. 伊布替尼联合维奈克拉治疗复发/难治性弥漫大B细胞淋巴瘤患者的疗效和安全性评价[J]. 国际输血及血液学杂志,2023,46(2):141-148.  图1. ViPOR治疗方案和治疗后的指标监测
图1. ViPOR治疗方案和治疗后的指标监测 图2.研究中出现的不良事件
图2.研究中出现的不良事件 表1.治疗缓解率和患者生存率
表1.治疗缓解率和患者生存率 图3. ViPOR方案中双药组合在4个ABC DLBCL细胞系中的协同作用热图
图3. ViPOR方案中双药组合在4个ABC DLBCL细胞系中的协同作用热图 图4. ABC DLBCL细胞系与ViPOR方案药物(单药或联合)共培养2~24 h内的细胞凋亡
图4. ABC DLBCL细胞系与ViPOR方案药物(单药或联合)共培养2~24 h内的细胞凋亡 图5.接受ViPOR方案治疗的各亚型患者的缓解率
图5.接受ViPOR方案治疗的各亚型患者的缓解率 图6. BCL2抑制剂维奈克拉溶液(0.01~10.0 μM)处理后GCB DLBCL细胞系的正常细胞活力
图6. BCL2抑制剂维奈克拉溶液(0.01~10.0 μM)处理后GCB DLBCL细胞系的正常细胞活力











