在血液恶性肿瘤的治疗领域,免疫调节药物(IMiDs)已成为治疗方案的重要组成部分,而在多发性骨髓瘤(MM)的治疗中,从沙利度胺的首次应用到二代药物来那度胺和三代泊马度胺的临床开发,IMiDs使得这类患者生存期得到了显著延长的同时却也存在着复发耐药的问题。若想进一步提高疗效,优化目前的治疗策略,解决患者耐药,就必须深入分析疾病的致病因素及IMiDs的作用机制。目前可以确定,肿瘤微环境、遗传学特征以及免疫逃逸在疾病进展中均有一定作用,而IMiDs的作用机制相当复杂,涉及多种机制的协同,目前仍不够明确。因此,从基础研究的角度出发对来那度胺与泊马度胺的抗肿瘤活性进行分析,探索其药理作用机制、分子结构及在耐药性问题上的潜在差异,或许可以为MM的治疗策略提供新的视角。IMiDs作用机制
IMiDs在肿瘤治疗中的具体靶点和确切的作用机制目前尚不明确,大量临床前研究表明,IMiDs通过一系列复杂的机制发挥其抗肿瘤作用1。在直接抗肿瘤效应方面,IMiDs能够通过激活凋亡信号通路和下调抗凋亡蛋白的表达,诱导肿瘤细胞周期停滞和凋亡。在直接作用之外,这类药物还能够调节肿瘤微环境与免疫应答。IMiDs通过增强T细胞和NK细胞的活性,提高对肿瘤的免疫反应,同时抑制调节性T细胞(Tregs)的扩增,减少肿瘤的免疫逃逸。与此同时,IMiDs可以通过调节骨髓基质细胞分泌的趋化因子来抑制新血管的形成,降低TNFα和PGE2等炎症因子的产生、下调肿瘤细胞和免疫细胞表面的粘附分子以干扰肿瘤细胞与基质的相互作用、直接作用于破骨细胞,抑制其成熟和活性,减少肿瘤相关的骨病变。这些免疫调节、影响骨髓微环境以及抗肿瘤、抗血管生成活性也使得IMiDs成为了骨髓增生异常综合征(MDS)的一种新的治疗手段。在相关研究中,研究人员发现,IMiDs还可以刺激红细胞生成、直接抑制del(5q)的克隆细胞增殖并诱导其凋亡、逆转与MDS相关的细胞学和细胞遗传学异常,进一步改善无效造血,这些机制共同作用,使得IMiDs成为治疗MDS,尤其是低风险MDS患者和del(5q)患者的有效药物2。拓展阅读:
来那度胺是低风险MDS的二线治疗选择之一,根据NCCN(2020)推荐,单纯5q-异常的症状性贫血及低危患者MDS患者可使用免疫调节剂来那度胺,约67%的患者治疗后可脱离输血依赖。既往研究表明,来那度胺可以恢复红系祖细胞对促红细胞生成剂(ESA)的敏感性,然而,van de Loosdrecht等人的研究结果表明,在中低风险MDS患者中,来那度胺单独使用或联合ESA/G-CSF的疗效并没有显著差异3。不过,这一研究中,ESA/G-CSF与来那度胺并非同时给药,这一序贯给药研究的结果仍有待在进一步的研究中验证。
来那度胺与泊马度胺作为二代及三代IMiDs,均属于沙利度胺类似物,但化学结构有所不同,泊马度胺在邻苯二甲酰亚胺环上具有两个氧原子和一个氨基,而来那度胺则有一个氨基和一个羧基1。与沙利度胺相比,这两种药物体外抑制TNFα的效力显著更高,且在共刺激T细胞方面也表现出了显著优势。二者都通过与Cereblon(CRBN)结合发挥作用,泛素化并降解Ikaros(IKZF1)和Aiolos(IKZF3)等底物蛋白,而泊马度胺所引起的降解更快、更有效,这可能是由于泊马度胺的C4氨基可以直接与Ikaros转录因子相互作用。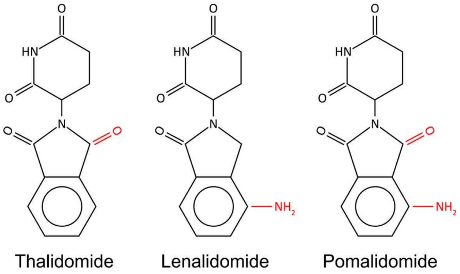 图1.三种药物分子结构5
图1.三种药物分子结构5
研究表明,相较于来那度胺,泊马度胺的免疫调节作用更强,抗炎及抗增殖活性均相对更高。尽管目前仍缺乏泊马度胺与来那度胺头对头比较的相关研究,但Verhelle等人在细胞系中的研究表明,泊马度胺和来那度胺均可以上调恶性B细胞中p21WAF-1的表达,进一步导致细胞周期停滞和抑制细胞增殖,但是,泊马度胺在这一过程中的活性更高,意味着泊马度胺有着更强的调节细胞周期进程和凋亡作用4。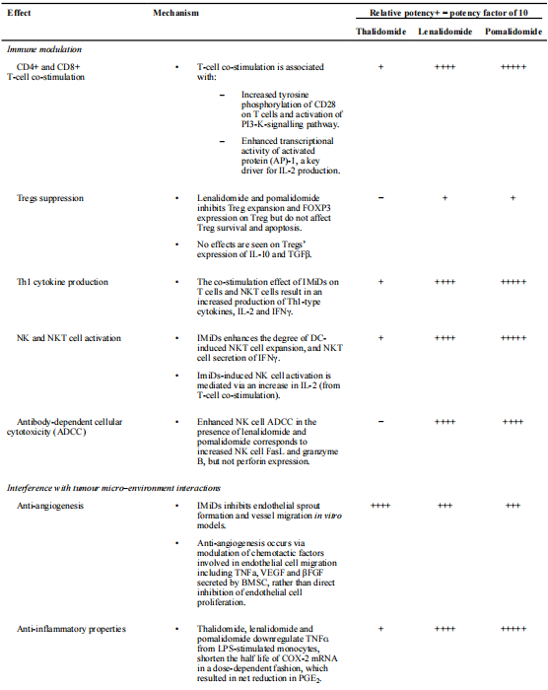 表1.三种药物机制对比1
表1.三种药物机制对比1
拓展阅读:
来那度胺是MM一线治疗的常用药物之一,然而,既往研究表明,不少患者在首次复发时即表现出来那度胺耐药,因此,探索来那度胺的耐药机制对于后续治疗决策而言非常重要,然而,来那度胺的作用机制仍不够明确,其耐药机制同样相当复杂。2023年,Kulig等人对来那度胺耐药的可能机制进行了汇总分析5。研究人员提出,CRBN的缺失或表达下调、CRBN及下游蛋白编码基因的突变、DNA甲基化等表观遗传因素、特定表面抗原的表达模式改变、CDK6的上调、SUMOylation的改变、IL-6和STAT3的激活等均可能导致来那度胺耐药。针对来那度胺耐药的机制,恢复或调节CRBN、使用泊马度胺等其他IMiDs、应用单克隆抗体和新型蛋白酶体抑制剂等治疗策略均有望用于来那度胺耐药的MM患者。
尽管分子结构有相似之处,两种药物与CRBN的结合位点并不相同,因此,来那度胺和泊马度胺不存在交叉耐药性。Ocio等研究人员使用小鼠模型对两种药物的耐药性进行了探索6。研究人员发现,小鼠连续接受来那度胺联合地塞米松(LD)或泊马度胺联合地塞米松(PD)治疗后,在大约30天后表现出获得性耐药,且两种药物组合处理的细胞显示出了不同的基因表达谱,且对关键靶蛋白CRBN及其底物Aiolos和Ikaros的需求存在差异。在更换药物组合对耐药小鼠进行治疗后,新的治疗方案再次表现出了疗效。Rychak等人的体内外研究进一步表明,泊马度胺与地塞米松联合给药在来那度胺耐药的MM细胞系中显示出了显示出协同的抗增殖和促凋亡效果7。 图3.泊马度胺对来那度胺耐药的MM细胞系抑制作用7
图3.泊马度胺对来那度胺耐药的MM细胞系抑制作用7
拓展阅读:
目前,国内外已有多个探索泊马度胺治疗经来那度胺治疗后复发/耐药的MM患者的临床试验,整体而言,泊马度胺显著延长了患者的生存期。泊马度胺中国人群单臂研究共纳入74例复发或难治性多发性骨髓瘤(RRMM)患者,其中74.3%对来那度胺耐药8。从临床数据来看,中位OS为24.3个月,ORR达37.8%,疗效数据与MM-002和MM-003相似。此外,OPTIMISMM研究的亚组分析表明,首次复发的患者接受泊马度胺治疗获益更高,ORR可达到91.4%9。
近年来,基于在临床试验中展露的疗效及良好的耐受性,来那度胺已成为MM一线治疗的选择之一,但随着临床数据的积累,来那度胺的耐药问题逐渐成为制约疗效的瓶颈,而泊马度胺区别于沙利度胺及来那度胺的分子结构和作用机制为克服耐药提供了新的策略。然而,泊马度胺的剂量优化、长期安全性等方面仍需要进一步明确,且这一三代IMiDs的耐药问题同样需要解决。从基础研究的结果不难看出,来那度胺和泊马度胺在MM的治疗中各有所长,且不存在交叉耐药性,因此,二代及三代药物的联合使用或序贯治疗或许可以为患者提供更大的临床获益。正如前文中提到的,这类药物的作用机制尚不明确,因此,这两种药物的最佳用药方案仍需结合其分子机制的差别在未来进一步探索,通过基础研究来指导临床实践,为患者提供更加精准有效的治疗策略。

1.Quach H, et al. Leukemia. 2010 Jan;24(1):22-32.
2.Castelli R, et al. Clin Lymphoma Myeloma Leuk. 2013 Feb;13(1):1-7.
3.van de Loosdrecht AA, et al. 2024 Apr;38(4):840-850.
4.Verhelle D, et al. Cancer Res. 2007 Jan 15;67(2):746-55.
5.Kulig P, et al. Cancers (Basel). 2023 Feb 2;15(3):963.
6.Ocio EM, et al. Leukemia. 2015 Mar;29(3):705-14.
7.Rychak E, et al. Br J Haematol. 2016 Mar;172(6)889-901.
8.Fu WJ, et al. BMC Cancer. 2022 Jul 1;22(1):722.
9.Richardson PG, et al. Eur J Haematol. 2022 Jan;108(1):73-83.  图1.三种药物分子结构5
图1.三种药物分子结构5 表1.三种药物机制对比1
表1.三种药物机制对比1 图3.泊马度胺对来那度胺耐药的MM细胞系抑制作用7
图3.泊马度胺对来那度胺耐药的MM细胞系抑制作用7











