血小板减少症的病理机制相当复杂,可能由骨髓功能障碍、自身免疫性疾病、感染、药物诱导或其他不明原因引起。在众多治疗血小板减少症的方案中,TPO-RA因其作用于TPO受体、直接刺激血小板生成为患者提供了新的治疗选择,其药理作用机制和临床效果一直是研究的热点。海曲泊帕与艾曲泊帕同为小分子非肽类TPO-RA药物,并且已经在原发性免疫性血小板减少症(ITP)、肿瘤治疗所致血小板减少症(CTIT)、再生障碍性贫血(AA)等多个疾病领域中显示出了一定的疗效。虽然海曲泊帕和艾曲泊帕在作用机制上存在一定的相似性,但它们作为升板药物的具体表现并不完全一致。对于那些使用艾曲泊帕未见明显疗效的患者来说,改用海曲泊帕也有可能够获得满意的治疗效果。通过深度探索这两种药物在药理学上的差异,我们或许能够找到海曲泊帕疗效优越的原因。海曲泊帕更有效促进巨核细胞增殖分化
在海曲泊帕的临床前研究中,研究人员对海曲泊帕和艾曲泊帕的药理学进行了深入分析对比1。研究表明,海曲泊帕与艾曲泊帕均可以诱导转染人TPO受体的32D细胞(32D-MPL)的增殖,不过,海曲泊帕的EC50值为0.4 nmol/L,远低于艾曲泊帕的13.4 nmol/L。TPO-RA类药物与TPO受体结合后可刺激多种细胞内信号通路,例如JAK/STAT、PI3K/AKT和ERK1/2等,这些信号传导途径的差异性可能也是导致海曲泊帕与艾曲泊帕在疗效上存在差异的因素。研究人员发现,与rhTPO类似,海曲泊帕与艾曲泊帕均诱导TPO介导的下游信号通路主要成分磷酸化,包括STAT3、STAT5、ERK1/2和AKT,不过,与艾曲泊帕相比,海曲泊帕对于下游信号的刺激显著增强,且持续时间更长。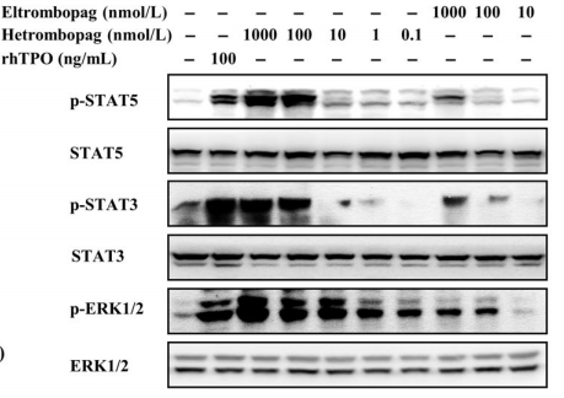 图1.海曲泊帕与艾曲泊帕对下游通路的作用
图1.海曲泊帕与艾曲泊帕对下游通路的作用
拓展阅读:
目前上市的TPO-RA药物大多为小分子非肽类药物,现有的证据表明,罗普司亭作为人TPO模拟肽,与小分子非肽类药物的作用位点不同,对下游信号通路激活的程度也不尽相同,相较与艾曲泊帕,罗普司亭更主要地激活AKT信号通路,对于STAT和ERK通路的激活较弱2。但是,从海曲泊帕与艾曲泊帕的数据来看,这些小分子非肽类药物由于各自结构的独特性,其药效学与药代动力学特性也有很大差别。阿伐曲泊帕是另一种小分子非肽类TPO-RA,使用苯并噻唑结构而非酰肼结构,同样与TPO受体的跨膜结构域相结合,激活下游JAK/STAT、MAPK等多个信号传导途径,促进巨核细胞的增殖和分化的同时具有抗凋亡效应3。体外研究表明,阿伐曲泊帕促进巨核细胞增殖分化的能力同样优于艾曲泊帕。海曲泊帕和艾曲泊帕都能够刺激人骨髓来源的CD34+细胞的增殖,并促进这些细胞分化成巨核细胞,二者促进CD34+细胞增殖的EC50值分别为2.3和86.2 nmol/L,刺激巨核细胞分化的EC50值分别为4.5和80.8 nmol/L,海曲泊帕治疗后,成熟巨核细胞的比例显著上升。此外,海曲泊帕与TPO受体结合、诱导STAT3、STAT5和ERK1/2磷酸化的水平呈剂量依赖性,效果优于艾曲泊帕。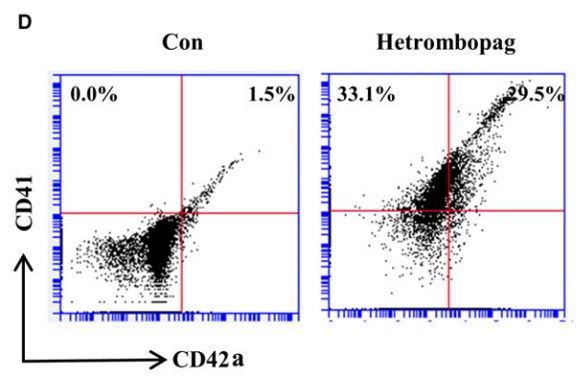 图2.海曲泊帕加速巨核细胞成熟
图2.海曲泊帕加速巨核细胞成熟
在小鼠体内的研究表明,海曲泊帕可以特异性激活TPO受体,在促进32D-MPL细胞增殖方面的确有比艾曲泊帕更高的效力,且海曲泊帕的体内活性与剂量正相关。拓展阅读:
艾曲泊帕是海曲泊帕的先导化合物,而海曲泊帕保持了艾曲泊帕原有的关键金属螯合区域相互作用,加大了疏水性片段苯环上的取代基基团以进一步提高亲脂性并提升药物活性,同时使用呋喃环替代联苯结构中的末端苯环,这种氧原子电负性更大的结构将增强羧酸片段的酸性,以此显著增强药物活性,这也是海曲泊帕达到有效治疗水平的药物浓度大幅降低的原因之一。尽管目前上市的TPO-RA类药物给患者提供了多种治疗方案的选择,但是,相关的头对头试验依旧很少,因此,仍旧缺乏ITP患者二线治疗选择的推荐标准。在临床实践中,二线治疗药物更多地依据患者和医生的偏好及个体化因素来决定。2021年I-WISh研究的结果表明,减少自发出血、维持安全稳定的血小板水平是ITP相当重要的治疗目标4。海曲泊帕的药理学特性意味着这种药物起效更快,而在临床实验中,海曲泊帕可以维持患者的血小板技术水平,且对于艾曲泊帕治疗无效的患者改用海曲泊帕后也实现了血小板应答,这也为患者和医生的临床决策提供了重要的参考依据。
进一步研究表明,海曲泊帕能够通过上调G1期相关蛋白,如p-RB、Cyclin D1和CDK4/6,促进细胞从G1期过渡到S期,从而推动细胞周期的正常化。在细胞因子剥夺导致G1期阻滞后,海曲泊帕通过刺激32D-MPL细胞,增加G2和S期细胞的比例,减少G1期细胞的比例,从而促进细胞重新进入细胞周期并进一步维持细胞周期进程。此外,通过上调BCL‐XL和MCL‐1、下调促凋亡BAK的表达,海曲泊帕可以减少细胞凋亡,这不仅有助于维持巨核细胞的数量,也有助于维持细胞周期的正常进行,防止细胞在周期的早期阶段发生凋亡。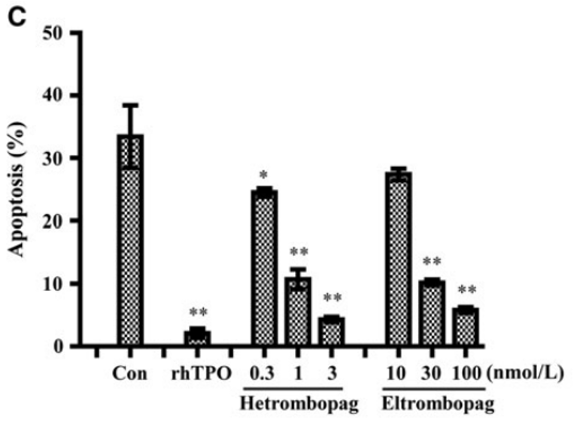 图3.海曲泊帕抑制细胞凋亡
图3.海曲泊帕抑制细胞凋亡
拓展阅读:
BAX是BCL-2家族蛋白之一,在调控细胞凋亡中起着关键作用。实际上,艾曲泊帕也有一定的抑制细胞凋亡的功能。2021年,Adam Z. Spitz等人在Nature Communications杂志上发表的文章中指出,艾曲泊帕具有直接抑制BAX蛋白的活性、抑制细胞凋亡的潜力5。通过使用计算方法、NMR分析、分子动力学模拟和细胞实验,研究人员发现,艾曲泊帕可以与BAX高亲和力结合,并且阻止由tBID和BIM-BH3介导的BAX激活。具体而言,艾曲泊帕能够直接与BAX蛋白的N端触发位点结合,阻止BAX的构象转变,使得这种蛋白维持在非活性状态,同时诱导BAX蛋白的远端构象变化,增强非活性状态的稳定性,再加上对BAX从细胞质到线粒体转位的抑制,艾曲泊帕可以抑制BAX介导的细胞凋亡。从药理学层面来看,海曲泊帕与TPO受体的结合具有高度特异性和亲和力,能够快速激活TPO受体介导的JAK/STAT、PI3K/AKT和ERK1/2等信号传导途径,进一步促进巨核细胞的增殖分化,最终实现升板目的。此外,海曲泊帕抑制细胞凋亡的作用有利于维持巨核细胞数量。
TPO-RA药物的药理作用机制、临床疗效及安全性已经得到了广泛的研究和讨论,其中海曲泊帕这种新型口服TPO-RA类药物在临床前模型和临床试验中展现出的疗效,不仅在提升血小板数量上表现出了潜力,且生物利用度更高、半衰期较长、代谢方式对肾脏造成的负担较小,同时不与多种药物代谢酶发生相互作用、不影响其他药物的代谢、无铁离子螯合风险,在药代动力学和药物相互作用方面也显示出了独特的优势。对传统方案或艾曲泊帕治疗无效、不耐受的患者而言,海曲泊帕可能是一种安全有效的治疗选择。海曲泊帕与艾曲泊帕的药理学差异为血小板减少症的临床治疗提供了更为精准的药物选择依据,也为未来的药物开发和治疗策略提供科学的理论支持。至于海曲泊帕在不同血小板减少症中的疗效和安全性,以及如何更好地与其他治疗手段结合以实现最佳的治疗效果,仍有必要在未来的研究中进一步探索。
1.Xie C, et al. J Cell Mol Med. 2018 Nov;22(11)5367-5377.
2.Raslova H, et al. Haematologica. 2016 Dec;101(12):1443-1445.
3.Kuter DJ. Blood Rev. 2022 May;53:100909.
4.王茹婷, 等. 中华血液学杂志, 2021, 42(5) : 369-375.
5.Spitz AZ, et al. Nat Commun. 2021 Feb 18;12(1):1134.  图1.海曲泊帕与艾曲泊帕对下游通路的作用
图1.海曲泊帕与艾曲泊帕对下游通路的作用 图2.海曲泊帕加速巨核细胞成熟
图2.海曲泊帕加速巨核细胞成熟 图3.海曲泊帕抑制细胞凋亡
图3.海曲泊帕抑制细胞凋亡












