多发性骨髓瘤(MM)是一种克隆性浆细胞异常增殖的恶性疾病,是血液系统常见的恶性肿瘤之一,其典型病程特点是对最初治疗有所反应,随后产生耐药性。大量研究证实沙利度胺及其衍生物来那度胺、泊马度胺为代表的免疫调节剂(IMid)在初治和复发难治性MM中有显著疗效,且在诱导、巩固、维持各个阶段均发挥了重要作用,已经成为了MM临床治疗的基石药物。然而,MM仍不可治愈,随着单克隆抗体、免疫检查点抑制剂、CAR-T、抗体偶联药物(ADC)等新兴药物的获批上市,推动了诸多新型联合治疗方案的发展,极大地改变了MM的治疗格局,有望进一步改善患者预后。达雷妥尤单抗联合来那度胺维持治疗助力NDMM患者实现持续MRD阴性
3期随机对照PERSEUS研究初期分析证明在适合移植的新诊断多发性骨髓瘤(NDMM)患者中,D-VRd(达雷妥尤单抗、硼替佐米、来那度胺联合地塞米松)方案诱导/巩固后DR(达雷妥尤单抗、来那度胺)维持,与VRd方案诱导/巩固后R维持相比,显著延长患者的PFS并加深缓解程度。今年EHA大会进一步报告了该研究可检测微小残留病(MRD)的分析结果1。在709例随机分组的患者(D-VRd,n=355;VRd,n=354)中,D-VRd组的完全缓解率显著更高(巩固治疗结束:44.5% vs 34.7%;P=0.0078;总体研究:87.9% vs 70.1%;P <0.0001)。随着时间推移,两组MRD阴性率持续增加,但无论是在维持治疗后12个月、24个月还是36个月,D-VRd组的MRD阴性率均显著高于VRd组(P<0.0001)。此外,D-VRd组≥12个月的持续MRD阴性患者比例更高(10–5:64.8%vs 29.7% ,P=0.0028;10–6:47.3% vs 18.6%,P<0.0001)。在巩固治疗结束时MRD阳性的患者中,D-VRd组在DR维持治疗期间有更高比例患者转为MRD阴性(10–5:68.8% vs 52.7%, P=0.0330;10–6:62.3% vs 31.0%,P <0.0001)。在巩固治疗结束和整体研究中,MRD阴性均与改善的无进展生存期(PFS)相关。综合来看,该研究结果支持D-VRd诱导/巩固后DR维持治疗作为适合移植NDMM患者的新标准治疗。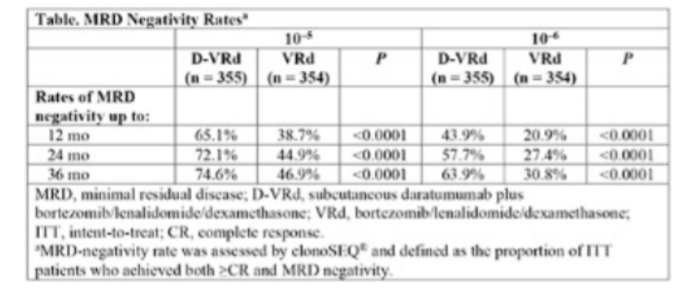 表1.D-VRD及VRD治疗NDMM后实现MRD阴性的患者比例
表1.D-VRD及VRD治疗NDMM后实现MRD阴性的患者比例
拓展阅读:
大多数MM患者会经历复发耐药最终复发的历程,为了尽可能延长患者生存,维持治疗的选择显得尤为重要。根据2024版NCCN多发性骨髓瘤指南,来那度胺仍然是适合移植NDMM患者的1类推荐维持治疗药物,而对于高危MM,指南推荐两种药物联合治疗策略,包括硼替佐米/来那度胺、卡非佐米/来那度胺和达雷妥尤单抗±来那度胺。MRD是MM最有力的预后因素之一,然而,该指标在指导治疗策略方面的应用价值仍受到争议。2023年,一项研究探索了TOURMALINE-MM3研究和TOURMALINE-MM4研究中的1280例符合/不符合移植条件MM患者的MRD动态预后价值3。结果发现,9.5%的患者从MRD阴性转换为MRD阳性,在此过程中,获得了与始终保持MRD阳性患者相当的不良预后(2年PFS率约为30%)。相反,5.1%的患者从MRD阳性转换为MRD阴性,并且在此过程中,保持了与持续MRD阴性患者相似的PFS(2年PFS约为75%),说明从MRD阴性转化为MRD阳性的患者的疾病进展风险增加。未来在该研究基础上,可进一步探索缩短MRD持续阴性患者的维持治疗时间,减轻用药负担的潜在可能。
对于多重耐药的RRMM患者,Talquetamab联合泊马度胺显示出快速、深度缓解Talquetamab是第一个被批准的靶向GPRC5D受体的双特异性抗体(BsAb),该项多臂、1b期研究评估了Talquetamab联合泊马度胺在多重耐药复发难治性(RR)MM患者中的疗效与安全性4。截至2023年10月11日,共招募了35例患者,既往中位治疗线数为3。每周一次(QW)队列(n=16)和每两周一次(Q2W)队列(n=19)分别有31.3%和21.1%患者三药耐药;6.3%的患者五药耐药(均在QW队列中)。结果显示,在两组队列中,最常见的不良事件为味觉相关事件(85.7%)、感染(80.0%)和细胞因子释放综合症(CRS;74.3%,大多为1/2级)。91.4%的患者出现了3/4级不良事件;最常见的是中性粒细胞减少症(54.3%)、贫血(25.7%)、感染(22.9%)和血小板减少症(20.0%)。68.6%、74.3%和20.0%的患者分别出现了指甲、皮肤和皮疹毒性反应(大多数为1/2级)。3名患者出现了免疫效应细胞相关神经毒性综合征(ICANS,均为1级)。34.3%和45.7%的患者因不良事件减少了药物剂量;77.1%和20.0%的患者因不良事件延迟了药物剂量。4名患者(11.4%)因不良事件停止治疗,其中一名患者因肺栓塞(与药物无关)死亡。疗效数据显示,QW队列和Q2W队列的总体缓解率(ORR)分别为93.8%和84.2%;在高风险细胞遗传学特征和既往接受过泊马度胺或CAR-T治疗的患者中,ORR均超过75%。QW队列和Q2W队列首次反应的中位时间分别为1.7个月和1.2个月。中位缓解持续时间(DOR)和无进展生存期(PFS)均未达到。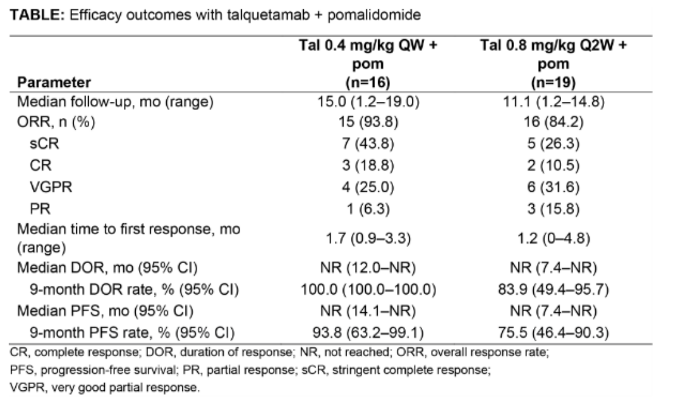 表2. Talquetamab联合泊马度胺的疗效
表2. Talquetamab联合泊马度胺的疗效
拓展阅读:
泊马度胺是第3代免疫调节剂(IMiD),相较于一、二代IMid具有更强的抗MM活性和相似的安全性,于2013年获美国食品药品管理局(FDA)批准用于治疗复发难治MM5。然而,随着目前泊马度胺在MM临床治疗中的广泛应用,耐药性问题仍然无可避免。2021年,一项研究分析了泊马度胺耐药MM队列的基因变化,约1/3泊马度胺难治性MM患者出现cereblon基因改变 ,携带异常cereblon基因患者较无改变者的无进展生存期(PFS)明显降低,证实cereblon蛋白下调或基因改变是MM获得性免疫调节剂耐药的重要机制6。近年来,新型IMid药物Iberdomid的开发有望克服耐药性,其对cereblon蛋白的结合亲和力是来那度胺或泊马度胺的20倍。2023年,一项多中心开展的多队列Ⅰ/Ⅱ期研究评估了Iberdomide联合地塞米松治疗在重度预处理RRMM(既往接受中位数≥5线疗法)成年患者中的疗效与安全性7。结果显示,剂量递增队列(0.3mg-1.6mg)和剂量扩展队列(1.6mg)的总体反应率分别达到32%和26%,且剂量递增队列未达到最大耐受剂量。虽然服用 Iberdomide后会出现中性粒细胞减少、感染、贫血、疲劳等不良反应,但仅7%患者因不良反应停药,安全性处于耐受范围内,这些结果都支持 Iberdomid的进一步临床开发。今年EHA大会上报道的泊马度胺联合新型双抗药物则是克服耐药性的另一思路,从不同作用机制入手,需注意的是,该研究入组的患者有相当比例是三重耐药,这类人群存在极大尚未满足的临床需求,基于良好的缓解比率,该组合疗法的长期生存数据值得关注。
近几年来,随着研究的不断深入,MM新药层出不穷,患者的肿瘤缓解程度得到显著加深,尤其是蛋白酶体抑制剂、免疫调节剂、单克隆抗体、激素的联合治疗方案为患者带来了更深层次的缓解。然而,三类药物暴露MM的后续复发治疗难度提升,患者生存率极低。目前,临床普遍认可若是短期内复发,同类药物应用可进行升级,如从来那度胺升级为泊马度胺,从硼替佐米升级为卡非佐米,或是换用不同作用机制药物。CAR-T、双抗、抗体偶联药物等免疫治疗在MM领域的研发如火如荼,但是药物高昂价格所带来的经济负担以及尚未证实的远期药物不良反应仍是需攻克的难题。新药时代下,患者和临床医生更应格外意识到规范诊疗的重要性,无论是初治还是复发阶段盲目叠加新药绝非良策,必须结合患者基础状况、疗效、安全性、可及性等多方因素,合理安排药物组合和给药顺序,才能让MM患者的治疗之路走得稳、走得远。此外,MRD的预后价值被越来越多研究高度肯定,但利用MRD监测结果指导MM临床决策仍是一个具有争议的话题,但就目前的研究数据来看,MM的未来治疗模式有望朝着适应性治疗的方向发展。基于MM的高度异质性,MRD在该疾病领域的应用前景相当广阔,包括指导维持治疗的减量或停止;残留病灶的强化巩固治疗以及对于早期生化复发的干预。期待随着未来更多研究结果的公布,MRD监测能够促进MM向个性化治疗模式迈进。

参考文献:
1.Emma Searle, et al. 2024 EHA. Abstract P911.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)Multiple Myeloma Version 4.2024
3.Paiva B,et al. Blood. 2023;141(6): 579-591.
4.Pieter Sonneveld,et al.2024 EHA Abstract S201.
5.中国临床肿瘤学会(CSCO)白血病专家委员会,等. 白血病·淋巴瘤, 2022, 31(6) : 321-329.
6.Gooding S, et al. Blood. 2021 Jan 14;137(2):232-237.
7.LONIAL S, et al. Lancet Haematol,2022,9(11):822-832.  表1.D-VRD及VRD治疗NDMM后实现MRD阴性的患者比例
表1.D-VRD及VRD治疗NDMM后实现MRD阴性的患者比例 表2. Talquetamab联合泊马度胺的疗效
表2. Talquetamab联合泊马度胺的疗效











