慢性髓性白血病(CML)是一种骨髓造血干细胞克隆性增殖形成的恶性肿瘤,目前,酪氨酸激酶抑制剂(TKI)为CML的标准治疗药物,一代、二代TKI均被推荐作为CML一线治疗药物。从真实世界数据来看,大多数患者的一线治疗选择均为一代TKI伊马替尼,二、三代TKI则作为伊马替尼不耐受或耐药的二线治疗药物。但是,随着对CML疾病异质性认识的加深、药物临床数据及对比分析逐渐公布,伊马替尼在初诊CML患者治疗中的定位需要重新评估,能够提供更快分子应答和更高深度分子应答率的二代TKI究竟适用于哪些患者也需进一步考量。约90%到95%的CML患者中存在费城染色体(Ph),染色体9和22之间的易位导致BCR和ABL1基因融合,BCR-ABL1融合基因编码异常的酪氨酸激酶,该激酶在缺乏正常调控的情况下持续性激活,导致下游JAK/STAT、PI3K/AKT、RAF、MYC和RAS/MEK等信号传导途径异常活化,进一步导致白血病细胞的增殖并抑制其凋亡1。TKI可以特异性地结合到BCR-ABL1融合蛋白的活性中心,抑制BCR-ABL1酪氨酸激酶活性并阻断下游信号途径。TKI成功使得CML从一种致命性疾病转化为一种可以长期控制的慢性疾病。根据《慢性髓性白血病中国诊断与治疗指南》推荐,慢性期CML患者(CP-CML)首选治疗为TKI,包括伊马替尼、尼洛替尼及氟马替尼,至于具体药物选择,指南强调,应在明确治疗目标的基础上,依据患者初诊预后分层、个体状况、基础疾病、合并用药的情况来选择一线治疗药物。拓展阅读:
2021年,王慧芳等研究人员对中国CML患者TKI治疗状况进行了调研,研究结果在《中华血液学杂志》上发表2。研究人员发现,自2019年开始,一线治疗选择二代TKI的患者比例明显增加,但是,中国CML患者的一线治疗选择仍以伊马替尼为主,占到了所有受访者的84.6%。
CML治疗的首要目标是提高患者生存率,然而,随着TKI的问世,无治疗缓解(TFR)逐渐成为了CML的治疗目标之一,但无论是哪一代TKI,均有实现TFR的可能。一项META分析的数据表明,在一线治疗中,一代TKI与二代TKI在OS、PFS等生存率相关终点方面并没有太大的差别,而达沙替尼、尼洛替尼、博舒替尼等二代TKI在主要分子应答(MMR)等其他疗效方面显著优于伊马替尼3。研究表明,达到早期分子学应答(EMR,即3个月时BCR-ABL1 IS ≤10%)是影响新诊断CP-CML患者预后的重要因素,而深度分子学应答(DMR)持续时间则可能是实现TFR的唯一显著相关因素4。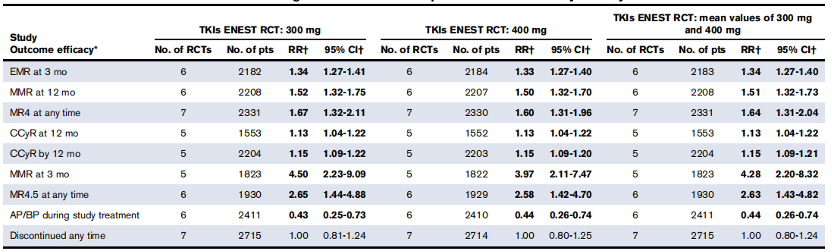 表1.二代TKI与伊马替尼相较的有效性数据3
表1.二代TKI与伊马替尼相较的有效性数据3
在实际应用中,对于老年患者而言,生存可能是首要的治疗目标,TFR稍显次要,因此,在这些患者中,伊马替尼可能是更优的一线治疗药物;在年轻患者中,TFR则更显重要,因此,二代TKI可能成为这类初诊患者的第一选择。需要注意的是,老年患者可能面临特定的TKI药物不良反应风险,包括胸腔积液和动脉血栓等,因此,需要结合患者疾病缓解情况,及时调整治疗目标。拓展阅读:
对于大多数患者而言,可以在达到停药标准后尝试减少剂量或停药,但是,罕见的、非典型CML患者无法使用国际量值进行检测,非典型CML的BCR-ABL1融合基因为阴性,无法准确测量MMR、MR4.5等RQ-PCR终点,因此,这类患者的治疗目标不应为TFR。与此同时,诊断时未进行RQ-PCR检测、不确定BCR-ABL1转录类型的患者也不应尝试TFR。在发表于2016年、题为Moving treatment-free remission into mainstream clinical practice in CML的文献中,Timothy P Hughes等研究人员提到,加速期和急变期CML患者即使在经历治疗后达到第二慢性期,也不应该停止TKI治疗5。不过,这类患者的一线治疗药物选择应该结合疾病风险类型进行考量。
目前,国内外已经有了多个CML预后模型,包括Sokal评分、Hasford评分、EUTOS评分和ELTS评分以及国内江倩教授团队开发的“一线伊马替尼治疗失败(IMTF)预测模型”。多个临床试验的数据证实,中高危评分的CML患者选择二代TKI作为一线治疗方案可能有更高的临床获益,对于低风险患者而言,一、二代TKI的疗效没有显著差别。此外,基线状态下的不良遗传学特征可能会影响到TKI的疗效,包括高危附加染色体异常以及ASXL1基因突变等,有学者认为,二代TKI可能消除这些不良预后突变的影响,但是这些因素尚未纳入CML风险评估模型。拓展阅读:
ASXL1基因突变是CML患者中最常见的体细胞突变之一,Aram Bidikian于2022年在《Blood Cancer Journal》杂志上发表了一篇题为Prognostic impact of ASXL1 mutations in chronic phase chronic myeloid leukemia的文章,研究人员发现,ASXL1突变的发生率达到了14%,且这类患者预后较差,无事件生存期(EFS)和无失败生存期均比不携带体细胞突变的患者更短。多变量分析表明,ASXL1突变是CP-CML中与更差EFS唯一相关的独立风险因素6。同样在2022年,Lioba Schönfeld等研究人员发现,携带ASXL1突变的CML患者对尼洛替尼治疗的分子应答较差,与其他患者相比,12、18和24个月时达到MMR的患者比例均较低。而在实现MMR的ASXL1突变患者中,部分患者的ASXL1突变被清除,但是,仍有部分患者在治疗过程中突变持续存在,即使达到了MMR仍可检测到ASXL1突变7。这项研究以ASXL1 mutations predict inferior molecular response to nilotinib treatment in chronic myeloid leukemia的题目发表于《Leukemia》杂志。整体而言,二代TKI究竟能否为有不良遗传学特征的CML患者提供持久获益,仍需要进一步研究确定。
随着分子靶向治疗的快速发展,CML的治疗药物选择逐渐丰富,伊马替尼作为第一代TKI,在CML治疗中的地位毋庸置疑,但并非初诊CML患者治疗的唯一选择,第二代和第三代TKI已经在临床试验中显示出了一定的优势,可为患者带来更优的长期预后。此外,随着基因组学和个体化医疗的发展,针对CML患者预后较差体细胞突变等特定遗传背景的个体化治疗策略也被提出,但具体用药选择尚为形成共识。值得一提的是,导致TKI耐药的ABL突变在TKI治疗后产生,且一代TKI耐药的实际发生率并不高,因此,这一因素无法影响患者一线治疗的选择。在治疗过程中,医生需要根据患者的个体情况、疾病风险评估、以及患者的偏好来制定最合适的治疗计划。与此同时,临床试验和对疾病机制的进一步揭示将为CML患者精准治疗的药物选择提供新的见解和策略。

参考文献:
1.Rinaldi I, et al. J Blood Med. 2023 Apr 6;14:261-277.
2.王慧芳,等. 中华血液学杂志, 2021, 42(7) : 535-542.
3.Vener C, et al. Blood Adv. 2020 Jun 23;4(12):2723-2735.
4.Bonifacio M, et al. Blood Cancer J. 2024 Mar 26;14(1):53.
5.Hughes TP, et al. Blood. 2016 Jul 7;128(1):17-23.
6.Bidikian A, et al. Blood Cancer J. 2022 Oct 28;12(10):144.
7.Schönfeld L, et al. Leukemia. 2022 Sep;36(9):2242-2249.  表1.二代TKI与伊马替尼相较的有效性数据3
表1.二代TKI与伊马替尼相较的有效性数据3











