基于肿瘤微环境的复杂机制,神经母细胞瘤(NB)患者即使接受了囊括手术、化疗、放疗、自体干细胞移植和GD2单抗在内的多模式治疗,仍然面临着疾病复发的难题。儿童肿瘤协作组(COG)发布的数据显示,免疫治疗开始后患者的2年无事件生存率(EFS)为66%,但在4年时下降到59%,这一数据揭示了预防NB复发的临床需求。
在许多恶性肿瘤中,多胺的水平较正常情况明显升高。多胺水平的升高与细胞增殖、凋亡减少相关。鸟氨酸脱羧酶(ODC)是多胺代谢中的首个限速酶,而二氟甲基鸟氨酸(DFMO)是ODC的不可逆抑制剂,能直接抑制ODC的活性,降低多胺水平进而防治肿瘤。
DFMO于1978年由Merrell Dow研究中心的科学家最早合成,最初其应用局限于治疗昏睡病和减少毛发生长。随着2004年到2010年研究者开展的一系列临床前研究初步证实了ODC和MYCN基因之间的关系,DFMO迎来了在NB中应用的突破口。
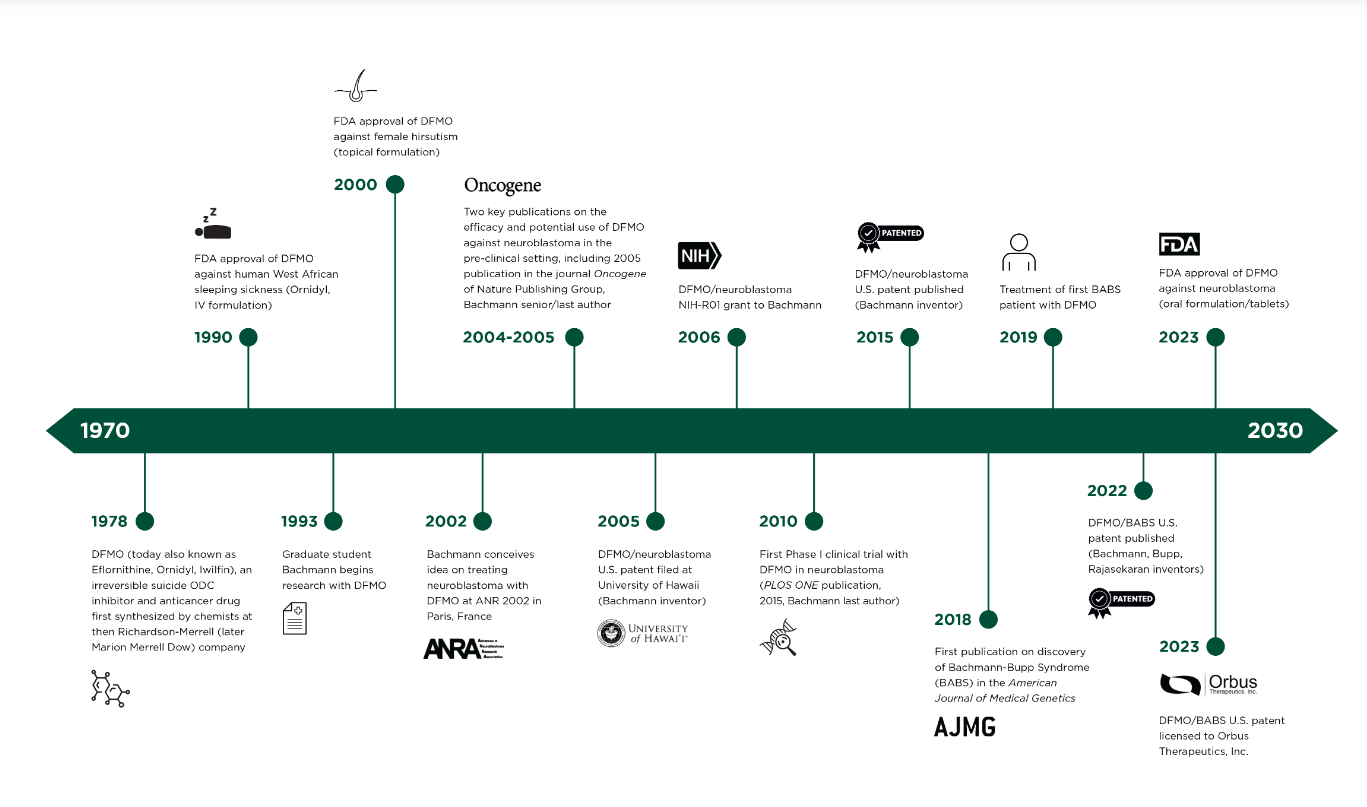
图1.DFMO的研发历程
2008年的一项研究表明在MYCN扩增的神经母细胞瘤中,ODC1的表达显著升高(p<0.001)。此外,ODC1表达高的患者无事件生存率(EFS)显著低于ODC1表达低的患者(38% vs 76%,p<0.001)。
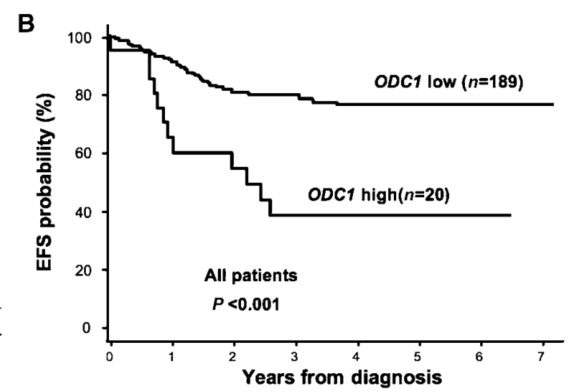
图2.ODC表达水平与NB患者预后关系
随后的研究进一步证实ODC和多胺途径中的其他几个基因是MYCN的转录靶标。ODC基因表达直接被MYCN激活,在一部分患者中与MYCN共扩增,表明MYCN基因扩增导致ODC高表达和随后的高多胺水平,从而促进NB持续发展。由于在30%的NB中存在MYCN扩增,因此ODC过表达在患者中很常见。这些事实均证明了靶向ODC是一个充满潜力的治疗方案。
除了MYCN基因,DFMO也已经被证实可影响LIN28-Let 7通路,该通路影响许多细胞过程,包括癌症干细胞的调节和糖酵解代谢。LIN28是一种miRNA结合蛋白,在未分化细胞中高表达,具有致癌特性。Let-7是一种miRNA,通过抑制癌基因转录作为肿瘤抑制因子。LIN28和Let-7在整个发育过程中受到高度调控,并通过一个双负反馈回路相互作用。研究发现,DFMO处理降低了NB细胞系中LIN28B和MYCN蛋白水平,增加了Let-7 miRNA水平。在体内试验中,经DFMO处理后,糖酵解代谢活性降低。此外,研究也证实了对DFMO处理的敏感性与LIN28过表达相关,这也提示LIN28有可能成为DFMO治疗反应的标志物。正是这些大量的临床前研究奠定了DFMO治疗NB的作用机制,并推动DFMO走向临床试验。
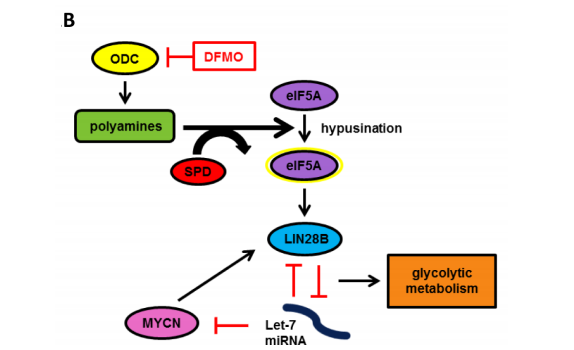
从研究设计入手,挖掘DFMO治疗高危NB患者生存数据背后的“秘密”
早在2018年,研究者开展了一项单臂、开放标签、II期研究(NMTRC003B),评估了DFMO在接受过标准高危治疗的101名NB患者以及接受过挽救性治疗的39名复发难治性NB患者中的疗效,所有受试者接受每日2次的750±250mg/m2 DFMO,治疗持续2年。鉴于DFMO的口服特性,在家庭中持续给药达2年是可行的。
研究结果显示,DFMO治疗高危NB的2年EFS率高达84%,OS率高达97%,而复发难治性NB患者的2年EFS率达54.8%,OS率达84.6%。

图4.DFMO治疗高危及复发难治性NB患者的疗效
该项研究中,DFMO治疗最常见的毒性是2-3级转氨酶升高,发生率达9%。76%患者在研究开始时已有听力损失,有5名(4%)患者的听力损失在治疗后加剧,需要暂时停止治疗。DFMO引起的听力损失是可逆的,所有患者的听力都恢复到了基线水平。根据DFMO申办方提供给FDA的简报文件,安全性总结显示311名患者参与安全性分析,其中43.7%报告了3或4级不良反应,排名前三的不良反应是听力下降(11.9%),谷丙转氨酶升高(11.9%)以及天门冬氨酸氨基转移酶升高(11.9%)。对于前期接受过大量化疗药物的高危NB患者,耳毒性确实是一个不可忽视的问题,据统计12.2%接受DFMO的患者听力损失加重并恶化到3级,所以在未来,优化耳毒性管理至关重要。
虽然这项研究的结果显示出DFMO治疗具有良好的生存获益,但是客观分析其研究设计是存在缺陷的。具体来说,单臂研究多用于药物的I期研究阶段,可确定最大耐受剂量以及药代动力学的关键信息。然而,单臂试验无法控制混杂因素,这在很大程度上影响了研究结果的可靠性。此外,应用单臂试验无法确定某种单一药物在联合治疗中的疗效。正如NMTRC003B研究中的受试者在接受DFMO前接受了大量的治疗,包括GD2单抗,那么DFMO在最终生存获益中的贡献就值得思考。
为了弥补这一缺陷,研究者进一步开展了NMTRC003B的外部对照研究,选择的对照数据来源于ANBL0032研究,同时研究还引入了倾向评分匹配和敏感性分析。倾向评分匹配是一种旨在减少已知混杂因素影响的匹配技术,而敏感性分析是用于评估研究结果对不同假设和方法变化敏感程度的一种分析方法。两者在处理观察性研究数据时互补使用,有助于提高研究结果的可靠性和有效性。
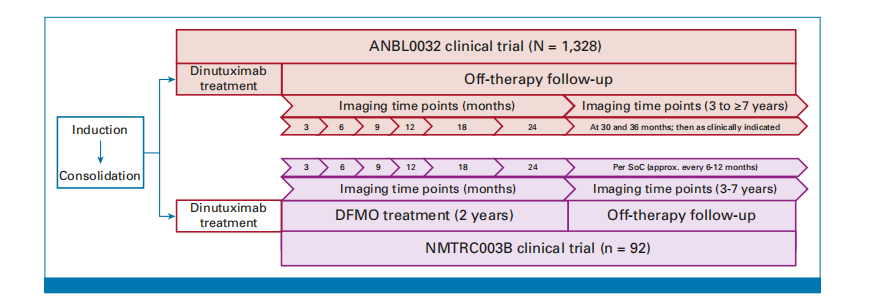
图5.NMTRC003B外部对照研究的流程
结果显示,在总体人群中,与未接受DFMO的外部对照组患者相比,接受DFMO治疗患者的EFS(HR,0.50;p<0.008)和OS(HR,0.38;p<0.007)显著更高。而在倾向评分匹配的队列中,DFMO组的EFS和OS趋势与在总体人群中观察到的一致。此外,针对潜在偏差(如治疗引入时间、治疗时期等)的多重敏感性分析始终有利于DFMO。这项研究结果于2023年10月正式发表,也正是基于此,FDA批准了DFMO作为免疫治疗结束后,实现缓解(至少实现部分缓解)的高危NB患者的维持治疗。
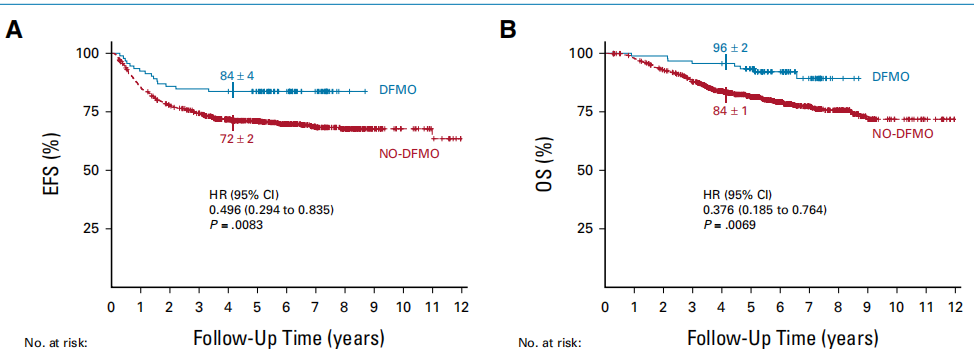
图6.在总人群中,接受DFMO和未接受DFMO治疗的生存差异
虽然比起先前的单臂研究,设计外部对照和引入倾向匹配分析、敏感性分析得以最大程度避免了NMTRC003B结果的偏倚性,但是终究无法在科学性和严谨性上完全媲美随机对照研究。众所周知,随机对照试验被视为临床试验的金标准。回顾高危NB标准治疗的演变,无论是联合自体干细胞移植、串联移植、异维甲酸还是GD2单抗均建立在随机对照研究的结果之上。所以DFMO这项研究设计的特殊性也导致了FDA肿瘤药物咨询委员会的获批审评结果是14票同意,6票反对。
值得一提的是,2024年美国国家综合癌症网络(NCCN)推出了第一部NB指南,在这部指南中,DFMO被推荐作为高危NB免疫治疗后的延续治疗,虽然推荐等级仅为2B级。至于未来DFMO是否能够得到国际上的普遍认可看来仍需要更多研究结果来说话。

联合治疗的大趋势下,DFMO是否具有锦上添花的潜力?
随着研究者对NB耐药机制的深入研究与理解,联合治疗策略已经成为了公认的突破口,联合治疗旨在从多个信号通路杀伤肿瘤。在这一大趋势下,临床研究者也开始开展DFMO联合治疗的相关研究。
DFMO联合化疗的第一项临床试验选择的药物是依托泊苷,这是因为依托泊苷单药被证实治疗复发难治性NB有效,且在临床前模型显示出和DFMO的协同作用。在这项研究中,DFMO剂量范围为500-1500mg/m2,在可评估的18名患者中,最佳缓解情况包括1名患者实现部分缓解,12名患者疾病稳定,5名患者疾病进展。其中有3名患者在开始DFMO治疗后的2-4.5年间仍然存活,且疾病未进展。值得注意的是,这项研究初步表明了单核苷酸多态性与DFMO治疗反应的关系:具有ODC基因rs2302616位点次要等位基因的患者,在基线时尿液多胺水平较高(p=0.02),并且在第一周期的DFMO治疗中总尿液多胺的减少幅度较大(p=0.003),同时这部分患者的中位无进展生存期(PFS)是拥有该位点主要G等位基因患者的三倍以上。事实上,这也间接说明了NB患者对DFMO治疗反应的异质性,提示在未来临床应用DFMO的过程中进行遗传分析或将确定受益最大人群,贴合了当代治疗时代下精准化、个体化的目标。
2024年1月,一项大剂量DFMO联合塞来昔布、环磷酰胺、拓扑替康治疗复发性NB的1期临床试验结果在《British Journal of Cancer》上公布。该项研究剂量递增范围为3000~9000mg/m2,并最终确定了6750mg/m2为最大耐受剂量。该研究入组24名患者中,88%病情复发或进展,96%MIBG显像阳性,50%入组时骨髓受累。血液学毒性在这一重度预处理人群中很常见,3级或4级血小板减少症、白细胞减少症或中性粒细胞减少症发生率分别达92%、74%和68%。疗效评估显示,客观缓解率(CR、PR)达9%,如果纳入轻微反应患者,客观缓解率达26%。随访2年后,整个队列的2年PFS为29.5%,2年OS为58.3%。
ODC在神经母细胞瘤中高度表达,它的特点是具有短半衰期以及快速的蛋白质水解更新速率,因此尽管DFMO是一种不可逆的抑制剂,临床认为更高剂量的DFMO才能实现临床相关的ODC抑制。这项研究实现的客观缓解率确实高于先前DFMO联合拓扑替康的I期研究。然而疗效与安全性的平衡仍然是儿童癌症治疗中面临的难题,6750mg/m2的剂量下,患者的长期安全性如何尚待考证。
令人欣喜的是,DFMO在临床前模型中与免疫治疗显示出协同作用,并可能通过影响免疫效应细胞功能来改变肿瘤免疫环境。化学免疫疗法可谓是近年来复发难治性NB的研究热点,国际上获批上市的三款GD2单抗均已开展相关研究,且取得了良好的客观缓解率和生存数据。目前研究者正在开展一项II期随机对照研究(NCT03794349),评估达妥昔单抗、伊立替康和替莫唑胺联合或不联合DFMO治疗复发难治性NB的疗效。从作用机制来看,这一联合策略从三个维度来实现杀伤肿瘤:化疗药物直接阻止肿瘤细胞分裂;免疫治疗则动员人体的免疫反应攻击肿瘤细胞;而DFMO实则是一种靶向药物,通过靶向ODC抑制肿瘤活性。该项研究目前处于活跃,但不再招聘阶段,clinical trial官网上预计研究完成的时间点为2025年。

图8.NCT03794349研究的关键信息
总结












