本期神母治疗新进展“1月报”为大家精选了四篇临床前研究,包括靶向ALK的CAR-T疗法、端粒延长替代通路阳性神经母细胞瘤的新治疗靶点、芹菜素的抗癌潜力以及[177Lu]Lu-DOTATATE放射性核素治疗的强化策略。期望这些前沿信息能促进学术交流,为神经母细胞瘤患者带来更多的希望与机会。1. ALK抑制剂增加ALK的表达并使神经母细胞瘤对靶向ALK的CAR-T疗法更加敏感

影响因子:9.0
研究阶段:小鼠模型
摘要:
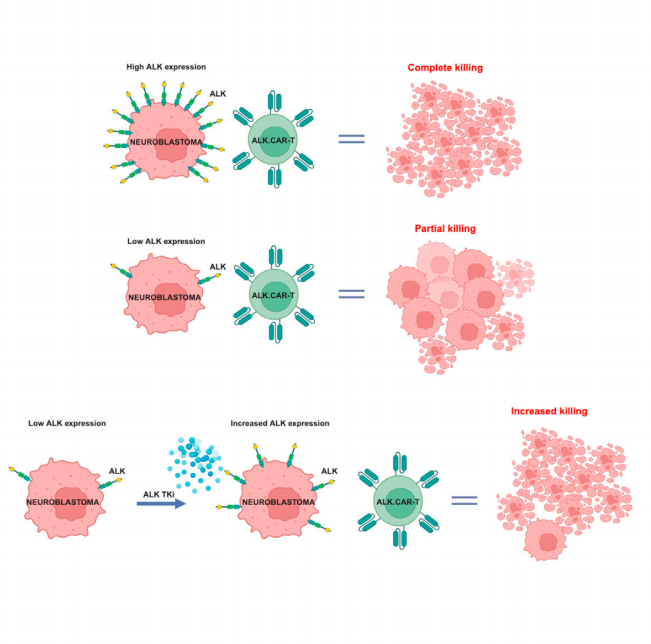
大多数神经母细胞瘤表达间变性淋巴瘤激酶(ALK),而ALK在正常组织中几乎不存在,ALK抑制剂显示出有希望的临床活性。本研究证实靶向ALK的CAR-T细胞疗法对高ALK表达的神经母细胞瘤显示出强大的抗肿瘤活性。而对于低ALK表达的神经母细胞瘤,与ALK抑制剂联合使用可特异性增强CAR-T细胞的作用。从机制上来看,ALK抑制剂可以抑制肿瘤生长并上调ALK的表达,从而促进CAR-T疗法对神经母细胞瘤的活性。关键内容解读:
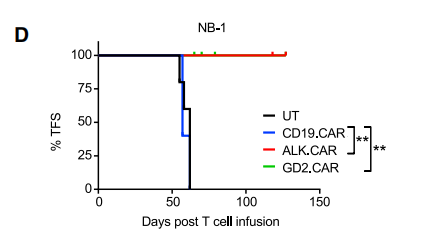
首先,研究证实了在ALK高表达的小鼠模型中,ALK.CAR-T和GD2.CAR-T能有效控制肿瘤生长,小鼠在实验终止前120天保持无肿瘤状态。
图.ALK高表达小鼠接受不同CAR T疗法的生存曲线接着,研究者探索了CAR-T细胞在ALK和GD2低表达的神经母细胞瘤小鼠模型中的活性。ALK.CAR-T单一治疗仅显示出有限的抗肿瘤作用,所有小鼠在注射CAR-T细胞的20天内死亡,而GD2.CAR-T的疗效更差,所有小鼠在注射CAR-T细胞的15天内死亡。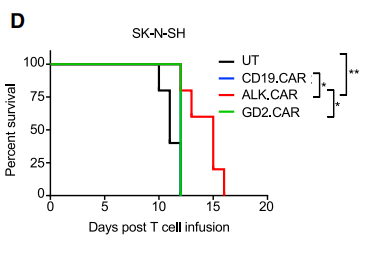
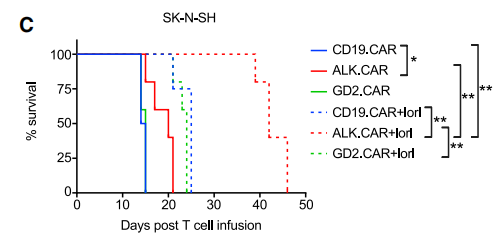
图.ALK低表达小鼠接受不同单一CAR T疗法的生存曲线研究进一步证实,在神经母细胞瘤细胞系以及小鼠模型中,ALK抑制剂劳拉替尼可增加ALK表达水平。于是,研究者设计让小鼠接受4天的劳拉替尼,然后接受CAR-T细胞输注,随后再次接受2个周期的劳拉替尼,每个周期为期5天。结果显示,在ALK低表达的小鼠模型中,相较于单药,GD2.CAR-T和ALK.CAR-T联合劳拉替尼显著减缓肿瘤生长速度并延长小鼠生存期,其中ALK.CAR-T联合治疗的疗效最优。图.ALK低表达小鼠接受单一CAR T疗法和ALK抑制剂联合疗法的生存曲线差异
2. METTL3可能是端粒延长替代通路(ALT)阳性神经母细胞瘤的治疗靶点一部分侵袭性神经母细胞瘤(NB),特别是复发性肿瘤的ALT呈阳性(ALT+)。TERRA是一种来自端粒末端的lncRNA,以R环依赖的方式定位到端粒上,在端粒维持中起关键作用。本研究证实了TERRA中内部腺苷(m6A)的RNA修饰由甲基转移酶METTL3进行,对于ALT+细胞中的端粒维持是必不可少的。因此,对ALT+ NB细胞使用METTL3抑制剂进行治疗会导致TERRA的端粒定位受损以及端粒上的DNA损伤累积,这表明对抑制METTL可能是一种治ALT+NB患者的有效方法。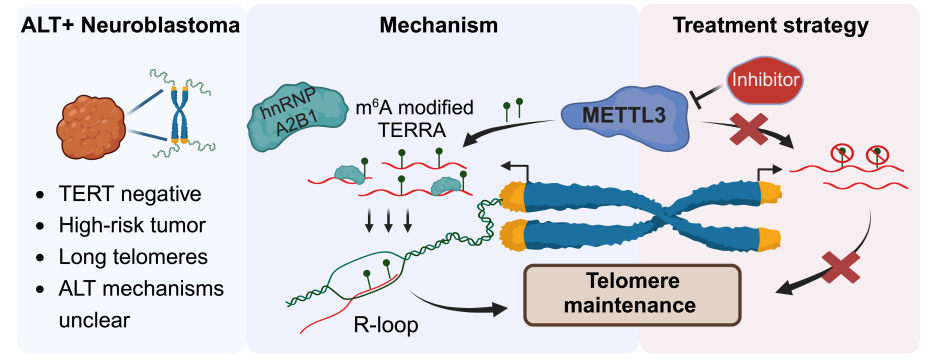
在纳入498份NB细胞的样本组中, METTL3的高表达与较差的无事件生存期(EFS)显著相关。而在ALT+的细胞组中显示出同样的生存差异趋势。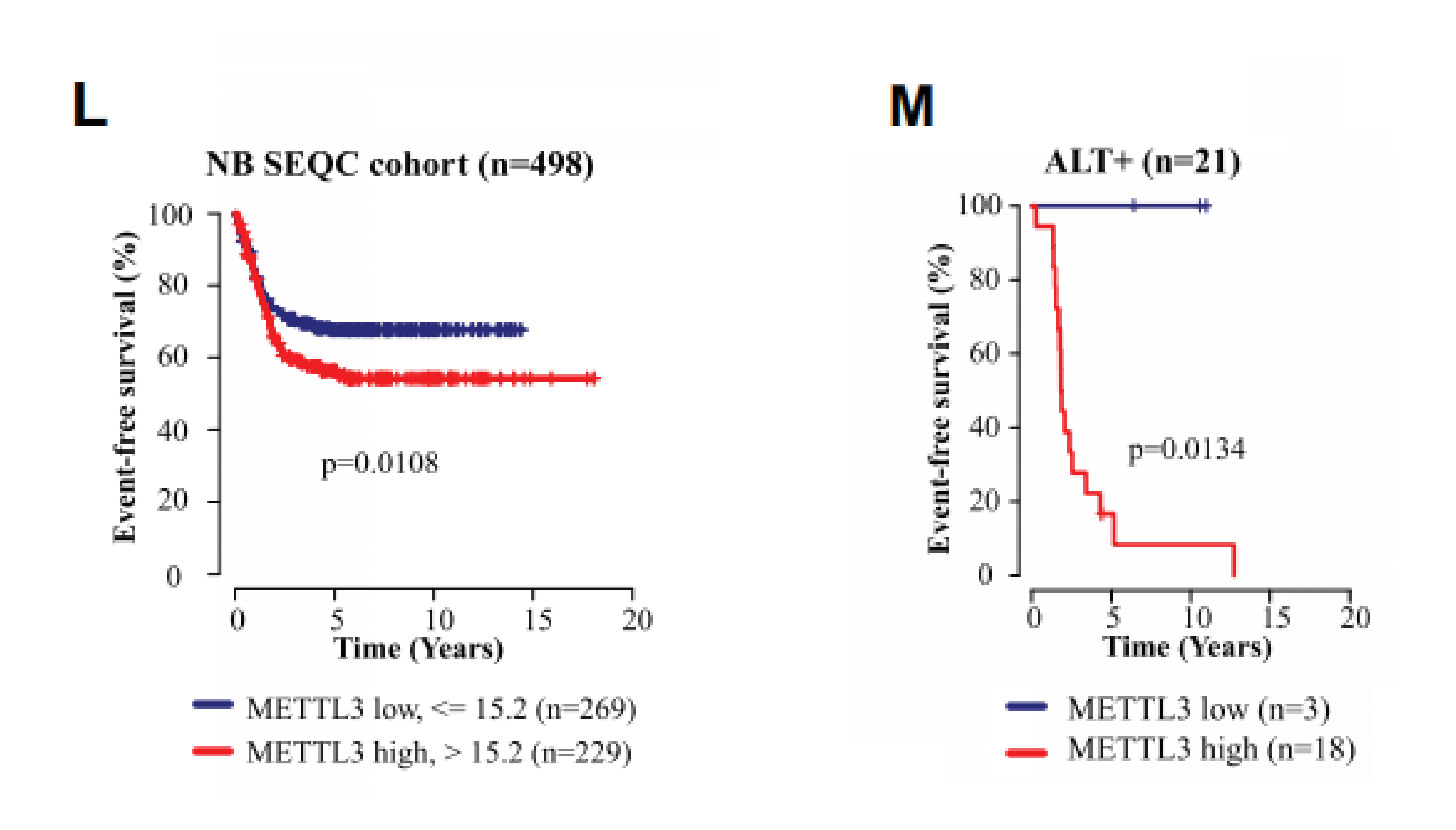
研究使用METTL3抑制剂STM2457处理一组NB细胞系(ALT+、ALT-[MYCN扩增和MYCN未扩增])和正常成纤维细胞72小时。结果显示,与ALT- NB细胞系相比,ALT+ NB细胞系对METTL3抑制更敏感,而成纤维细胞则不受影响。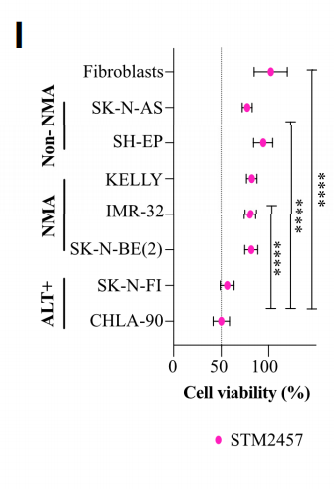
图.使用METTLE3抑制剂处理不同细胞系的细胞活力结果3. 天然类黄酮类化合物——芹菜素,在神经母细胞瘤中的抗癌作用
影响因子:5.1
摘要:
芹菜素已被报道多种药物活性,包括抗炎症、抗氧化、抗菌和抗癌作用。本文综述了芹菜素和其结构相似的化合物对胶质母细胞瘤和神经母细胞瘤的治疗效果的见解。芹菜素对正常神经元细胞的毒性较低,而通过触发多种信号通路和分子靶点对神经系统肿瘤细胞的诱导细胞毒性。
芹菜素的具有多种抗癌机制,如诱导细胞周期阻滞和凋亡,以及抑制迁移、侵袭和血管生成。虽然芹菜素是一种很有前途的药物,但其低生物利用度是在引入临床前必须解决的一个重要问题。近年来,通过脂质体和纳米颗粒递送芹菜素极大地提高了该药物的利用度。
关键内容解读:
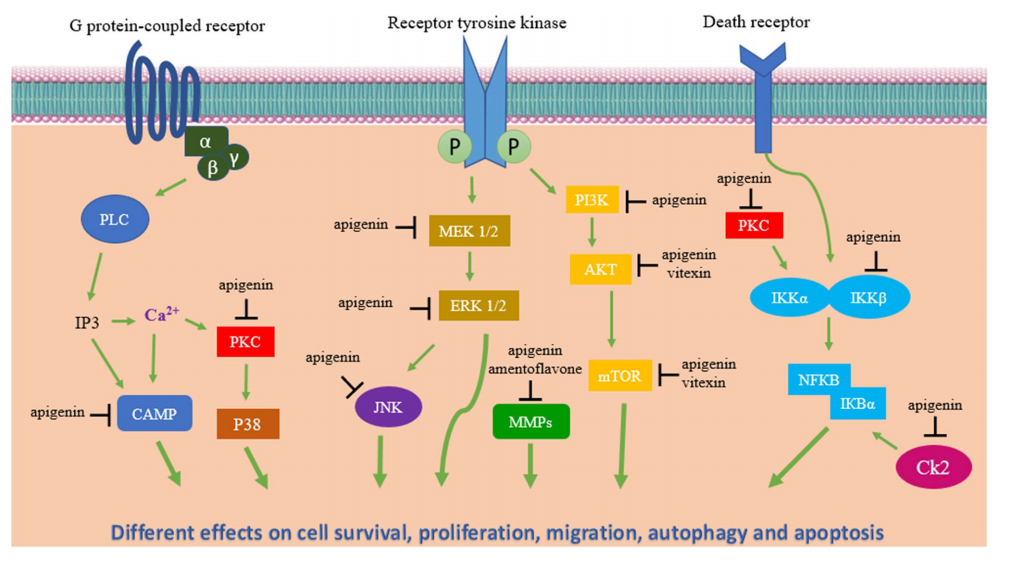
芹菜素又称芹黄素,化学名为4,5,7-三羟基黄酮,是一种天然存在、广泛分布于多种水果、蔬菜、豆类、茶叶和多种中草药中的黄酮类化合物,有“植物雌激素”之称。目前多项临床前研究已经证实了芹菜素对神经母细胞瘤的多种抗癌机制,包括:

表.芹菜素在神经母细胞瘤中的体内研究结果汇总
1)芹菜素可能通过阻断c-MET的磷酸化及其下游效应分子的活性,抑制神经母细胞瘤细胞的自我更新能力和克隆形成能力2)芹菜素通过抑制NF-κB、降解PARP、下调BCL-2、诱导BAX和激活半胱天冬蛋白酶-3,协同促进神经母细胞瘤细胞的凋亡
3)芹菜素在诱导神经母细胞瘤细胞凋亡的同时,会导致线粒体和粗面内质网的损伤,增加细胞内游离Ca2+的水平以及细胞色素c的释放
4)芹菜素和KLF4的异位表达通过损害MMP-2和MMP-9的转录和翻译来阻止神经母细胞瘤细胞的迁移
5)芹菜素和HA14-1(一种小分子Bcl-2抑制剂)联合治疗神经母细胞瘤细胞可协同抑制血管生成因子的表达图.芹菜素及其糖基化衍生物的信号通路和分子靶点
4. p53蛋白的稳定能强化[177Lu] Lu-DOTATATE在神经母细胞瘤异种移植模型中的治疗效果
影响因子:9.1
研究阶段:小鼠试验
研究背景:
基于临床试验结果,美国食品与药品监督管理局和欧洲药品管理局陆续批准177Lu-DOTATATE用于治疗生长抑素受体(somatostatin receptor,SSTR)阳性的胃肠胰神经内分泌肿瘤。75%~90%的神经母细胞瘤临床样本被证实SSTR2阳性,目前已报告了若干项早期临床试验证实了[177Lu] Lu-DOTATATE治疗神经母细胞瘤具有客观缓解率和良好安全性。
p53信号通路在放射诱导的DNA损伤反应中起着至关重要的作用,所以它成为了增强靶向放射性核素治疗敏感性的理想靶标。而装订肽VIP116通过抑制MDM2和MDM4这两种p53的负调节器,抑制野生型p53的消耗。
关键内容解读:
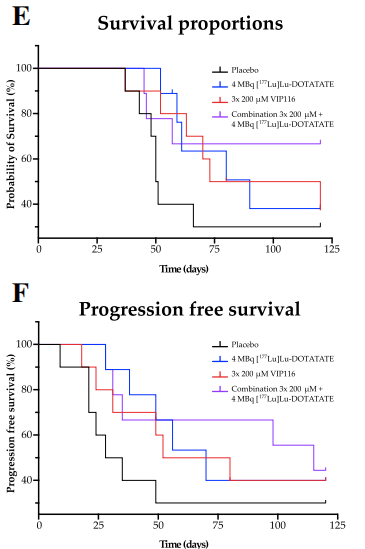
安慰剂组的中位生存期最短(50.5天),而VIP116和[177Lu]Lu-DOTATATE单独治疗的中位生存期较为接近,分别为90天和96.5天。在研究终点时,VIP116和[177Lu]Lu-DOTATATE联合治疗组尚未达到中位生存期,说明大多数小鼠仍然存活。
联合治疗组在无进展生存期(PFS)方面同样具有明显优势。安慰剂组的中位PFS为31.5天,而[177Lu]Lu-DOTATATE和VIP116单药治疗组的PFS同样较为接近,分别为66天和70天。而联合治疗组的中位PFS为115天。图.不同治疗组的生存结果差异(E.总生存;F:无进展生存)
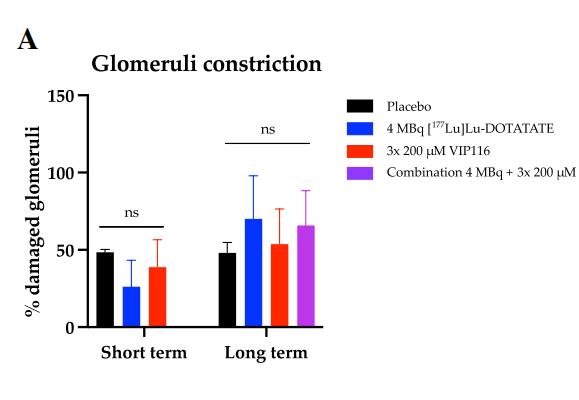
此外,与安慰剂和单药治疗组相比,[177Lu]Lu-DOTATATE和VIP116的联合治疗组未增加小鼠的肾小球损伤百分比,说明联合治疗未引发明显肾毒性。图.不同治疗组肾小球受损比例
参考文献
Bergaggio E, et al. Cancer Cell. 2023 Dec 11;41(12):2100-2116.e10.
Berglund H, et al. Eur J Nucl Med Mol Imaging. 2024 Feb;51(3):768-778.
Lotfi MS, et al. Mol Neurobiol. 2024 Jan 11.
Vaid R, et al. Nucleic Acids Res. 2024 Jan 5:gkad1242.