第 六届东方儿科大会于2023年12月7-9日在上海圆满召开,大会邀请了国内外儿科专家分享领域诊疗现状和前沿进展,旨在促进学术交流,推动中国儿科医学的持续发展。
高危神经母细胞瘤(NB)是儿科诊疗的难点,疾病异质性强、恶性程度高,往往预后不良。近年来,靶向GD2免疫疗法已成为高危和复发难治性NB治疗研究的热点,并在临床应用实践中得到认可。在此次大会上,山东省肿瘤医院儿童肿瘤科主任王景福教授做了主题为“GD2免疫治疗方案的探索与实践”的演讲。本文整理演讲精要内容如下,与大家共享专家真知灼见。
治疗
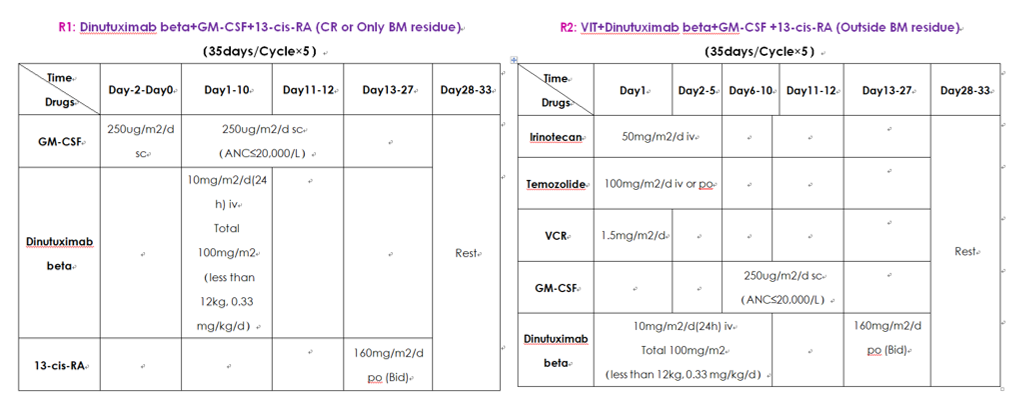
(一)达妥昔单抗β免疫治疗分层策略与启动时机选择
在演讲的第一部分,王景福教授首先结合近年来的临床经验,向我们详细阐明了达妥昔单抗β的应用策略。达妥昔单抗β的用药方案分2层:对于疾病达完全缓解(CR)或仅伴有骨髓转移的患者采用单纯免疫治疗;而对于伴有非骨髓转移的患者,包括骨转移的患者采用化疗联合免疫疗法。具体用药方案如图1所示。
图1.达妥昔单抗β用药分层方案
王景福教授指出,在临床特定的情况下,达妥昔单抗β的用药方案会有所修订 。比如,虽然大部分患者选择VIT(伊立替康+替莫唑胺+长春新碱)方案联合免疫治疗,但是对于个别对VIT方案反应不佳的复发难治患者会改用OPEC(长春新碱+顺铂+依托泊苷+环磷酰胺)或OPET(长春新碱+顺铂+依托泊苷+替莫唑胺)方案。如果患者对劳拉替尼治疗敏感,且未出现耐药情况,则应考虑在免疫治疗时联合给予劳拉替尼。 另外,在标准的5轮免疫治疗后,未达到CR的患儿,若疾病处于稳定或部分缓解(PR)状态,可以选择性继续增加免疫治疗周期数 。 就达妥昔单抗β的启动时机 而言,王景福教授认为经过前期诱导和巩固治疗,包括手术、放化疗、移植治疗后,疾病达到CR是理想状态,而对于无法实现CR的患者,可通过综合手段将肿瘤负荷降到最低方可启动达妥昔单抗β免疫治疗 。① 对于存在骨皮质或突破骨膜形成软组织病变的患者,可行局部放疗(300cGY x 12),再启动达妥昔单抗β免疫治疗;② 对于移植后骨髓恢复功能慢,原发间室(-),骨活性残留的患者,可推迟原发间室预防放疗,先启动达妥昔单抗β免疫治疗,5轮后补充放疗;③ 对于颅脑多发转移,少量骨活性残留,ALK突变的患者,行多疗程化疗+洛拉替尼(lorlatinib)治疗。采集干细胞,行全中枢放疗,局部增量(推荐质子,如果是光子,全中枢180cGY x 12),行ITCBP移植,颅内稳定2-3个月后,启动达妥昔单抗β免疫治疗。
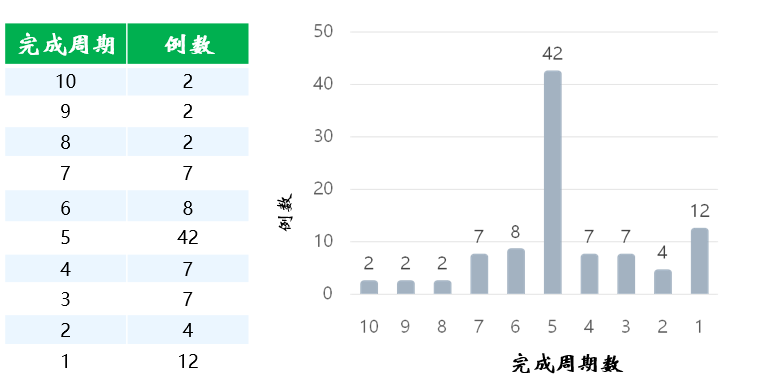
王景福教授还就疾病状态评估时间节点和方法展开了讨论。基于中枢神经系统转移进展较快的情况,他建议最好在免疫治疗前2周进行评估,其余的评估时间节点包括3轮免疫治疗后和5轮免疫治疗结束后的1个月。对于骨髓病灶,王景福教授采用基于GD2抗原的免疫细胞学检测。考虑到病灶活性已经大幅下降,王景福教授不再推荐在这一时期选择FDG PET-CT,推荐采用123I-MIBG SPECT/CT,68Ga-DOTA-PET-CT或18F-NOTA-PET-CT作为骨和软组织病灶的影像学检测。他指出,68Ga-DOTA-PET-CT或18F-NOTA-PET-CT与123I-MIBG的评估结果往往并不重叠,也就是说前者结果阴性的患者可能后者阳性,反之亦然,故在有条件的情况下建议两者都做。而中枢神经系统的病灶必须通过增强核磁共振成像才能实现精准评估。 (二)山东省肿瘤医院达妥昔单抗β免疫治疗单中心临床实践分享 在演讲的第二部分,王景福教授分享了在他们中心应用达妥昔单抗β免疫治疗的临床实践数据。从达妥昔单抗β上市至今,山东省肿瘤医院已经入组了93例接受免疫治疗的神经母细胞瘤患者 。 图2. 山东省肿瘤医院93例神经母细胞瘤患者完成达妥昔单抗β治疗的周期数情况 纳入的初治高危患者共78例,基线特征如图3所示,免疫治疗前30例(39%)患者实现CR,48例(61%)实现非常好的部分缓解(VGPR)和PR。实现VGPR和PR患者的残存病灶主要分布在骨和骨髓。
图3.初治高危患者的基线特征和免疫治疗前残存病灶分布情况 中心入组的15例复发难治患者,在免疫治疗前实现CR的患者比例仅7%,其余患者均有残留病灶。
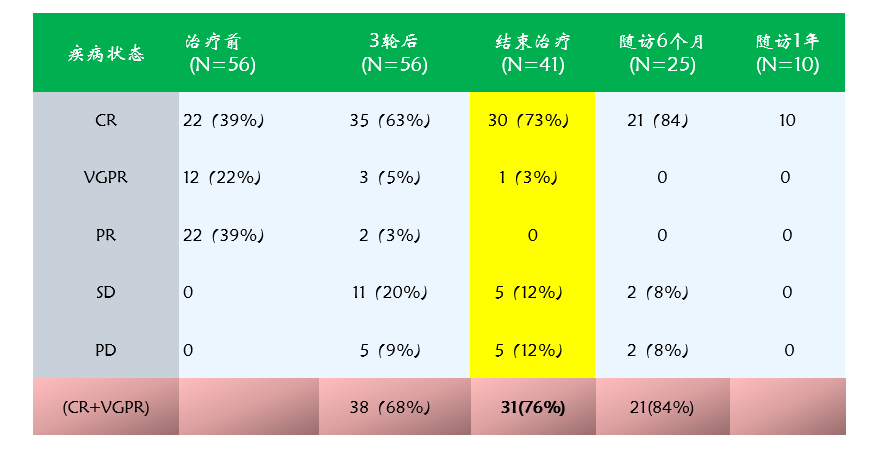
在完成中期和终期评估的56例高危患者中,结束5个周期达妥昔单抗β免疫治疗后实现CR和VGPR的患者比例达到76%。在完成随访6个月的患者中,CR率达到84%,在完成随访1年的患者中CR率为100% 。
图4. 达妥昔单抗β治疗高危患者的疾病缓解情况
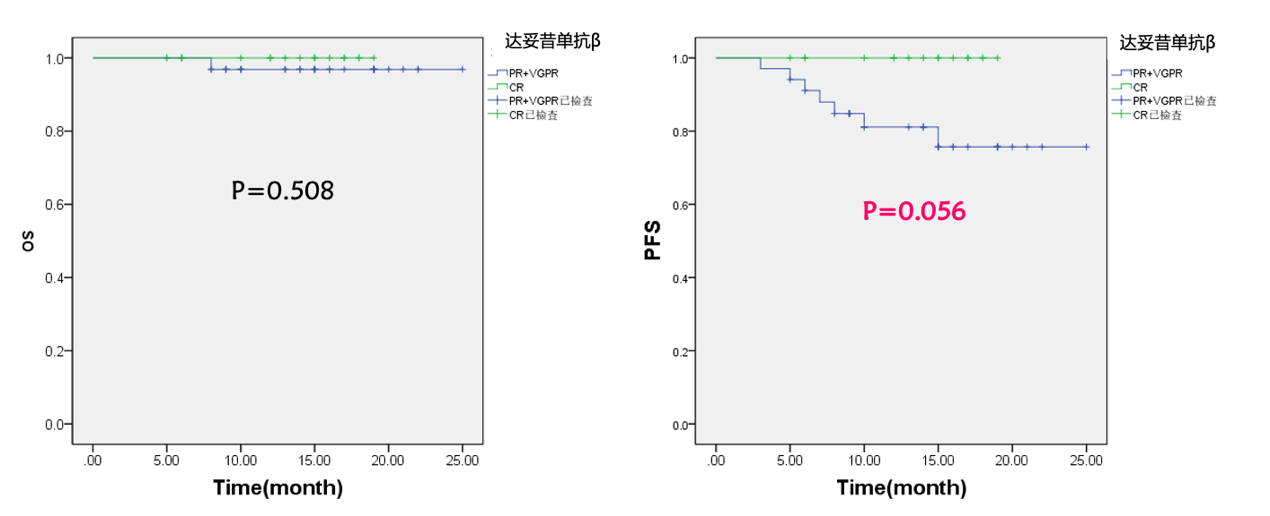
初治高危组的生存分析结果显示,在完成和超过5个达妥昔单抗β治疗周期的51例患者中,6个月的总生存(OS)率达100%,而1年OS达95%;6个月的无进展生存率(PFS)达97%,而1年PFS达82% 。与免疫治疗前实现VGPR和PR的患者相比,实现CR的患者在OS方面无显著性差异,但在PFS上具有更优的趋势 。
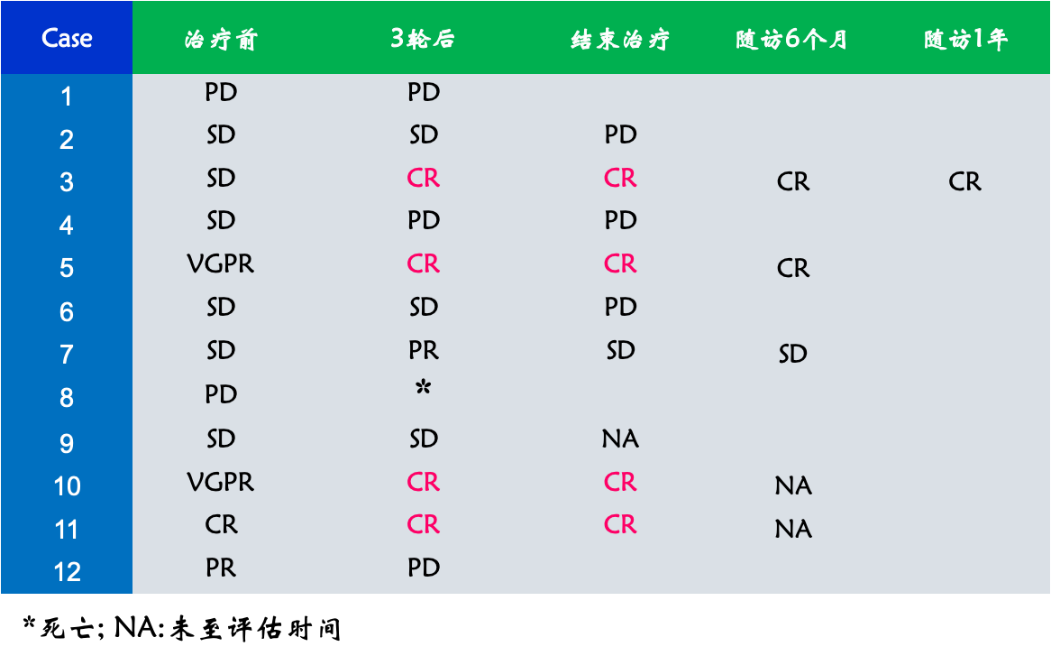
复发难治组完成中期和终期评估的患者有12例, 其中4例在结束5轮治疗后实现CR 。这4例患者中1例在治疗前达到CR, 2例达到VGPR。在3轮后达到CR的患者,在治疗结束后均实现CR,且在随访6个月时仍维持CR,提示治疗早期实现CR是长期疗效的预测因子 ,
图6. 复发难治组(完成中期和终期评估12例)疗效总结
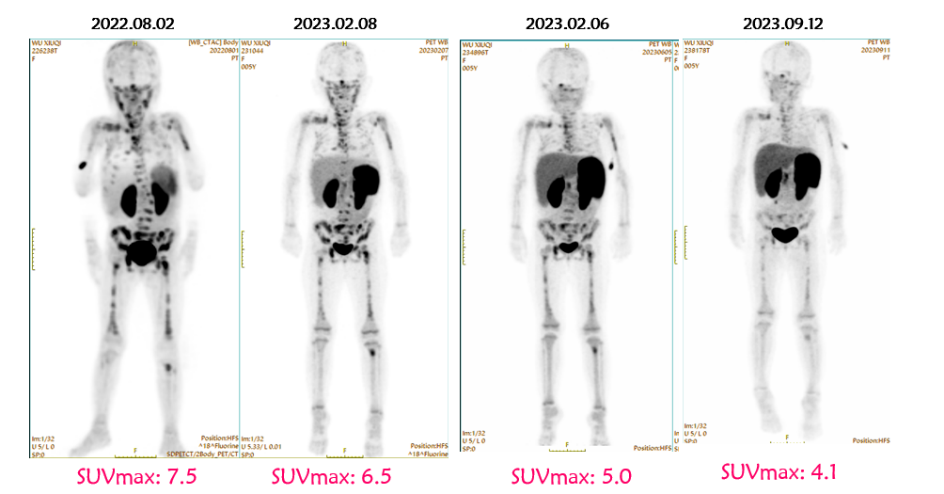
另外,王景福教授也讨论了对增加达妥昔单抗β免疫治疗周期数的探索。中心现有增加免疫周期的患者共计20例,多数患者随着免疫治疗周期的增加,疾病状态得以改善或保持稳定 。NOTA-PET-CT结果显示,随着免疫治疗周期的增加SUVmax值逐渐下降。第8轮免疫治疗后评估SUVmax值为4.1,疾病保持稳定状态,第10轮免疫治疗后的结果还未评估 。 图7. 1例难治性患者完成8轮达妥昔单抗β免疫治疗的评估结果
达妥昔单抗β在安全性方面整体相对可靠。但在治疗过程中出现了4例严重细胞因子释放综合征(CRS),主要症状是大量胸腹水伴有呼吸窘迫。这些病例立即停止了免疫治疗,但在1个月后可以重新启动免疫治疗 。
(三)达妥昔单抗β免疫治疗的实践思考与探索展望
王景福教授在小结与思考部分中,首先肯定了达妥昔单抗β对神经母细胞瘤骨和骨髓病灶具有良好的杀伤作用 。对于免疫治疗期间发生严重CRS的患者,在停用GM-CSF和调整为半速输注方案后,可以重新启动达妥昔单抗β 。部分患者可以通过增加达妥昔单抗β治疗周期数获益 。