导 语
神经母细胞瘤治疗方案的选择是依据危险度分层来制定的,低危神经母细胞瘤仅需要手术切除即可;高危神经母细胞瘤即使通过化疗、手术、放疗等多手段综合治疗,临床治愈率仍然不理想。近年来,随着造血干细胞移植、GD2单抗免疫治疗的广泛应用,高危患者的预后得到了明显改善。
现将1例接受异基因造血干细胞移植和GD2单抗免疫维持治疗的高危神经母细胞瘤患儿病例报告如下。
患者资料
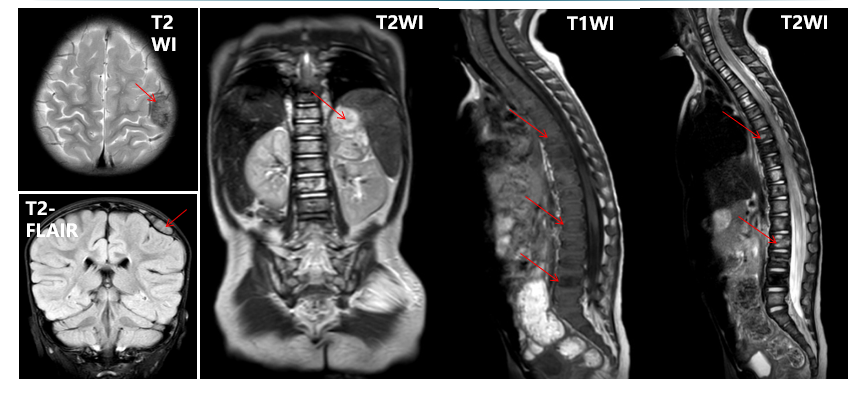
患儿,女,因“发热、左下肢发力、行走不稳”于2020年10月15日至当地医院住院。当地医院的骨髓病理结果提示神经内分泌肿瘤;PET-CT结果提示左侧肾上腺占位,伴腹膜后多个淋巴结转移以及脑膜转移灶,以及多个胸腰椎体成骨性骨质破坏,考虑骨转移,双侧肱骨、双侧股骨髓腔代谢增高,不排除骨髓浸润。综合诊断为肾上腺恶性肿瘤IV期。
该患儿在当地医院接受了1个疗程的伊立替康和环磷酰胺化疗后转诊至我院,入我科后对病情进行了重新评估。骨髓穿刺形态可见15%的神经母细胞瘤细胞,流式免疫分型显示0.73%的CD45-CD56+CD81+GD2+细胞,符合神经母细胞瘤免疫分型。另外,FISH检测提示MYCN基因扩增。病理会诊考虑是分化差型的神经母细胞瘤。进一步检查肿瘤指标显示神经元特异性烯醇化酶(NSE)值明显升高,达41.1ng/ml,而尿香草扁桃酸与肌酐比值(VMA/Cr)正常。最后影像学检查提示左肾上腺肿块,伴左顶骨、脑膜、多个胸腰椎体、双侧肱骨、双侧股骨髓腔及腹膜后淋巴结转移。
最终该患儿诊断为肾上腺神经母细胞瘤(4期,高危,MYCN基因扩增阳性),伴骨、骨髓、脑膜、腹膜后淋巴结转移。
患儿于2020年11月开始三氧化二砷联合CT(环磷酰胺、拓扑替康)方案、CAV(环磷酰胺、阿霉素、长春新碱)方案化疗,4个疗程后的疗效评估为部分缓解(PR)。随后,该患儿于2021年3月进行了左肾上腺区肿物切除术,术后继续接受3个疗程的三氧化二砷联合CVP方案(顺铂、依托泊苷、环磷酰胺)和CAV方案化疗。完成7个周期的诱导化疗后,病灶评估结果为PR。2021年7月,患儿进行了瘤床、淋巴引流区和全中枢放疗。
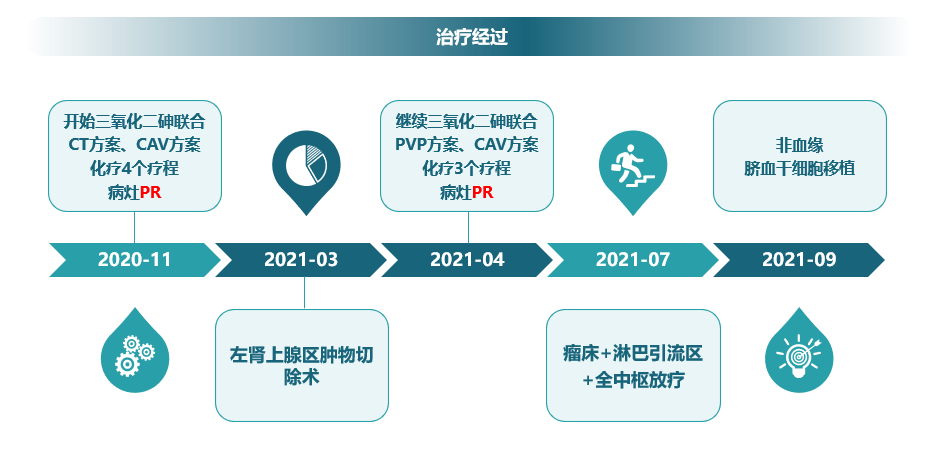
2021年9月,患儿进行了10/10HLA全相合的非血缘脐血干细胞移植。移植前再次进行了检查评估,结果显示:NSE和尿VMA/Cr值均上升;骨髓的形态学、流式细胞术测定的微小残留病灶(MRD)及MYCN扩增均转阴;但影像学检查仍提示全脊柱、骨盆多发骨转移灶。综合来看,患儿在移植前实现了PR。移植前我们对骨残留病灶进行了放疗处理。其他移植相关指标检查的结果显示,患儿无活动性感染且脏器功能大致正常。
异基因移植的预处理方案采用氟达拉滨、白舒非、环磷酰胺联合拓扑替康,同时给予环孢素A和吗替麦考酚酯作为移植物抗宿主病(GVHD)预防方案。患儿发生的主要移植并发症包括感染、急性GVHD、口腔粘膜炎和肝功能及心肌损害,经治疗均得到控制。

图3.异基因造血干细胞移植的用药方案和相关并发症
维持治疗过程
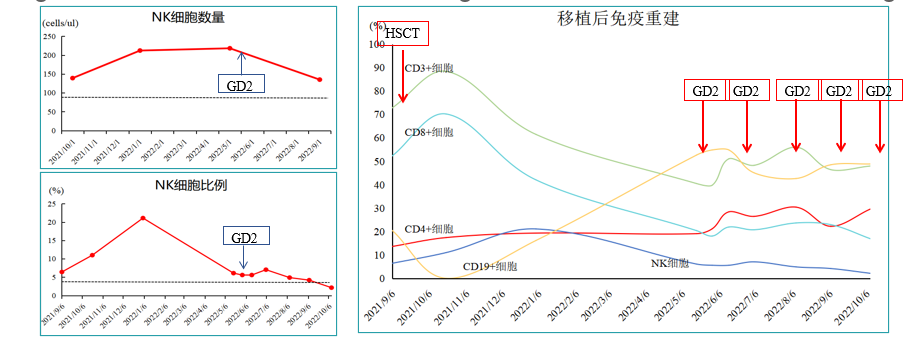
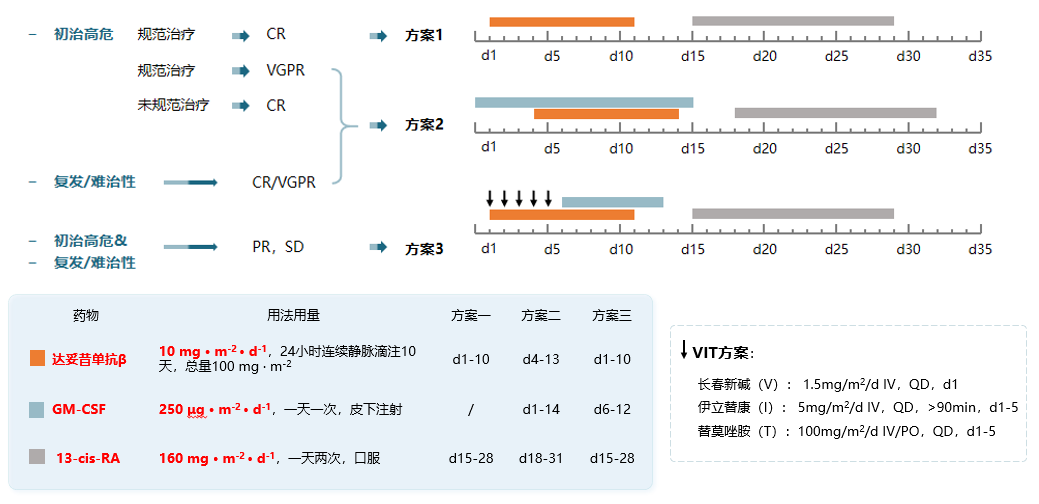
第1疗程的第1~6天,达妥昔单抗β给药剂量为5mg/m2/d,第7~8天给药剂量调整为7.5mg/m2/d,到第9~10天,再次将给药剂量上调至10mg/m2/d。患儿在第1天输注约4小时后出现腰痛、皮疹、心率增快症状,治疗期间有发热、腹泻及皮疹,考虑药物反应,同时不排除合并感染,故予舒普深抗感染。第10天输注时,患儿出现一过性双眼视物模糊,眼科检查显示双侧瞳孔不等大,对光反射迟钝,考虑可能是达妥昔单抗β与视神经细胞结合引起的视神经损害。经治疗后,患儿的视神经问题得以恢复。
第5疗程继续连用14天的7.5mg/m2/d达妥昔单抗β,同时联合GM-CSF的方案。最后1个疗程患者耐受性良好,仅出现对光反射迟钝症状,无视力下降,同时也未出现严重感染。
总体来看,达妥昔单抗β治疗期间的不良反应符合预期范围,且对症治疗后均可控制。
治疗结果
病例总结
本病例为伴有多发骨、骨髓、中枢等全身远处转移的MYCN基因扩增的高危NB,经三氧化二砷联合诱导化疗、手术、放疗、异基因造血干细胞移植及GD2单抗免疫治疗后获得长期CR。异基因造血干细胞移植后采用爬坡剂量的达妥昔单抗β免疫治疗安全性好,且不影响患者重建正常的免疫功能。


参考文献
1. 孙晓燕,等.中华转移性肿瘤杂志,2021,04(4):247-250.
2. Flaadt T,et al. J Clin Oncol. 2023 Jun 10;41(17):3135-3148.












