神经母细胞瘤(neuroblastoma,NB)是儿童最常见的颅外实体肿瘤,进展迅速,50%以上NB患儿就诊时已存在远处转移1。GD2在NB细胞上100%高表达,为NB免疫治疗的理想靶点2。达妥昔单抗β是我国首个获批用于神经母细胞瘤治疗的靶向免疫治疗药物,达妥昔单抗β治疗中国高危或复发/难治NB患儿的初步临床应用研究显示短期疗效可期,严重不良反应发生率较低。现将1例二次复发后接受化疗联合GD2单抗免疫维持治疗的M期高危神经母细胞瘤病例报告如下。
患儿,男,7岁9个月。首次发病时间为2020年10月,诊断结果为左侧肾上腺混杂型节细胞神经母细胞瘤M期高危,伴多发骨、多发淋巴结转移,11q23缺失,N-myc未扩增。患儿接受了化疗、原发灶手术切除、原发灶瘤床放疗、异维甲酸口服维持的综合性治疗。
2021年10月(停化疗后6个月)患儿出现骨髓转移性复发。予3周期化疗后骨髓转阴。之后再次结疗。
2022年7月(停化疗7个月)复查骨髓穿刺提示再次复发,转我院治疗。入院后进行全面评估,发现患儿还存在多发骨、多发淋巴结(左侧锁骨上、双侧髂血管周围、右侧腰大肌内侧、腹主动脉旁)、胰腺转移性复发。
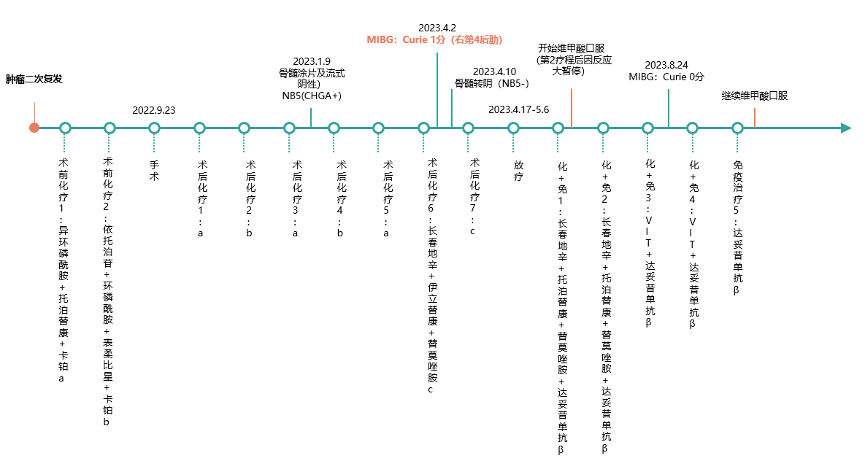
该患儿肿瘤二次复发后,在我院接受了包括化疗、手术、放疗和达妥昔单抗β免疫治疗在内的多模式治疗,整体治疗经过见图1。图1.患儿治疗过程
患儿接受了9周期化疗(具体方案见图1),2疗后接受了根治性手术,5疗后骨髓获得非常好的部分缓解,8疗后骨髓获得完全缓解,MIBG检查报告:Curie 1分(右侧第4后肋有少许活性)。手术及术后病理
患儿于2022年9月23日接受了手术治疗,包括腹膜后肿瘤切除、胰腺体尾部切除、右输尿管松解、腹膜后淋巴结清扫、肠黏连松解、左颈部淋巴结清扫和周围神经松解。
术后病理提示胰腺组织(胰尾、胰尾旁、胰体)、颈部、腹腔淋巴结均见神经母细胞瘤转移。
巩固治疗
2023年4月17日-5月6日行盆腔+左侧锁骨上区+第4后肋放疗。家长拒绝行自体干细胞移植。
维持治疗
根据《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识(2021年版)》推荐,我们采用方案三:达妥昔单抗β+VIT化疗+GM-CSF+异维甲酸。考虑患儿既往化疗胃肠道反应显著,故在前2个疗程予托泊替康替代伊立替康。之后患儿腹泻症状改善,在第3和4疗程时,恢复使用伊立替康。基于患儿骨髓抑制严重,并且MIBG已转阴,在第5个疗程时予纯免方案。
2023年5月19日即免疫治疗开始前2天开始疼痛预处理,方案为口服加巴喷丁,直至免疫治疗结束。2023年5月22日开始化疗,第1-5天在化疗的同时输注达妥昔单抗β,单抗开始前2小时开始吗啡泵注止痛,根据疼痛反应调整剂量,至5月26日减停。开始治疗后的第6-10天采用特尔立和达妥昔单抗β联合方案。2023年6月1日达妥昔单抗β免疫治疗输注完毕,随即口服维甲酸,持续14天(见图3)。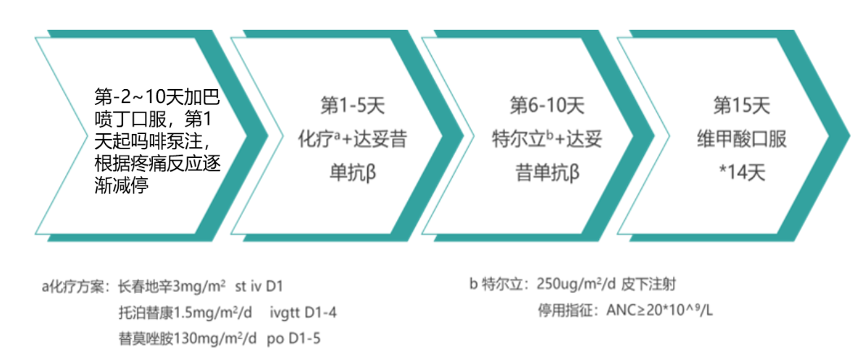
免疫治疗期间不良反应
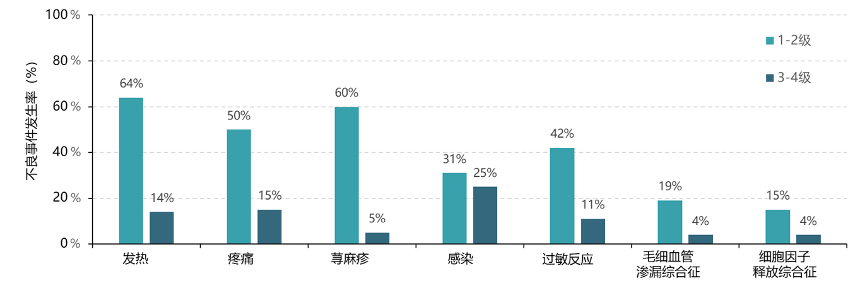
国外临床研究已经证实达妥昔单抗β免疫治疗主要不良事件多为轻中度,严重不良事件发生率低,安全性良好。
图3 达妥昔单抗β治疗NB患儿主要不良事件的发生率
对于达妥昔单抗β免疫治疗期间发生的疼痛,标准的用药方案包括阿片类药物、加巴喷丁和非阿片类镇痛剂(见图4)。该患儿在免疫治疗的第4天时出现一过性腹痛,调整吗啡剂量后明显好转,未再出现。
图4.免疫治疗期间镇痛用药方案
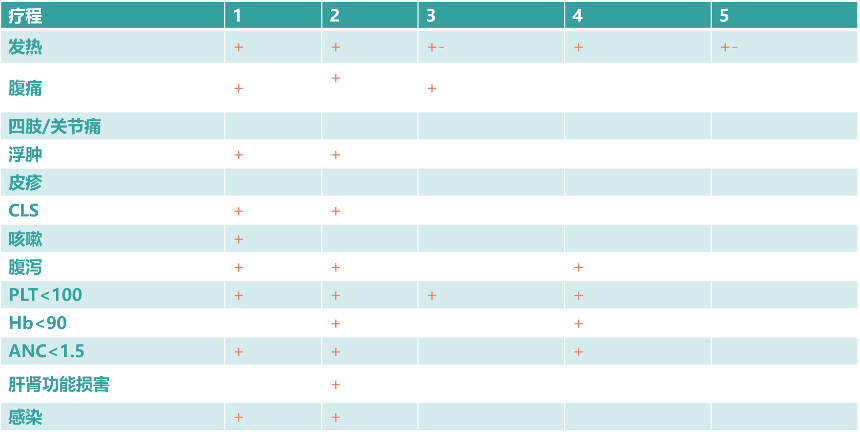
第一疗程中患儿的发热从疗程第1天持续到第10天;第1~4天出现轻微毛细血管渗漏综合征(CLS),主要表现为浮肿和尿少,接受白蛋白、利尿等对症处理后好转;患儿出现骨髓抑制,考虑与化疗有关。值得注意的是,患儿在第一疗程免疫治疗期间未出现四肢痛、关节痛、皮疹和肝肾功能损害不良反应(见图5)。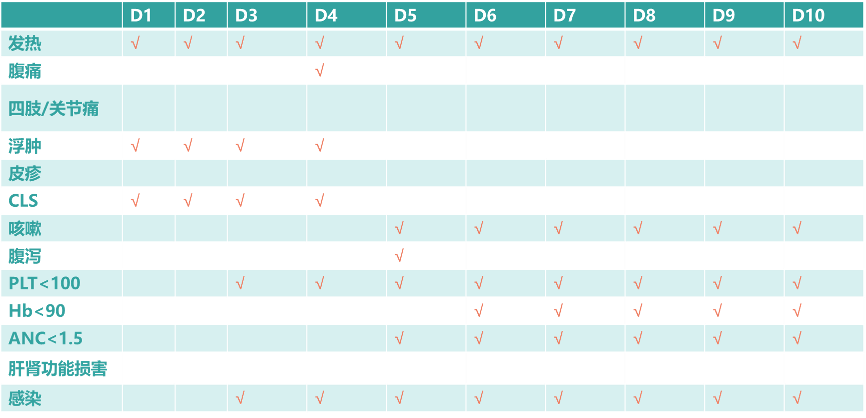
第3天患儿持续高热,降钙素原(PCT)为0.655mg/ml,C-反应蛋白(CRP)为22.26mg/L,较前升高,感染不能排除,加用抗生素。随着免疫疗程的进展,患儿的不良反应逐渐减少(见图6)。
图6.第1-5疗程免疫治疗不良反应
第三疗程免疫治疗结束后对患儿进行了评估,2023年8月24日进行了MIBG的检测,结果Curie评分为0分。 本病例为复发/难治神经母细胞瘤患儿,伴骨、骨髓、胰腺及淋巴结多处转移。患儿二次复发后接受化疗、手术、放疗和达妥昔单抗β方案三治疗,期间耐受性良好,不良反应程度较轻,及时处理干预可逆转,且主要不良事件发生率随疗程推进逐渐降低。在接受了第3个治疗周期的免疫治疗后,MIBG的检测结果显示,患儿的Curie评分从1分降为0分,短期疗效确切。本文由浙江大学医学院附属儿童医院的茅君卿教授担任点评专家,文章以非商业研究及教育为目的,不用作商业用途,欢迎阅读、分享!
1.袁晓军,等. 中华转移性肿瘤杂志, 2022, 05(1) : 14-20.2.Modak S, et al. Cancer Invest. 2007 Feb;25(1):67-77.