导 语
近几年,随着越来越多的抗肿瘤药物获批上市¹,抗肿瘤治疗现状得到明显改善。然而,抗瘤治疗期间容易诱发一系列血液系统相关不良事件,例如骨髓抑制、血小板减少等²。对于血小板减少,临床上的主要治疗措施包括输注血小板和应用血小板生长因子(重组人血小板生成素[rhTPO]、重组人白细胞介素-11[rhIL-11]、血小板生成素受体激动剂[TPO-RA])等³。阿伐曲泊帕属于第二代TPO-RA,相较于其他TPO-RA,其具有安全性、使用便利性等方面的显著优势⁴。基于此,本文将全面解读阿伐曲泊帕在肿瘤治疗相关血小板减少(CTIT)治疗中的独特优势,旨为推动临床合理用药。
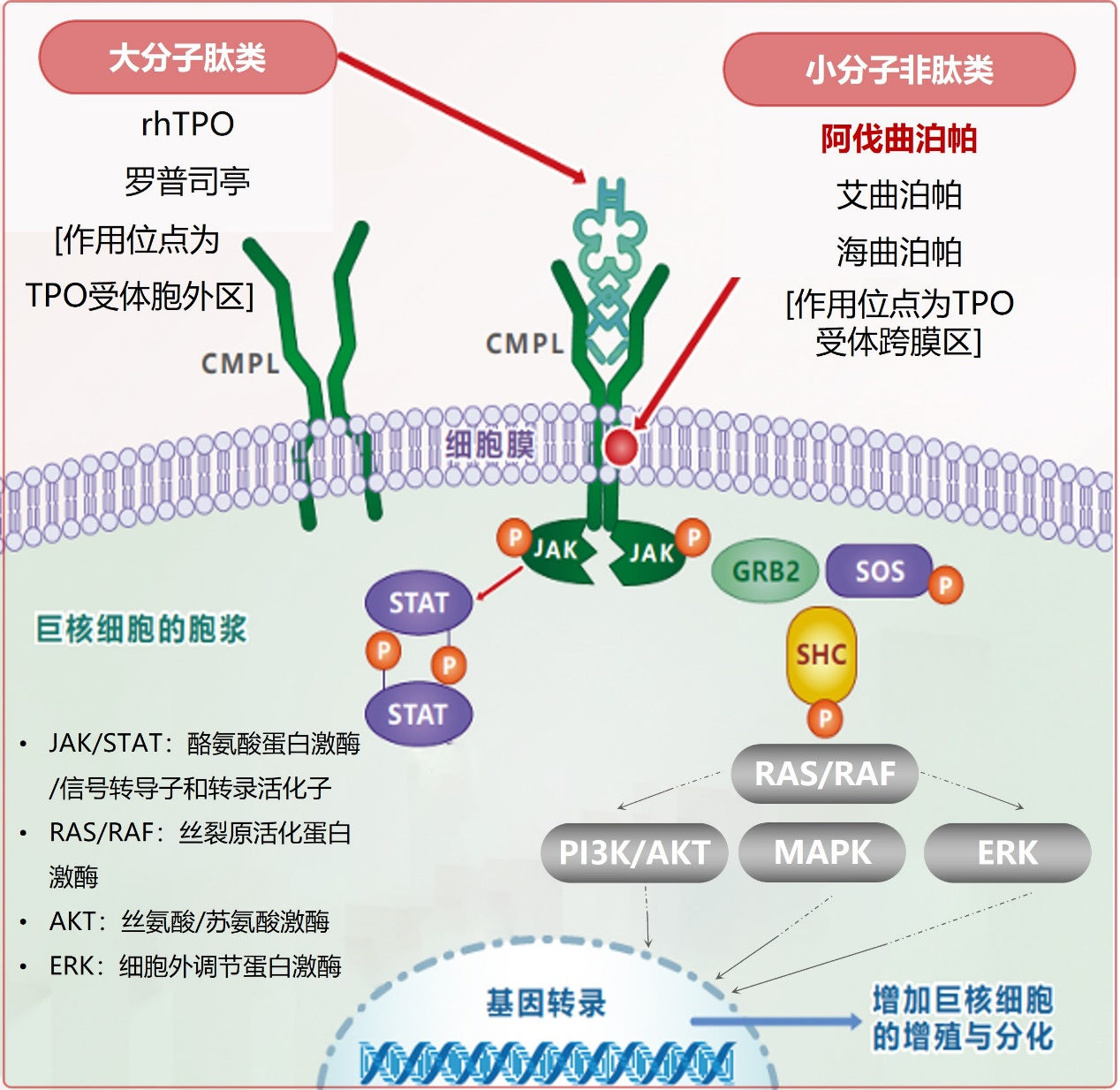
TPO-RA(阿伐曲泊帕、艾曲泊帕、海曲泊帕等)可与人血小板生成素(TPO)受体的跨膜结构域相互作用,启动信号级联反应,刺激骨髓巨核系的增殖和分化,从而促进血小板的生成和释放⁵,⁶,⁷,具体机制见图1⁸:
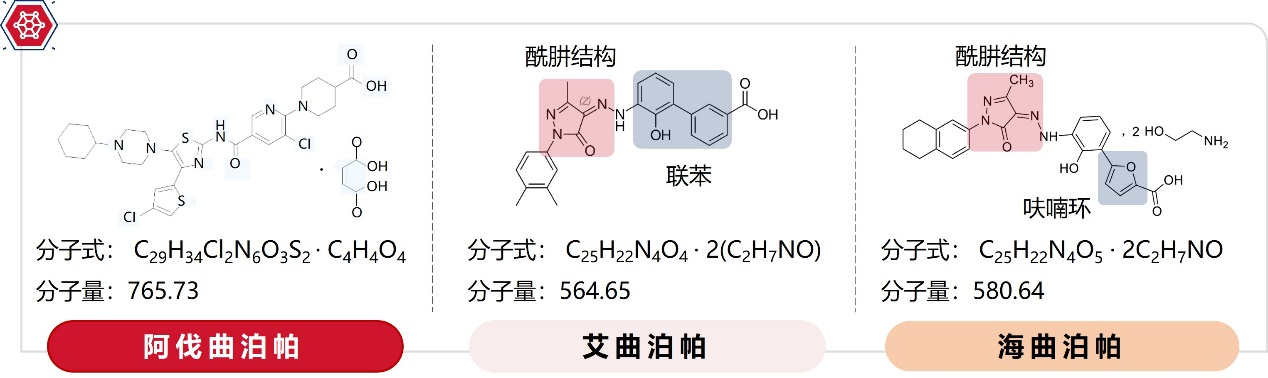
据药代动力学研究显示,进食状态会影响艾曲泊帕的吸收,造成药物暴露量降低。反观阿伐曲泊帕无论是进食或是禁食,不会影响AUC0-inf值,说明阿伐曲泊帕与食物同服不会影响药物暴露,见图3¹²,¹³。
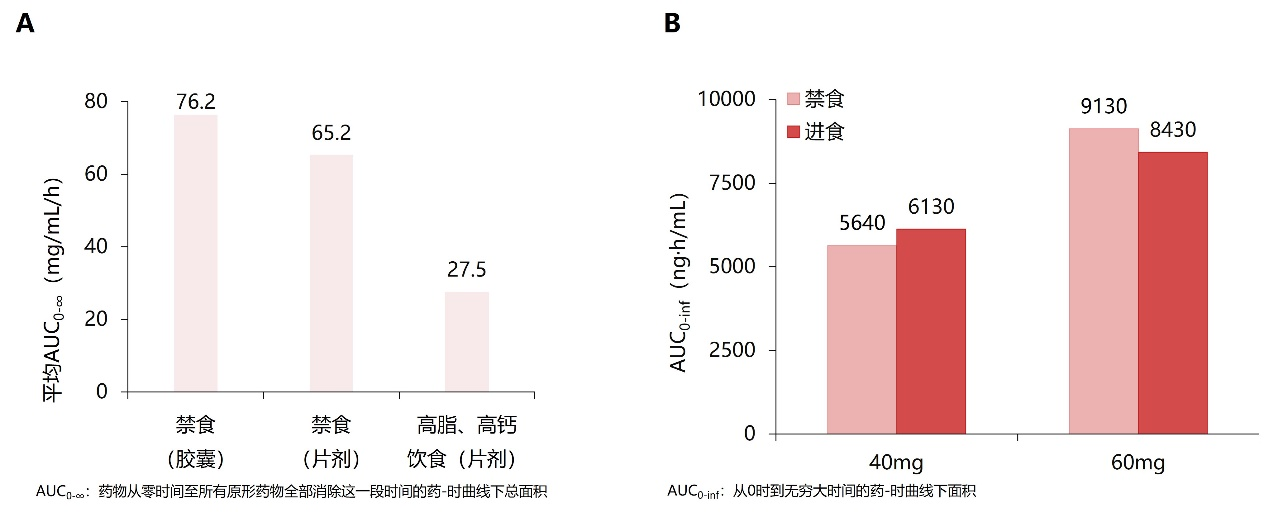
图3. 与食物同服后艾曲泊帕的暴露量受影响(A)、阿伐曲泊帕的暴露量不受影响(B)
MICHELSON等评估了阿伐曲泊帕对血小板功能的影响,研究显示阿伐曲泊帕在提升血小板计数的同时,未降低血小板活化阈值⁹,提示阿伐曲泊帕或许不增加血栓风险。
此外,Abe等进行的一项药效学试验提示,阿伐曲泊帕药理功效可能比艾曲泊帕更强,见图4、5¹⁴。
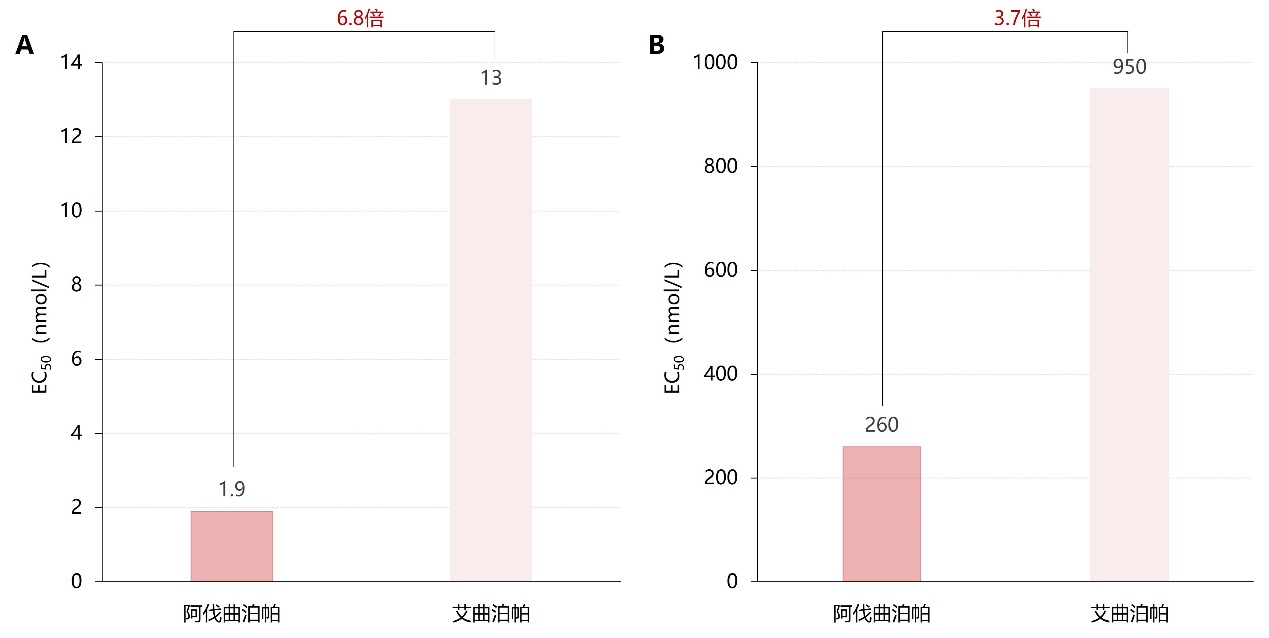
图4. 体外实验中阿伐曲泊帕、艾曲泊帕的EC₅₀对比。(A)Ba/F3细胞(表达人TPO受体)增殖促进;(B)人脐带血CD34⁺巨核细胞集落形成
EC₅₀:半数有效浓度
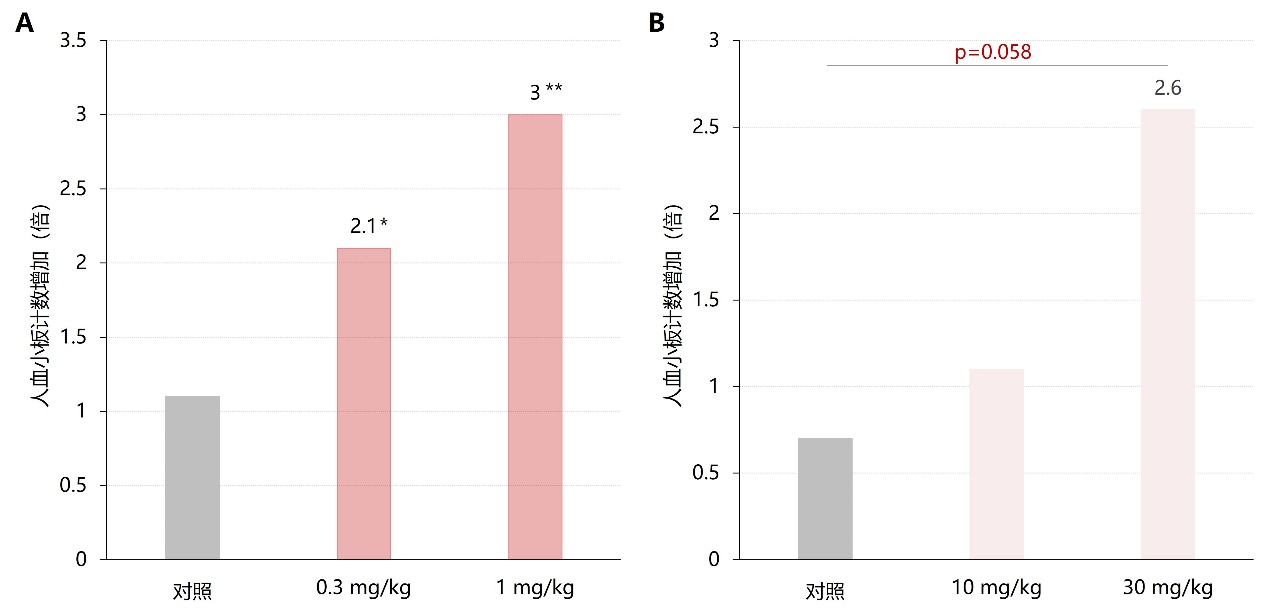
图5. 动物实验中阿伐曲泊帕(A)、艾曲泊帕(B)给药后第14天人血小板计数的增加倍数对比
*:与对照组相比p<0.05;**:与对照组相比p<0.01
化疗致血小板减少(CIT):一项回顾性、多中心、单臂研究纳入101例化疗后发生≥1级血小板减少症的患者,给予其阿伐曲泊帕口服片剂20~60 mg/d(20 mg/片)至少5天或患者达到停药指征(血小板计数≥100×10⁹/L或较基线升高≥50×10⁹/L),记录患者血小板计数的变化。
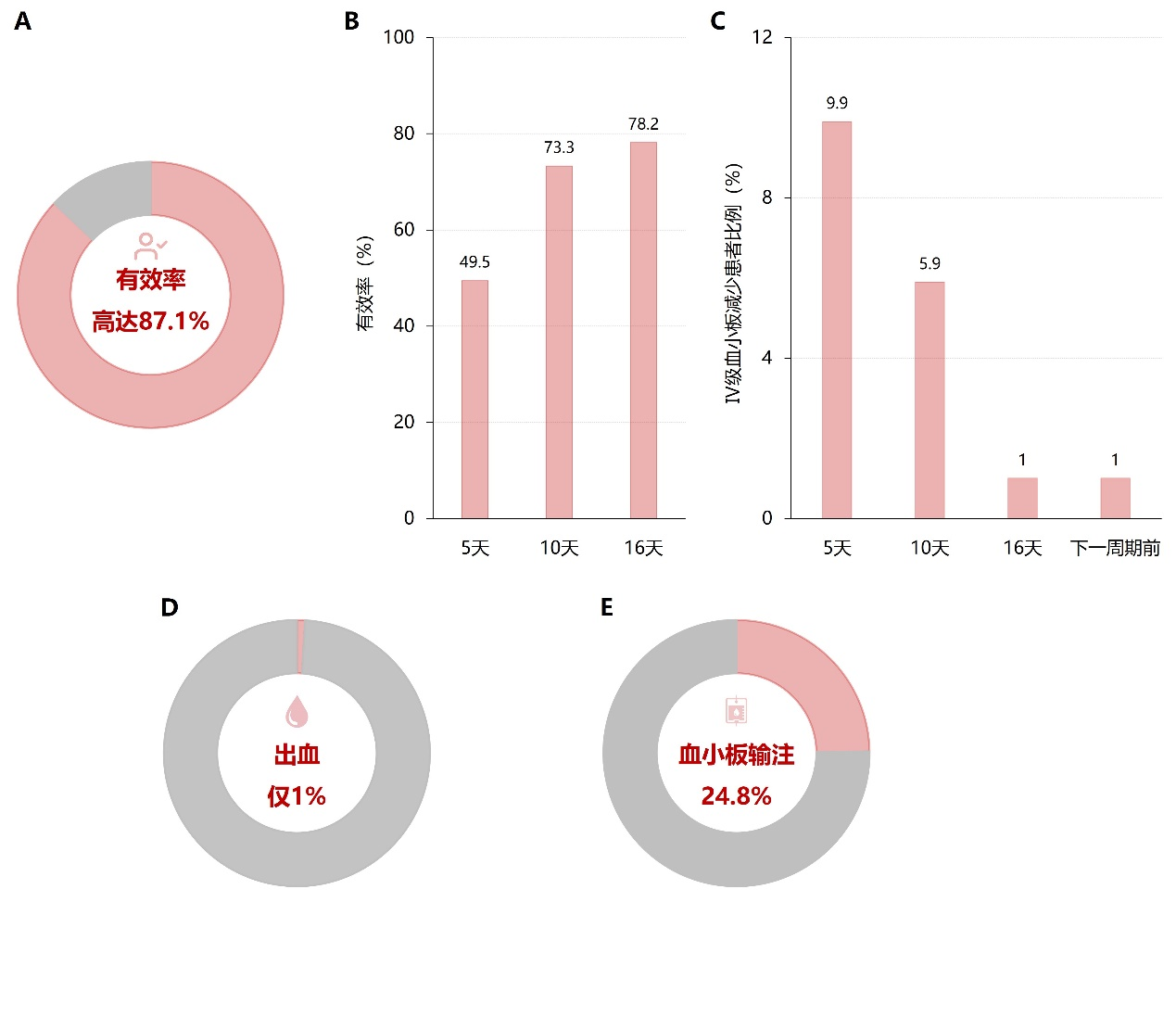
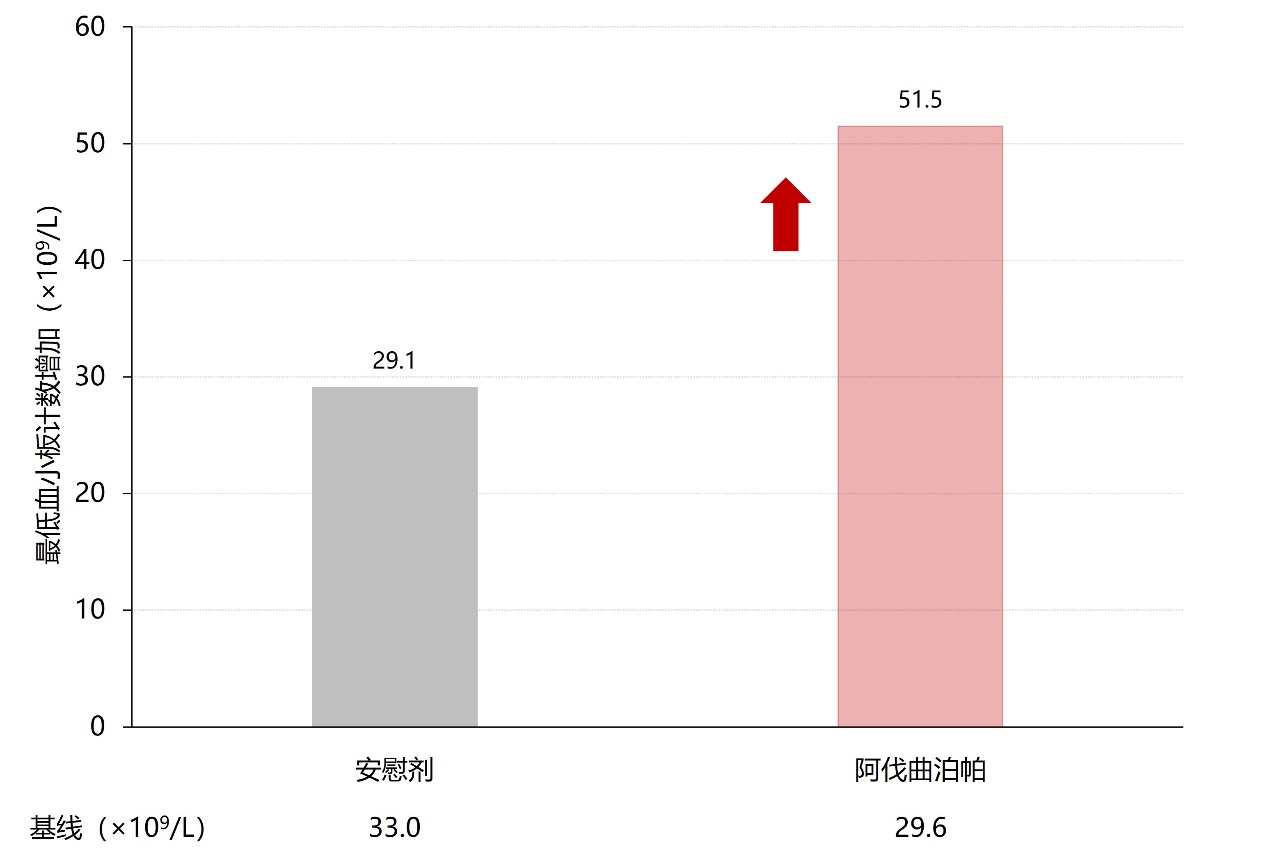
图7. 下一化疗周期内各组的最低血小板计数增加对比
除了在接受化疗的患者中表现不俗以外,阿伐曲泊帕在接受新型治疗(靶向治疗、免疫治疗)的患者中也显示出了亮眼的结果:
靶向治疗致血小板减少:一项病例报告纳入多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂尼拉帕利治疗致血小板减少的2例转移性乳腺癌患者、4例卵巢癌患者,给予其阿伐曲泊帕进行治疗。结果表明,经阿伐曲泊帕治疗后,2例乳腺癌患者均因接受尼拉帕利治疗的剂量增加,实现颅内缓解。其中2例卵巢癌患者因重新开始尼拉帕利治疗,体内标志物CA-125水平降低。另1例卵巢癌患者虽体内CA-125水平保持稳定,然而后续实现完全缓解、无病生存¹⁷。
免疫治疗致血小板减少:一项病例报告纳入2例抗PD1抗体引起的获得性巨核细胞性血小板减少患者(其中1例已进展至再生障碍性贫血,糖皮质激素、环孢素、静脉注射免疫球蛋白、rhTPO、艾曲泊帕治疗均无效或不耐受),患者接受阿伐曲泊帕治疗后血小板计数均恢复正常,无需血小板输注¹⁸。
此外,相较于其他TPO-RAs,阿伐曲泊帕具有安全性优势,例如罗普司亭有产生中和抗体的风险,艾曲泊帕伴随白内障、肝毒性、门静脉血栓等不良事件。罗普司亭及艾曲泊帕均有骨髓纤维化的风险,目前尚无证据表明阿伐曲泊帕治疗与之相关⁴。
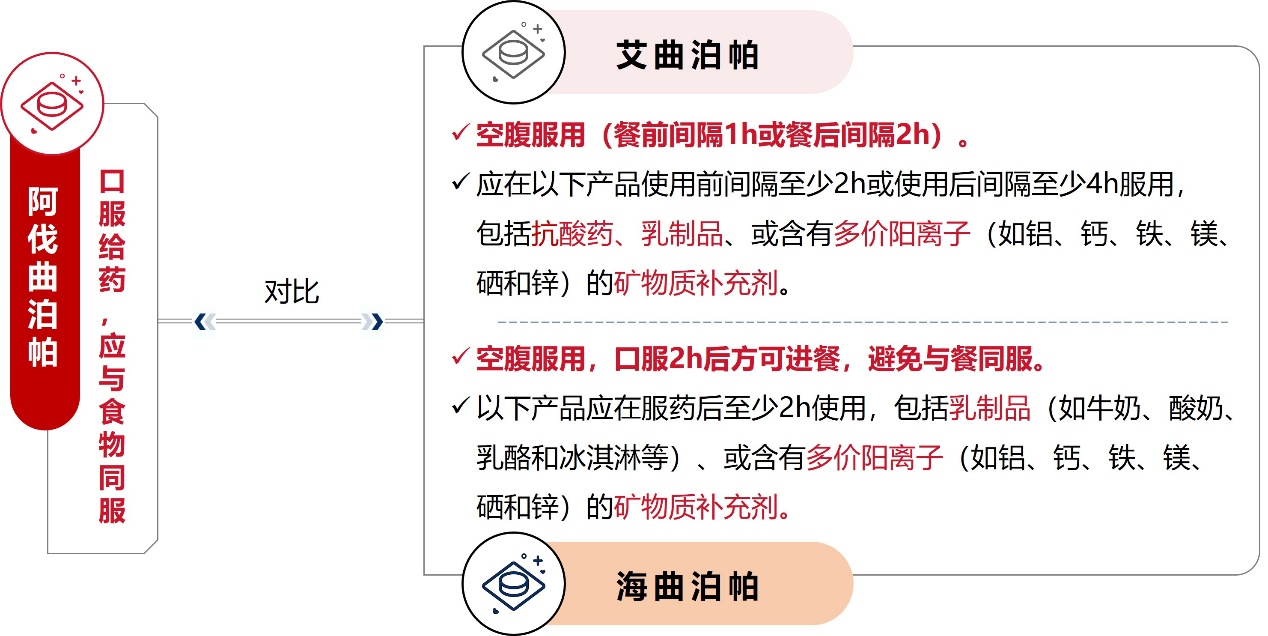
图8. 阿伐曲泊帕、艾曲泊帕、海曲泊帕的使用方法对比
总
结
阿伐曲泊帕是一种新型TPO-RA,其与TPO在促血小板生成方面具有累加效应、较强的药理活性,且在肿瘤相关血小板减少患者的应用中初步显示出了较好的疗效和相较于其他TPO-RA的安全性,且患者使用更加方便。然而目前肿瘤患者相关循证较少、样本量偏小,未来还需开展更多大样本、前瞻性、多中心的随机对照研究,以证实其在肿瘤的支持治疗中能够发挥重要作用,帮助患者提升血小板计数、促使患者更加顺利地接受治疗,改善临床结局。
参考文献:
1.黄可,于飞,张晓薇,等. 抗肿瘤药物研发与市场概览[J]. 世界临床药物,2017,38(7):后插2-后插6.
2.唐丽娜,周晓伟,董乐乐,等. 533例抗肿瘤药物不良反应报告分析[J]. 肿瘤药学,2022,12(5):663-670.
3.中国抗癌协会肿瘤临床化疗专业委员会,中国抗癌协会肿瘤支持治疗专业委员会. 中国肿瘤药物相关血小板减少诊疗专家共识(2023版)[J]. 中华医学杂志,2023,103(33):2579-2590.
4.郝晓静,马梁明. 阿伐曲泊帕的临床应用进展[J]. 实用医学杂志,2023,39(4):519-524.
5.马来酸阿伐曲泊帕片说明书.
6.艾曲泊帕乙醇胺片说明书.
7.海曲泊帕乙醇胺片说明书.
8.Ghanima W, Cooper N, Rodeghiero F, et al. Thrombopoietin receptor agonists: ten years later. Haematologica. 2019 Jun;104(6):1112-1123.
9.陈灿,张其坤,许青. 新型血小板生成素受体激动剂:阿伐曲泊帕[J]. 中国新药与临床杂志,2020,39(11):652-656.
10.Vlachodimitropoulou E, Chen YL, Garbowski M, et al. Eltrombopag: a powerful chelator of cellular or extracellular iron(III) alone or combined with a second chelator. Blood. 2017 Oct 26;130(17):1923-1933.
11.刘海龙,王江,林岱宗,等.先导化合物结构优化策略(二)——结构修饰降低潜在毒性[J].药学学报,2014,49(1):1-15.
12.Williams DD, Peng B, Bailey CK, et al. Effects of food and antacids on the pharmacokinetics of eltrombopag in healthy adult subjects: two single-dose, open-label, randomized-sequence, crossover studies. Clin Ther. 2009 Apr;31(4):764-76.
13.Nomoto M, Pastino G, Rege B, et al. Pharmacokinetics, Pharmacodynamics, Pharmacogenomics, Safety, and Tolerability of Avatrombopag in Healthy Japanese and White Subjects. Clin Pharmacol Drug Dev. 2018 Feb;7(2):188-195.
14.Abe M, Suzuki K, Sakata C, et al. Pharmacological profile of AS1670542, a novel orally-active human thrombopoietin receptor agonist. Eur J Pharmacol. 2011 Jan 10;650(1):58-63.
15.李红梅,余文熙,彭志刚,等.阿伐曲泊帕治疗肿瘤化疗所致血小板减少症的疗效及安全性的回顾性研究[J].肿瘤,2021,41(12):832-839.
16.Al-Samkari H, Kolb-Sielecki J, Safina SZ, et al. Avatrombopag for chemotherapy-induced thrombocytopenia in patients with non-haematological malignancies: an international, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Haematol. 2022 Mar;9(3):e179-e189.
17.Gabrail N, Smith C. Avatrombopag Optimizes Response to Niraparib by Managing Thrombocytopenia Associated with Poly-ADP Ribose Polymerase (PARP) Inhibition in Ovarian Cancer and Breast Cancer: A Case Series. Am J Case Rep. 2020 Nov 16;21:e927008.
18.Tu X, Xue A, Wu S, et al. Case Report: Successful Avatrombopag Treatment for Two Cases of Anti-PD-1 Antibody-Induced Acquired Amegakaryocytic Thrombocytopenia. Front Pharmacol. 2022 Jan 27;12:795884.












