随着肿瘤靶向治疗、免疫治疗等新型治疗手段以及升血小板治疗新药的不断涌现,药物可及性的逐步提高,既往定义的化疗所致的血小板减少症已不能适应如今肿瘤治疗的新形势。因此,为满足我国现阶段肿瘤治疗所致血小板减少症(CTIT)防治的需求,《中国肿瘤药物相关血小板减少症诊疗专家共识(2023版)》结合国内外最新临床循证依据以及国内临床实践,对2019版诊疗共识进行更新整理。其中,新版共识进一步肯定了血小板生成素受体激动剂(TPO-RA)类药物在CTIT的防治过程中的价值。
CTIT是抗肿瘤药物常见的不良反应之一,发生率高达21.8%¹。CTIT不仅增加出血风险、延长住院时间,也可导致治疗剂量强度降低、推迟治疗时间,甚至被迫中止治疗,以致影响抗肿瘤疗效,对患者长期生存产生不利影响。
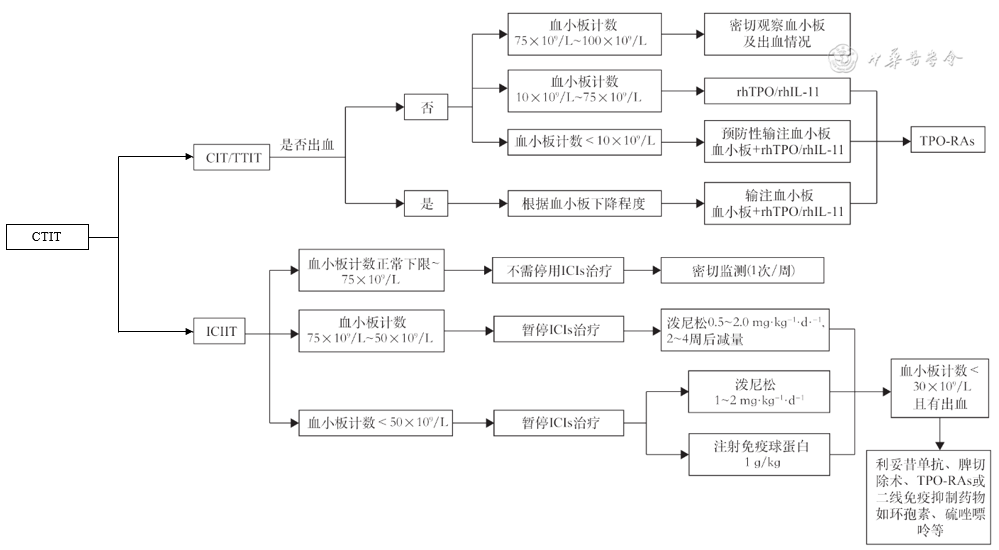
因此,CTIT的治疗目标应以降低血小板减少所导致的出血风险、提高血小板最低值、缩短血小板减少的持续时间为出发点,并减少CTIT导致的剂量强度降低,从而改善患者的远期生存。新版共识进一步优化了CTIT治疗流程和操作规范,明确了不同程度血小板减少的处理策略选择,以降低不必要血小板输注的风险,如图1所示。此外,增加了对促血小板生长因子类药物使用的讨论,提出了更明确的适应症及用药策略推荐²。图1. CTIT的治疗流程
新版共识推荐的治疗措施主要包括输注血小板、给予重组人血小板生成素(rhTPO)、重组人白介素-11(rhIL-11)和TPO受体激动剂(TPO-RAs)。
rhTPO是在中国仓鼠卵巢细胞中表达的全长糖基化重组人血小板生成素,其具有和人内源性TPO相同的氨基酸序列和结构,通过与其特异性受体Mpl结合而产生生物学效应³,如图2所示。然而,正是由于氨基酸序列同源性⁴,rhTPO治疗可能会导致中和抗体的出现,进而导致骨髓巨核细胞减少,使得血小板减少情况进一步恶化。此外,rhTPO需要在院内进行皮下注射,潜在增加CTIT患者院内感染的发生风险⁵。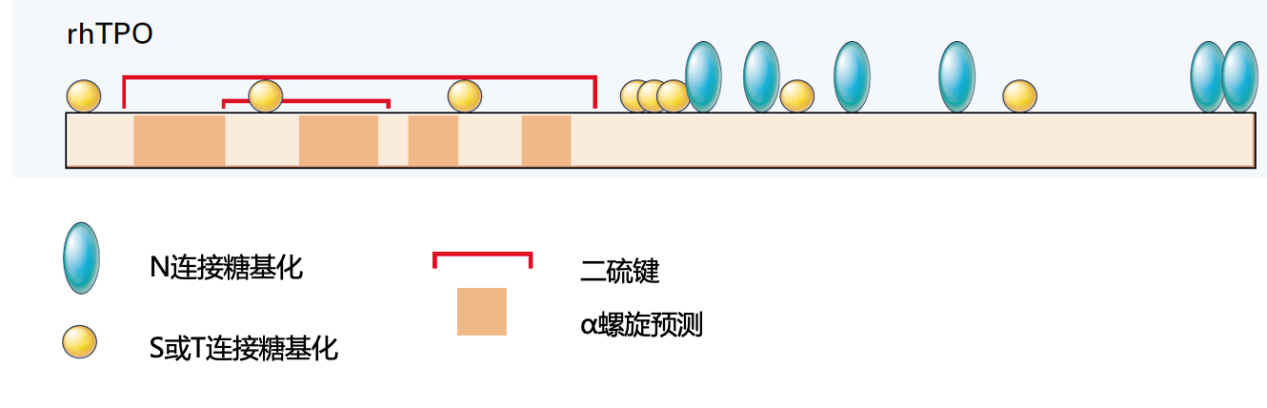
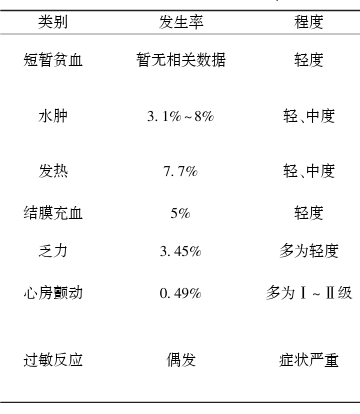
rhIL-11是另一种促造血因子,可直接刺激造血干细胞和巨核系祖细胞的增殖,诱导巨核细胞分化成熟并促进高倍性巨核细胞生成,从而增加单个巨核细胞血小板的产量,提高血小板计数⁶,但rhIL-11治疗相关的不良反应需引起重视,尤其是水肿、心脏相关不良事件(如:心房颤动、心力衰竭)和过敏反应等,如表1所示⁷,⁸。
近些年,随着TPO-RAs治疗地位的不断提高,适应症不断扩展,适用于各类血小板减少症的治疗。因而,新版共识增加了TPO-RA在CTIT治疗中的推荐。TPO-RA是一类合成的TPO模拟物,其主要通过模拟TPO与TPO受体相结合,刺激巨核细胞和血小板生成,并可与人体内源性TPO协同促进血小板生成⁹。目前,国内上市的TPO-RAs类药物主要包括阿伐曲泊帕、海曲泊帕、艾曲泊帕和罗普司亭,但不同TPO-RA之间的作用机制也存在细微差异,如图3所示¹⁰,¹¹。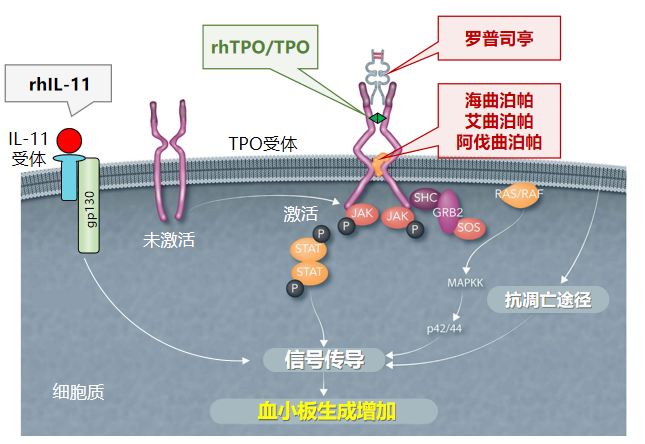
图3. 不同类型促血小板生成药物的作用机制
值得注意的是,阿伐曲泊帕是唯一不与金属离子发生螯合作用的小分子TPO-RA,且无肝毒性基团,不会引发肝脏相关不良事件,兼顾疗效与安全性。此外,与其他小分子TPO-RA不同的是,阿伐曲泊帕可以碾碎与食物同服,不影响药物稳定性,尤其适用于存在吞咽功能障碍或治疗依从性较差(儿童)的患者。随着临床循证的更新与积累,已有多项临床研究有效验证了TPO-RA治疗CTIT的临床价值:①促进血小板恢复;②有效缩短血小板减少症持续时间;③减少或避免化疗强度降低等,如表2所示。同时,两项最新的中国临床研究也进一步佐证了TPO-RA治疗CTIT的巨大潜力。结果显示,阿伐曲泊帕可使CTIT患者的血小板计数较基线显著增加,加速实体瘤患者化疗后血小板减少的恢复,减少血小板输注需求,且患者治疗的安全性与耐受性良好¹²,¹³。
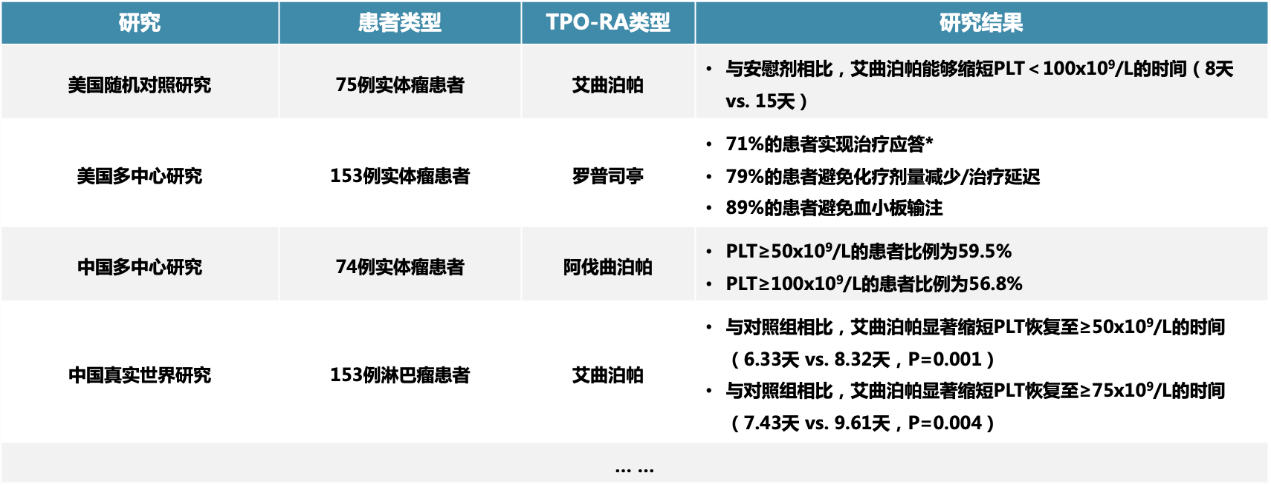
表2. TPO-RAs 用于治疗CIT的循证依据
CTIT是抗肿瘤治疗中常见的不良反应,其发生率和严重程度常与肿瘤类型、治疗方案和治疗周期等有关,出血风险通常与血小板减少症的程度有关。TPO-RA是新一代血小板生成药物,能有效促进血小板生成,在CTIT的治疗中有着重要作用。虽然目前国内上市的TPO-RA类药物(阿伐曲泊帕等)尚无CTIT适应症,但已有多部权威指南共识推荐TPO-RA作为CTIT的标准用药。相信在不久的将来,随着更多大样本随机对照研究结果的公布,将逐步优化国内CTIT的治疗格局,造福更多肿瘤患者。
1.Ten BergMJ, van den BemtPM, ShantakumarS, et al. Thrombocytopenia in adult cancer patients receiving cytotoxic chemotherapy: results from a retrospective hospital-based cohort study[J]. Drug Saf, 2011, 34(12):1151-1160.2.中国抗癌协会肿瘤临床化疗专业委员会,中国抗癌协会肿瘤支持治疗专业委员会. 中国肿瘤药物相关血小板减少诊疗专家共识(2023版)[J]. 中华医学杂志,2023,103(33):2579-2590.3.唐广,王晓敏,孟君霞,等.重组人血小板生成素与白介素-11治疗急性髓系白血病化疗后血小板减少症的疗效分析[J].中国实验血液学杂志,2018,26(01):234-238.4.Kuter DJ. Milestones in understanding platelet production: a historical overview. Br J Haematol. 2014;165(2):248-258.5.玲,崔雪华,黄劲华.肿瘤科医院感染危险因素调查分析[J].中华医院感染学杂志,2010,20(22):3480-3481.6.DuX, WilliamsDA. Interleukin-11: review of molecular, cell biology, and clinical use[J]. Blood, 1997, 89(11):3897-3908.7.重组人白介素-11防治血小板减少症临床应用中国专家共识(2021年版)[J].临床肿瘤学杂志,2020,25(12):1129-1137.9.Kühne T, Imbach P. Eltrombopag: an update on the novel, non-peptide thrombopoietin receptor agonist for the treatment of immune thrombocytopenia. Ann Hematol. 2010;89 Suppl 1:67-74.10.Kuter DJ. Treatment of chemotherapy-induced thrombocytopenia in patients with non-hematologic malignancies. Haematologica. 2022;107(6):1243-1263.11.Turner KJ, Neben S, Weich N, Schaub RG, Goldman SJ. The role of recombinant interleukin 11 in megakaryocytopoiesis. Stem Cells. 1996;14 Suppl 1:53-61.12.Gao Y, Liu Q, Shen Y, et al. Effect of avatrombopag in the management of severe and refractory chemotherapy-induced thrombocytopenia (CIT) in patients with solid tumors. Platelets. 2022;33(7):1024-1030.13.Al-Samkari H, Kolb-Sielecki J, Safina SZ, et al. Avatrombopag for chemotherapy-induced thrombocytopenia in patients with non-haematological malignancies: an international, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Haematol. 2022;9(3):e179-e189.