近年来,创新疗法陆续进入国内,神经母细胞瘤(NB)的临床治疗方案得以进一步优化。继2000年造血干细胞移植常规纳入高危NB患者的治疗计划以来¹,二十年后的今天,随着GD2单抗新药在国内的上市,中外权威共识的一致推荐²⁻⁴,以及国内专家对于免疫治疗的不断实践与探索,高危NB已经初步迈入了免疫治疗时代。
本文将主要围绕已获批上市的GD2单抗展开,对初治高危及复发/难治性神经母细胞瘤的治疗方案,各种GD2单抗在结构、疗效及安全性方面的证据进行深入分析,并针对GD2单抗在国内运用中临床医生所关注的问题作详细阐述。
1.Pinto NR, et al. J Clin Oncol. 2015 Sep 20;33(27):3008-17.2.2018年 NICE指南www.nice.org.uk/guidance/ta538.3.Ladenstein R, et al. Oral Presentation at ASCO 20194.中国抗癌协会小儿肿瘤专业委员会等. 中华小儿外科杂志,2022,43(7):588-598.
由于低、中危NB患儿的生存数据普遍较好,NB的临床治疗难点仍主要集中于高危患者。对于高危NB的三个阶段治疗,早在2015年由中国抗癌协会小儿肿瘤专业委员会(CCCG)神经母细胞瘤协作组制定发布的《儿童NB诊疗专家共识》中就已明确提及¹。结合国际诊疗进展和国内实际情况,在总结2015方案应用的前提下, 最新共识CCCG⁃NB⁃2021方案也在诊断分级、治疗方案及评估随访等方面作了要点更新²:■ 第一阶段为诱导治疗。通过低剂量化疗控制病情,初步抑制NB的快速进展,大幅度降低患儿体内的肿瘤负荷,并为随后的手术切除创造条件。■ 第二阶段为巩固治疗。该过程可有效降低肿瘤复发风险。通过造血干细胞移植,即大剂量的清髓化疗和干细胞输注,借助比第一阶段更加强力的肿瘤杀伤,以及后续的免疫重建,可初步消除微小残留病灶(MRD*);随后,放疗则再针对手术未能清除的原发和转移部位残余病灶进行有效杀伤。■ 第三阶段为维持治疗。即使通过上述阶段的治疗后,患儿获得完全或部分缓解后,仍需警惕高危NB的高复发风险。为进一步减少复发,在原有方案单药13-顺式维甲酸(13-cis-RA)的基础上,CCCG⁃NB⁃2021方案增加了对于GD2单抗免疫治疗的推荐,即应用达妥昔单抗β进行维持治疗。*残存的耐药肿瘤细胞从原发或转移病灶脱落,在血液中播散,其中绝大部分被人体免疫系统清除,而极少部分可能定植在骨髓、淋巴结及其他转移部位,由此形成了微小残留病灶(MRD)。
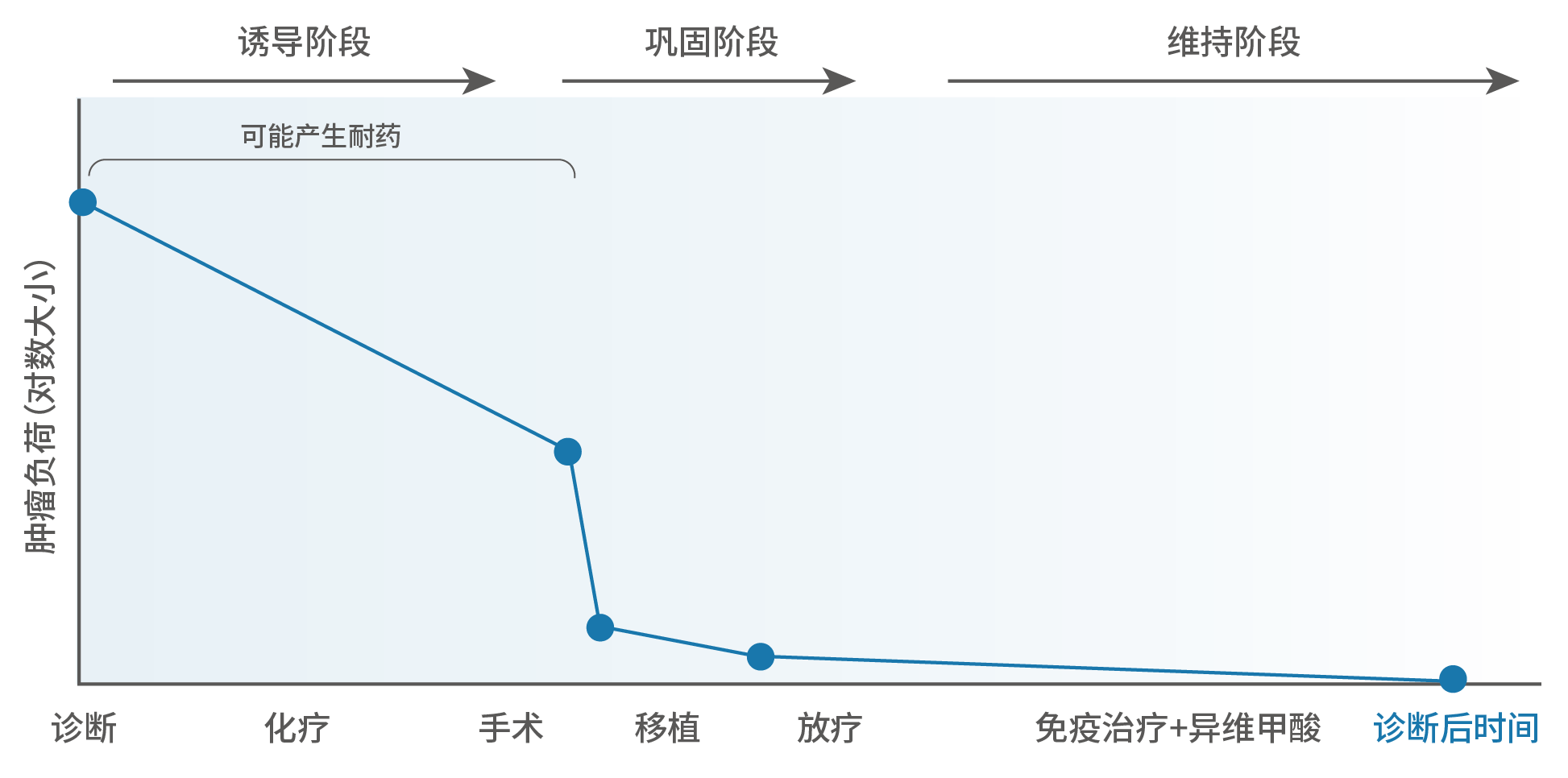
图1. 高危NB三阶段治疗及肿瘤负荷变化³
1.中国抗癌协会小儿肿瘤专业委员会等. 中华小儿外科杂志,2015,36(1):3-7.2.中国抗癌协会小儿肿瘤专业委员会等. 中华小儿外科杂志,2022,43(7):588-598.3.Uemura S, et al. Front Oncol. 2019 Jun 4;9:455.
疾病复发是指肿瘤首次完整治疗之后(包括手术、化疗、移植、放疗、GD2单抗免疫治疗)获得了缓解,在经过一段时间之后,肿瘤再次复发,可以是原发病灶的复发,也可以是全身疾病复发转移。难治性疾病是指肿瘤在首次完整治疗期间,对治疗的反应不佳(如化疗、放疗等),不能获得有效缓解,无法达到“完全缓解”或“部分缓解”的标准,处在疾病稳定或者疾病进展期。疾病复发和难治的出现,归根结底是由于NB肿瘤细胞经既往治疗后未得到彻底清除。截至目前,针对这部分患儿仍没有公认的标准治疗方案,临床医生须根据具体判断,综合患儿实际情况和已有治疗选择,拟定个性化方案¹:■ 手术切除和放射治疗是基本的局部治疗手段,适用于局灶复发NB的初步处理²。■ 化疗对小部分复发/难治性患儿短期有效,并使得部分无法完整切除肿瘤的患儿获得二次切除的机会³;但仅用化疗这一种手段,患儿的长期生存获益十分有限:数据显示,伊立替康联合替莫唑胺(I/T)治疗复发/难治性患儿的客观缓解率仅为15%,2年无事件生存(EFS)率和总生存(OS)率分别为13%和30%⁴。■ 免疫治疗方面,目前已有2类GD2单抗——达妥昔单抗β和那西妥单抗在国内上市⁵,⁶,其中达妥昔单抗β适用于初治高危及复发/难治性神经母细胞瘤患者(包括骨/骨髓和其他病灶)⁷,那西妥单抗则适用于伴骨/骨髓转移的复发/难治性高危神经母细胞瘤患者⁸。■ 如果患儿自体干细胞采集能符合移植所需,可考虑运用自体干细胞移植,采干困难或干细胞不符合需要的患儿可接受异基因造血干细胞移植。目前复发/难治性患儿接受干细胞移植治疗还缺乏大宗病例的临床研究,现有小规模研究报道的疗效不一,循证证据尚待进一步补充。■ 放射性核素(如¹³¹I⁃MIBG、¹¹¹In⁃DOTA TATE、¹⁷⁷Lu⁃DOTATATE或⁹⁰Y⁃DOTATATE)的运用尚需更加深入的研究。
参考文献:
1.儿童神经母细胞瘤诊疗专家共识CCCG-NB-2021方案[J].中华小儿外科杂志,2022,43(07):588-598
2.https://www.ncbi.nlm.nih.gov/books/NBK65747/#CDR0000062786__706
3.亓凯,等. 中国实用儿科杂志, 2017, 32(11):846-850.
4.Bagatell R, et al. J Clin Oncol. 2011 Jan 10;29(2):208-13.
5.https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210816154622110.html
6.https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20221208092804174.html
7.达妥昔单抗β注射液说明书
8.DANYELZA Prescribing Information. 2020
⭐ 什么是GD2单抗免疫治疗?
肿瘤免疫治疗可唤醒患儿自身的免疫系统来杀灭肿瘤细胞。在高危NB治疗的维持阶段,患儿需要接受免疫治疗以进一步清除体内的残留病灶。目前最有效的免疫治疗是针对GD2抗原的单克隆抗体(简称单抗)药物。
GD2是在NB细胞表面特异性表达的一种神经节苷脂,GD2单抗可通过结合GD2诱导机体自身免疫细胞的杀伤作用,精准消灭肿瘤细胞。
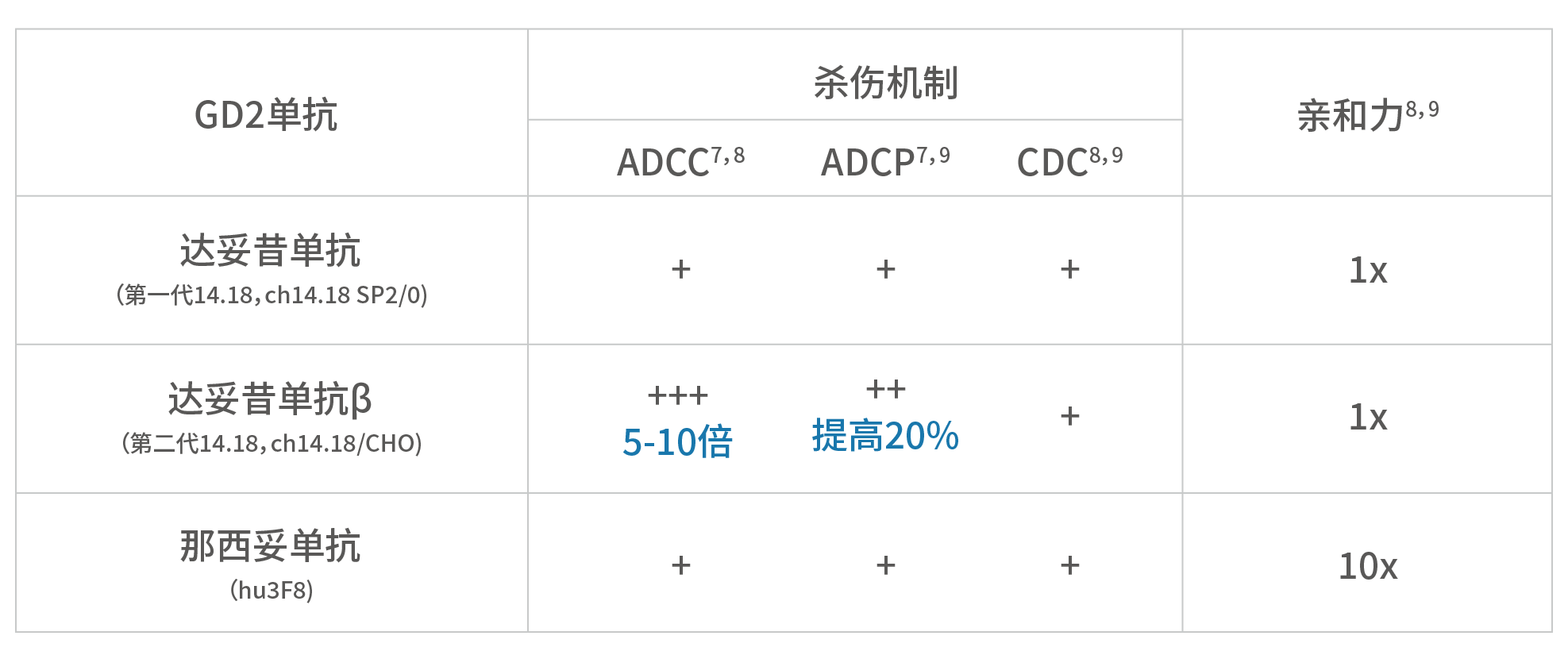
GD2单抗可激活多种免疫机制,其作用可分为抗体依赖和补体依赖两大类型,主要作用包括五种:ADCC(抗体依赖细胞介导的细胞毒性)、ADCP(抗体依赖的细胞吞噬)和CDC(补体介导的细胞毒性)、CDCC(补体依赖的细胞毒性)和CDCP(补体依赖的细胞吞噬);其中ADCC被认为是单抗最主要的肿瘤杀伤机制。
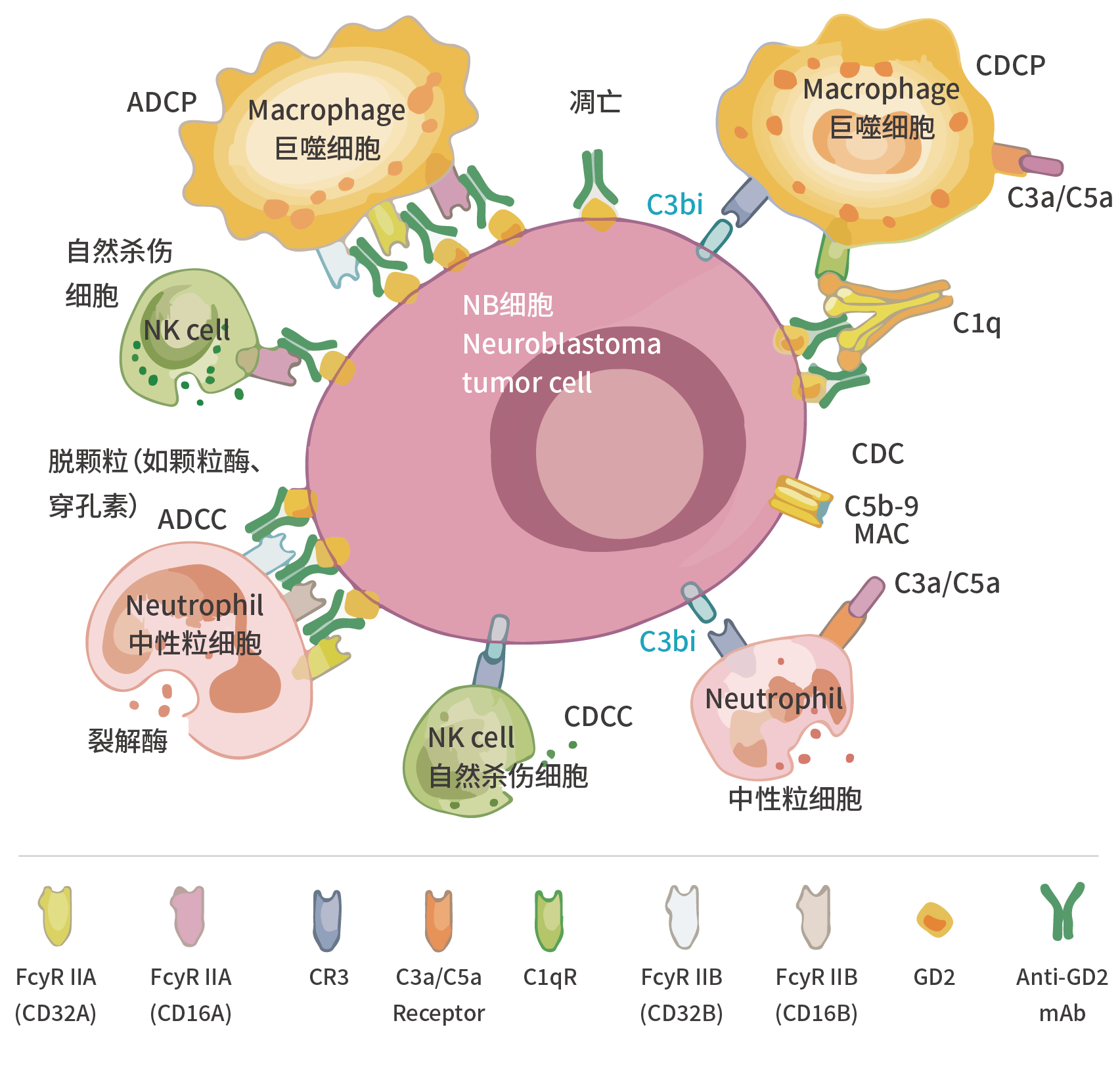
图2. GD2单抗的作用机制
参考文献:
Park JA, et al. J Clin Oncol. 2020;38:1836-48
目前全球范围内上市的GD2单抗有3种,其中达妥昔单抗β和那西妥单抗已在中国获批上市。表1. GD2单抗获批情况
FDA,美国食品药品监督管理局;EMA,欧洲药品管理局;NMPA,国家药品监督管理局
1.United Therapeutics. Overview of Unituxin. 2017. Available at: https://unituxin.com/about-unituxin/overview-of-unituxin/2.European Medicines Agency. 2021. Available at: https://www.ema.europa.eu/en/documents/ public-statement/public-statement-unituxin-withdrawal-marketing-authorisation-european-union_en.pdf3.https://www.ema.europa.eu/4.https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210816154622110.html5.FDA grants accelerated approval to naxitamab for high-risk neuroblastoma in bone or bone marrow | FDA6.https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20221208092804174.html目前,三种已上市的GD2单抗之间暂时没有头对头研究,也就是直接对比研究。因此,我们通过设计相近的临床研究和临床前研究进行详细的分析。■ 达妥昔单抗(ch14.18/SP/2/0,第一代14.18)和达妥昔单抗β(ch14.18/CHO,第二代14.18)的结构较为相似,区别在于达妥昔单抗β优化了重克隆细胞系,导致两者糖基化结构上存在一定差异。达妥昔单抗含有一定比例的α-gal,具有免疫原性和潜在致敏性;达妥昔单抗β中不存在这一结构¹,避免了该结构所导致的过敏反应。■ 通过下图的总结可发现,不同GD2单抗的过敏反应发生率和严重程度存在明显差异²⁻⁴。由于严重的输注相关过敏和神经毒性反应,达妥昔单抗被FDA予以最高等级的警示——黑框警告,那西妥单抗则被FDA和中国药品监督管理局(NMPA)同时予以黑框警告⁴,⁵,⁶,以提示其潜在风险。而达妥昔单抗β则没有黑框警告⁷。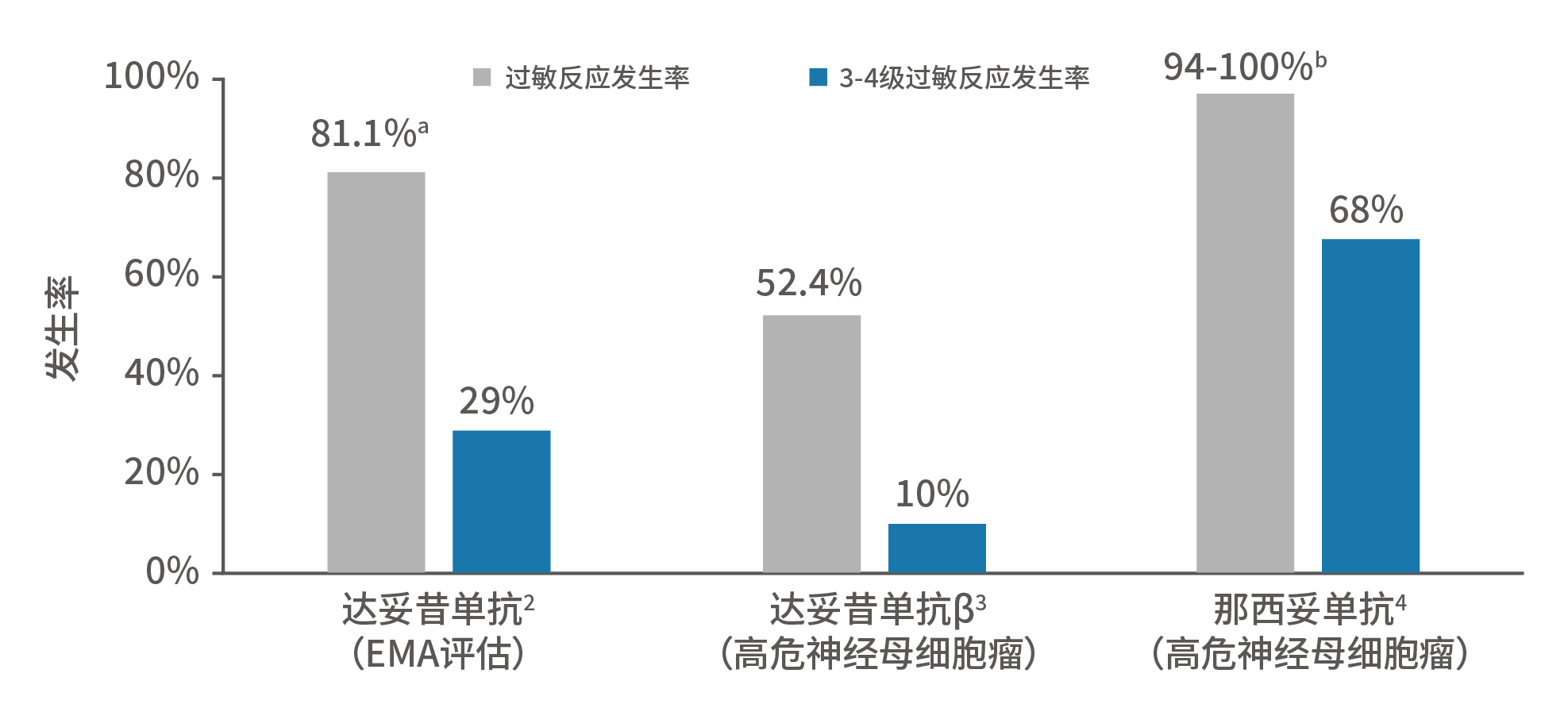
图3. GD2单抗的过敏事件及严重程度比较
此处报告的数据来自若干独立的研究,非头对头研究
此外,通过体外研究测量不同机制导致的肿瘤细胞裂解,不同研究者发现达妥昔单抗(第一代14.18)与那西妥单抗(hu3F8)的肿瘤杀伤效力基本相同⁸;而达妥昔单抗β(第二代14.18)的ADCC效力是达妥昔单抗的5-10倍⁹,ADCP效力较那西妥单抗提高了20%¹⁰,CDC效力方面3个单抗则基本一致。
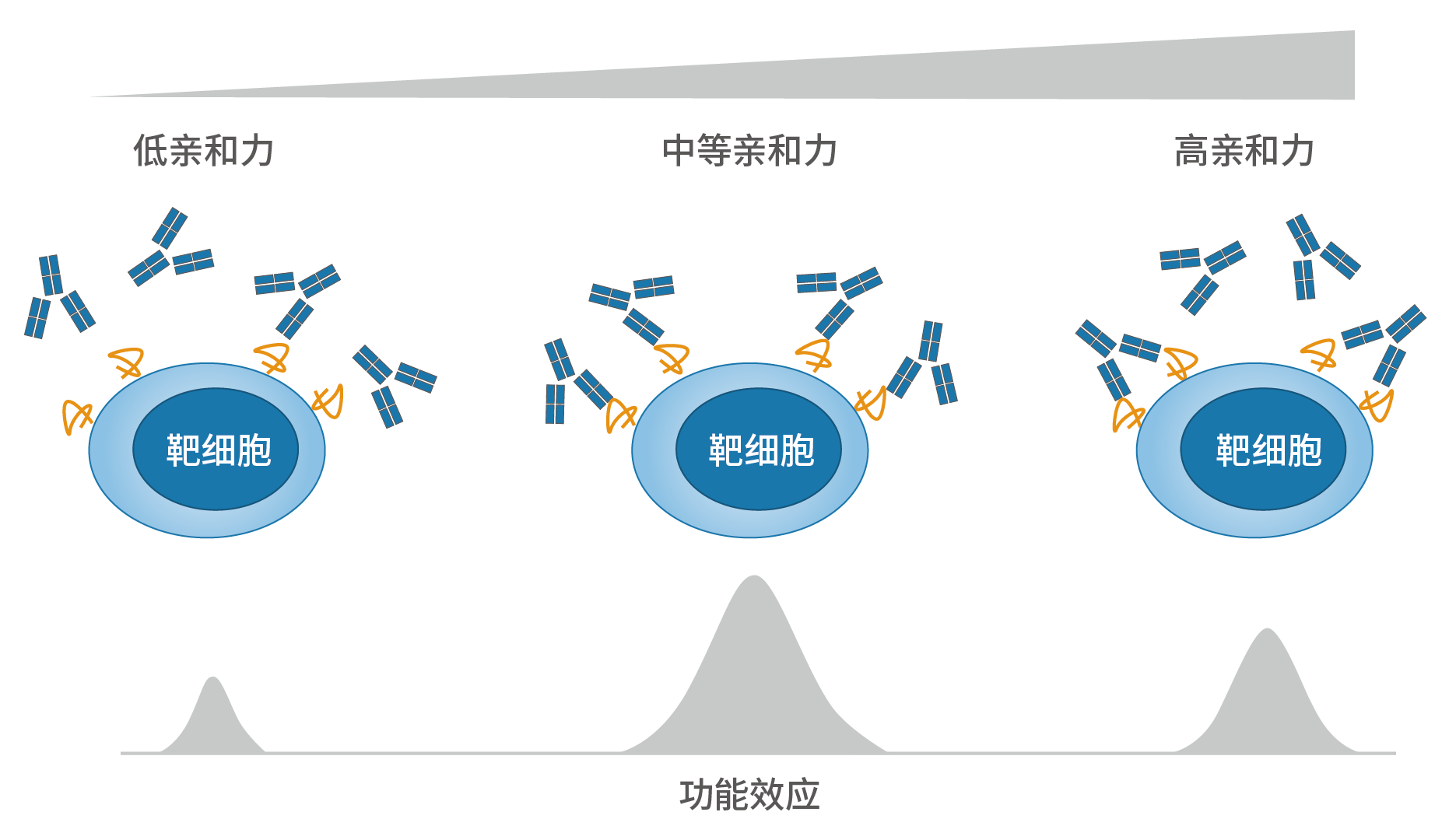
那么,是什么原因导致不同GD2单抗杀伤肿瘤的能力不同?研究表明,上述肿瘤杀伤能力的差异仍来源于这些GD2单抗分子结构的不同:达妥昔单抗β中具有免疫细胞亲和力优势的糖基化结构G2F、G1F (α1-6)比例均大于达妥昔单抗和那西妥单抗¹⁰⁻¹²,也就是说,达妥昔单抗β更容易与免疫细胞结合,诱导更强的ADCC、ADCP等免疫机制,从而发挥更强的肿瘤杀伤作用。
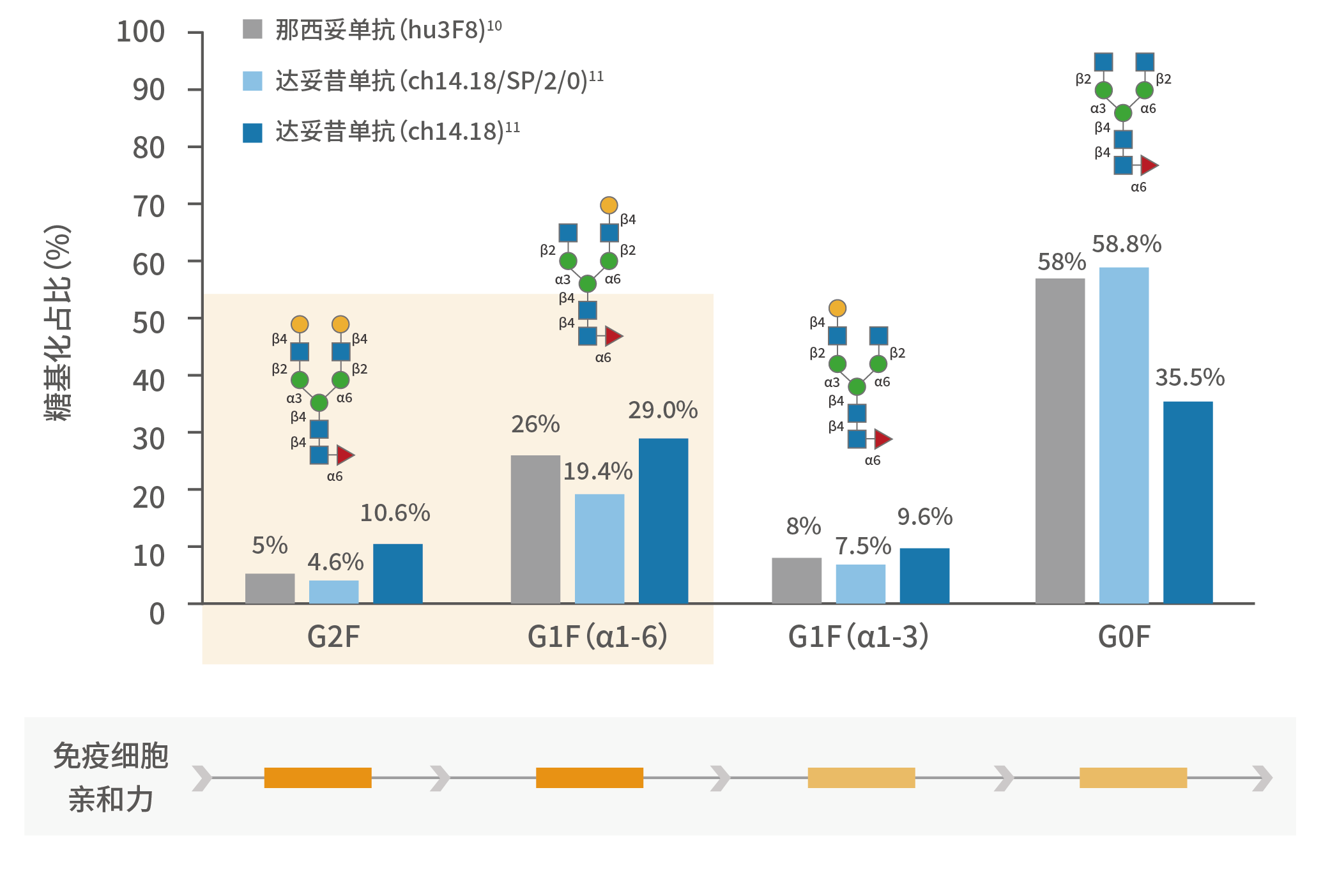
图4. 不同GD2单抗的各类糖基化的比例
相反的,那西妥单抗对GD2的亲和力是达妥昔单抗、达妥昔单抗β的10倍⁹,¹⁰,换言之,那西妥单抗更容易结合GD2抗原。遗憾的是,上述体外研究提示,那西妥单抗更高的亲和力并没有带来更强的肿瘤杀伤作用(ADCC、ADCP和CDC);同时,由于正常神经细胞中也存在少量GD2抗原¹³,那西妥单抗的高亲和力或过度结合正常细胞,这可能是其诱发严重神经疼痛反应的原因:那西妥单抗相关神经毒性同时受到了FDA和NMPA的黑框警告⁴,⁶。这些结论引发了另一个问题,拥有更高亲和力的hu3F8在肿瘤杀伤能力上与第一代14.18相似,并且远不如第二代14.18(达妥昔单抗β),为何如此,是否是偶然事件?其实不然。我们发现,最近发表在Nature、PLoS One、Frontiers in Immunology 等¹⁴⁻¹⁸国际一线科学期刊中的文章均验证了不同类型的单抗、双特异性抗体、抗体偶联药物甚至CAR-T 细胞的亲和力与疗效(肿瘤杀伤能力)的关系和其内在的分子机制。这些研究的结论都指向——拥有中等或适度的亲和力的药物反而比高亲和力的药物具有更高的抗肿瘤活性。这给创新药物的研发人员提供了新的设计思路,并提示在研发过程中需要更加深入地了解靶点的信号通路以及抗体的作用机制。图5.抗体与靶细胞的结合亲和力调节效应器功能效力的模型*¹⁵*:当亲和力过高,抗体以二价形式结合靶抗原,即抗体的两个Fab端均与抗原结合,但有些抗体不能得到最大化利用,Fc段触发的抗肿瘤效应并不一定是增强的 ;中等亲和力的抗体,以单价形式与靶抗原结合,抗体利用最大化,反而可激活抗肿瘤效应达到最大值
综上,在全球已上市的3个GD2单抗中,达妥昔单抗β的分子结构优势(糖基化和α-gal结构)以及适度的亲和力,使其在肿瘤杀伤能力和减少不良反应方面具有明确的优势。参考文献:
1.Apeiron APN311 Superiority Argumentation Summary 2016.
2.European Medicines Agency 2015. Unituxin.
3.Ladenstein R, et al. Cancers 2020; 12(2); E309.
4.DANYELZA® (naxitamab-gqgk) injection, for intravenous use, prescribing information
5.Unituxin Prescribing Information. 2015.
6.那西妥单抗注射液说明书
7.达妥昔单抗β说明书
8.Park J, et al. J Clin Oncol 2020; 38:1836-1848.
9.Loibner H, et al. Presented at: Int Soc Paediatr Oncol Eur Neuroblastoma 2014; Vienna, Austria.
10.Lisby S, et al. International Society of Paediatric Oncology (SIOP) 2020 Virtual Congress. October 14-17, 2020. Abstract #945,
11.Aoyama M,et al. MABS. 2019;11(5): 826-836
12.European Medicines Agency. Assessment report - Dinutuximab beta. 2017
13.Yu J, et al. FEBS Lett. 2020 Nov;594(22):3602-3618.
14.Yu X, et al. Nature. 2023 Feb;614(7948):539-547.
15.Mazor Y, et al. PLoS One. 2016 Jun 20;11(6):e0157788
16.Mao R, et al. Front Immunol. 2022 Oct 17;13:1032403.
17.Tsumura R, et al. J Control Release. 2018 Aug 28;284:49-56.
18.Long M, et al.Immunol Invest. 2022 Nov;51(8):2176-2214.
■ 达妥昔单抗(ch14.18/SP/2/0,第一代14.18)适用于多模式治疗前实现至少部分缓解反应的初治高危NB患儿的维持治疗¹■ 达妥昔单抗β(ch14.18/CHO,第二代14.18)适用于≥12月龄的初治高危NB患儿,既往需接受过诱导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗;也适用于治疗伴或不伴有残留病灶(包括骨/骨髓和其他病灶)的复发或难治性NB²■ 那西妥单抗(Hu3F8)适用于1岁及以上对先前治疗部分反应、轻微反应或病情稳定的骨/骨髓转移的高危复发/难治性NB³
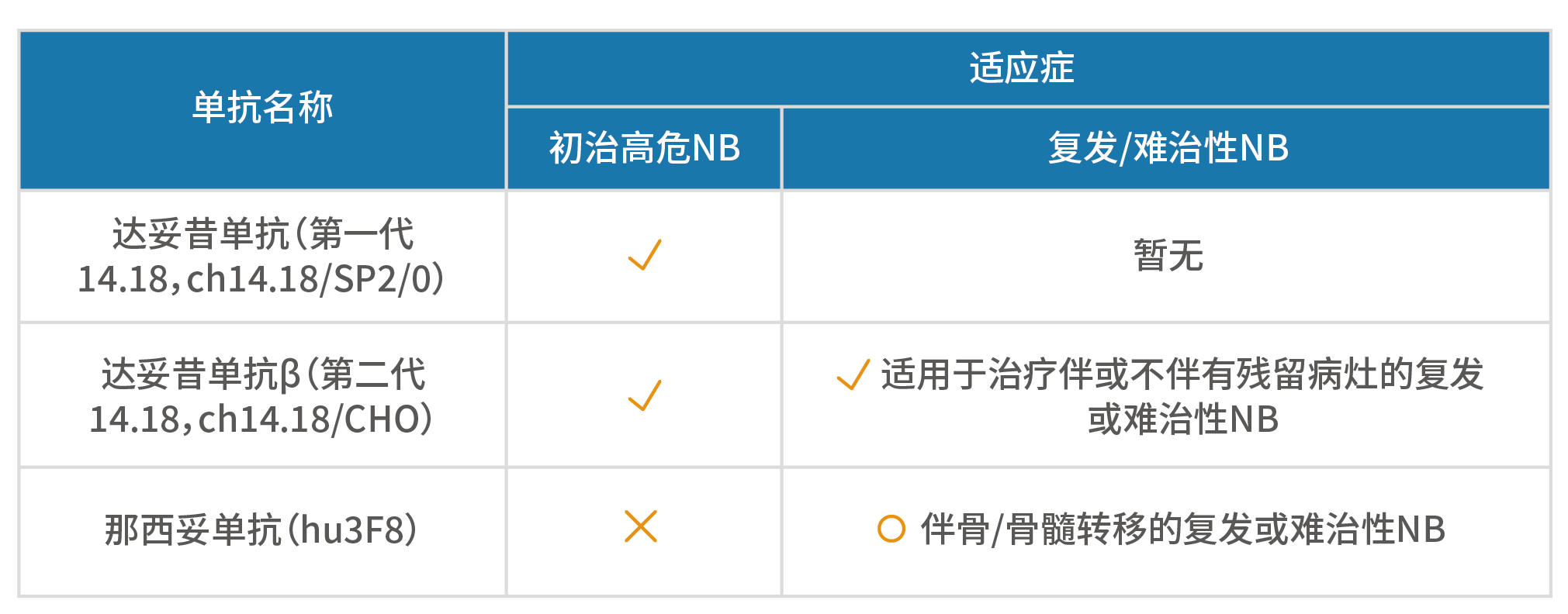
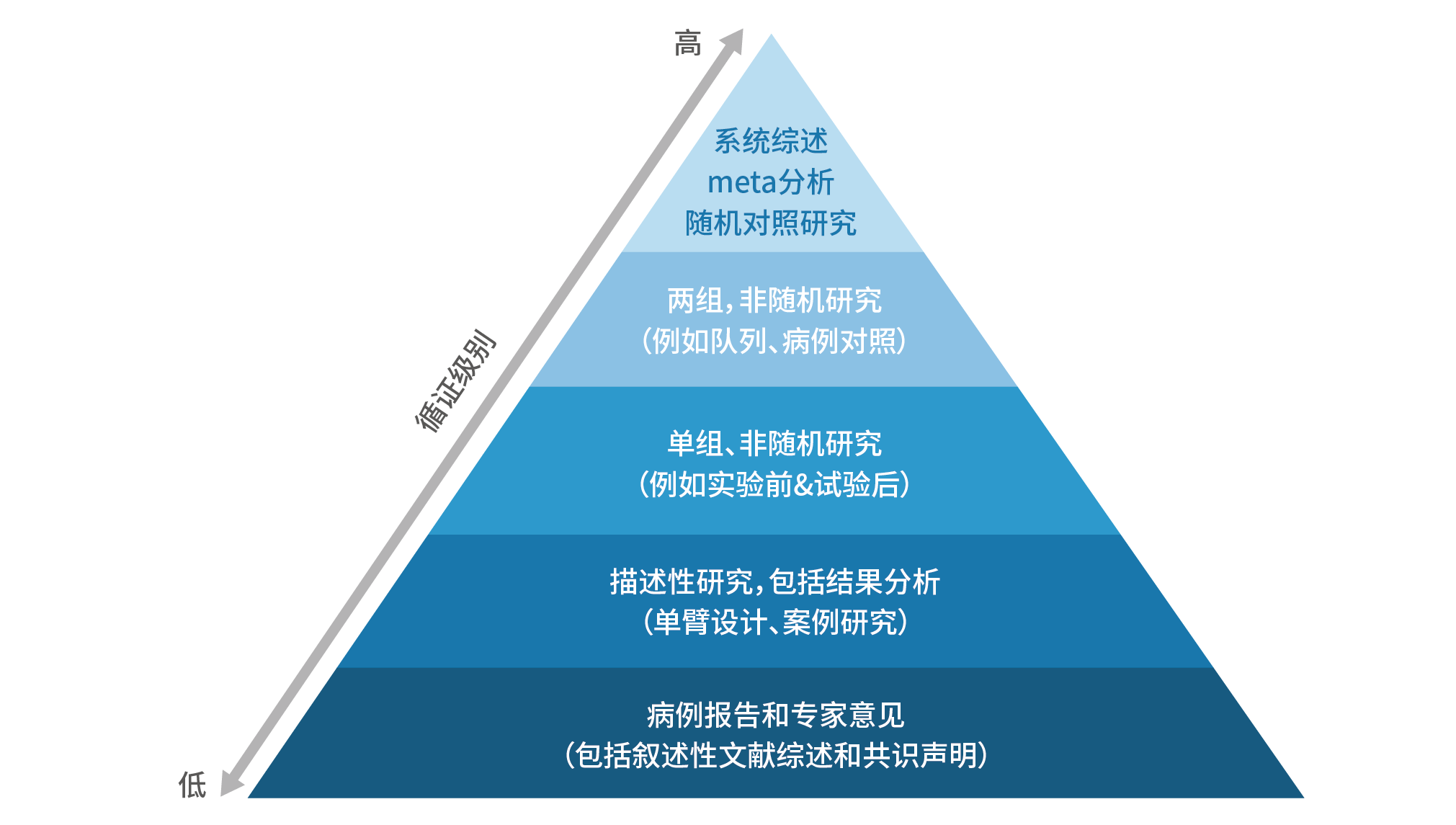
综上,在中国获批的两种GD2单抗,达妥昔单抗β的适应症广泛,可以用于初治高危NB的维持治疗,以及所有复发难治性NB患者的治疗;那西妥单抗的适应症为用于治疗伴骨或骨髓转移的复发或难治性患者。下文会详细分析为何有这些差异。1.Unituxin Prescribing Information. 2015.3.DANYELZA®(naxitamab-gqgk) injection, for intravenous use, prescribing information■ 首先向大家普及一下关于循证医学的证据等级。不同临床研究的设计背景和性质代表着证据等级的高低,其中大样本、多中心随机对照研究的证据等级最高,是药物疗效与安全性评价的金标准:随机对照试验使得组间具有良好的可比性,科学性强;多中心、大样本的纳入可以减少研究偏倚,所得的数据更加准确可靠。相较而言,单中心、小样本、非随机研究的证据等级更低,循证支持力度更弱。图6. 循证金字塔
其次,纳入人群的患者基线特征也至关重要。由于NB异质性很强,同样分类为高危,不同患者的病情可能仍存在较大差异,如有以下特征,则说明治疗难度更大:
■ MYCN扩增比例高
■ 免疫治疗前缓解情况不佳(完全缓解为最佳,部分缓解、疾病稳定和疾病进展的治疗情况依次递减)
■ 既往治疗手段(例如使用过GD2单抗)
■ 复发次数多
■ 转移部位广泛
复发患者和难治性患者的治疗难度差异也很大——数据显示,复发患者中位生存期为11个月,难治性患者中位生存期则为27.9个月,可以看出,复发患者的预后明显更差,也就是说,复发患者纳入的比例高,整体治疗结果数据更差。
不仅如此,研究终点的设置是否全面也是我们评判临床研究的一个关键角度。研究终点指的是某项临床研究最终评定的指标。在NB治疗中,客观缓解(ORR)用于评价治疗当前获得一定程度治疗反应的患者比例,评估的是药物短期疗效;无事件生存(EFS)、无进展生存(PFS)、总生存(OS)则指的是长期随访中患者的预后情况,评估的是药物长期获益。通过综合短期和长期生存率数据,我们才能客观准确地评价一个抗肿瘤药物的实际疗效。
此外,疗效评价也需要考量具体的用药方案。治疗周期长短、用药剂量大小、是否联合其他药物都可能影响最终的治疗结果。例如相较于联合粒细胞巨噬细胞集落刺激因子(GM-CSF)或白介素2(IL-2),GD2单抗的单药治疗能够体现的疗效则更为直接。
综上,我们需结合研究背景、性质、纳入对象、短期缓解和长期生存数据来综合评价3种GD2单抗的疗效。
CR,完全缓解;VGPR,非常好的部分缓解;PR,部分缓解达妥昔单抗:
■ 国际多中心Ⅲ期随机对照研究显示,13-顺式维甲酸±达妥昔单抗联合IL-2/GM-CSF,5年EFS率为56.6%,5年OS率为73.2%,均显著优于非免疫治疗组。
达妥昔单抗β:
■ 达妥昔单抗β通过短期和长期两种输注方案进行了多个多中心临床研究,接受免疫治疗的高危患儿达一千余人。其中短期输注方案中,SIOPEN APN311-302 国际多中心III期随机对照研究 [患者来自19个国家和地区(包括中国香港)的146个中心] 显示,达妥昔单抗β免疫治疗组5年EFS率为57%,较非免疫治疗组提升了15%(p<0.001),长期输注方案治疗的2年EFS和2年OS则分别达到了67%和82%,更长期的随访数据尚未发布。
那西妥单抗:
■ 西班牙单中心研究,为拓展性同情使用临床试验用药(未在美国国立注册资料库注册),那西妥单抗联合GM-CSF治疗,仅纳入达到CR的高危患儿,3年EFS为58.4%,3年OS为82.4%。
注:任何以人为对象的前瞻性研究试验,都应先注册后实施;ClinicalTrials.gov临床注册流程是一个非常重要的环节,是临床试验透明度和质量保障的基础。小结
■ 基于研究的证据级别,不同GD2单抗的临床研究背景差异很大,因此不可直接比较:从研究背景来看,达妥昔单抗和达妥昔单抗β针对高危患者均进行了多中心、大样本、III期临床研究,由权威学术组织发起研究,证据等级高;那西妥单抗所进行的单中心、未注册、同情用药研究证据等级弱,未申请相应适应症。简而言之,达妥昔单抗和达妥昔单抗β的数据更为可靠。
■ 不同GD2单抗临床研究的纳入人群与基线水平也各不相同,因此治疗难度并不在同一水平:达妥昔单抗和达妥昔单抗β研究纳入的患者MYCN 扩增比例约为40%,其中达妥昔单抗β涵盖了免疫治疗前达到不同缓解程度(包括CR、VGPR和PR)的患者;而那西妥单抗研究患者MYCN扩增比例为23%,仅纳入达到CR的患者,没有纳入VGPR和PR患者。综上,达妥昔单抗β纳入人群的治疗难度高。
■ 此外,就给药方案来看,达妥昔单抗和那西妥单抗的临床研究中都联合应用了GM-CSF,但由于欧洲缺乏该类药物,导致达妥昔单抗β相关临床研究中均未联合GM-CSF,因而我们推测当达妥昔单抗β联合GM-CSF时,免疫治疗的效果可能会进一步提高,但有待进一步研究验证。参考《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识》,目前已将联合GM-CSF作为治疗方案之一进行推荐。
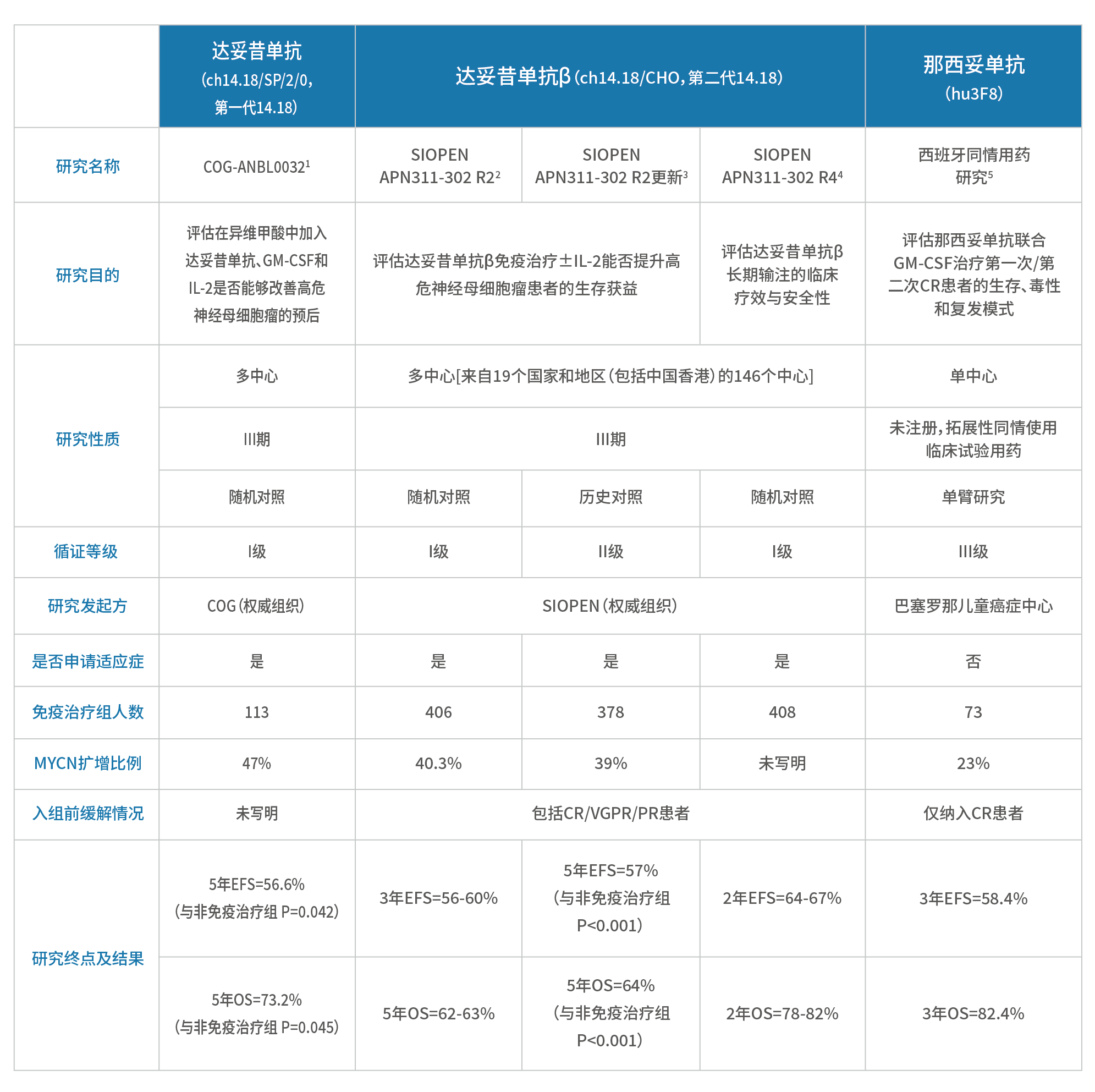
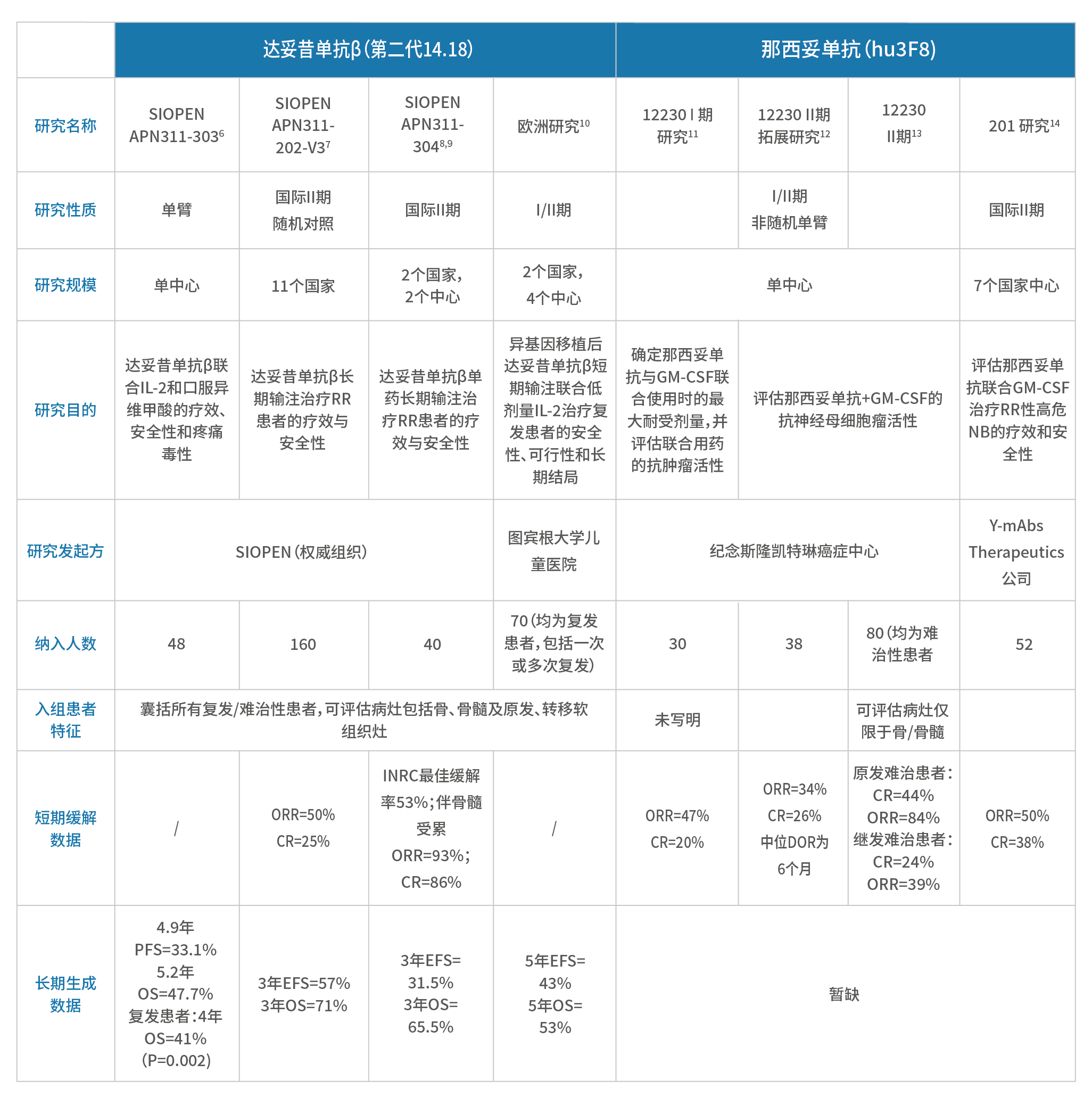
表5. 2种GD2单抗针对复发/难治性NB的关键研究汇总
■ 达妥昔单抗β单药(未联合13顺式维甲酸和细胞因子)长期输注治疗复发/难治性高危NB患者,最佳反应率为53.0%,获得完全或部分缓解患儿的中位缓解持续时间为238天(近8个月);在14例骨髓受累复发/难治性患儿中,13例患儿(93%)达ORR(其中12例为CR)。■ 单克隆抗体的分子结构驱动它们被机体的受体识别为外来物质,可能引发不良免疫反应,其主要表现之一就是抗药物抗体(ADA)的产生。目前普遍认为ADA会导致药物被快速清除,进而影响疗效。根据GD2单抗药物的不同类型,产生对应的ADA:鼠源抗体产生的ADA被称为人抗小鼠抗体(HAMA);人鼠嵌合抗体产生的ADA被称为人抗嵌合抗体(HACA);而人源化抗体产生的ADA则是人抗人抗体(HAHA)。■ 然而,根据SIOPEN APN311-304研究的最新报道显示,虽然接受治疗后24%的患者出现了HACA,但出现HACA与达妥昔单抗β暴露以及患者的临床缓解率、生存率均无明显相关性。■ 达妥昔单抗β长期输注联合13-顺式维甲酸分别在两个研究中应用于治疗复发/难治性NB,SIOPEN APN311-202 V3研究的ORR为50%,CR率为25%;3年EFS和OS分别为57%和71%;SIOPEN APN311-303研究的4.9年PFS为33.1%,5.2年OS为47.7%,治疗复发NB患儿相较于非免疫治疗组的4年OS率显著增加26%(p=0.002);■ 此外,一项多中心欧洲研究中,达妥昔单抗β短期输注联合低剂量IL-2治疗复发的高危患者,5年EFS率达43%,5年OS率达53%;由于复发NB的病情较难治性NB更为凶险,预后也更差,既往数据显示复发患者4年PFS仅6%,4年OS为20%¹³,基于此,该研究提示,达妥昔单抗β可大幅改善复发患者的长期生存。■ 那西妥单抗联合GM-CSF治疗仅伴骨/骨髓转移的复发/难治性患者,12-230不同阶段研究中,ORR在34-47%之间,CR率为20-26%。■ 同时,12-230的研究结果显示57例患者中有5例(9%)在第1周期后出现HAHA;49例患者中有8例(16%)在第2周期后出现HAHA。2例患者在第9个周期和第12个周期后出现晚期HAHA。 表6.12-230研究中患者产生HAHA的情况
■ 根据201研究最初发布的数据,ORR和CR率分别为50%和38%。那西妥单抗联合GM-CSF治疗局限于骨髓病灶的复发/难治性患者CR率为74%;治疗局限于骨病灶的患者CR率和ORR分别为58%和40%。
■ 目前,相关长期生存数据尚未发表。
小结
达妥昔单抗β和那西妥单抗针对复发/难治性神经母细胞瘤均展开多项临床研究:
■ 就研究的样本量来看,不同GD2单抗研究的患者数差距很大,解读研究结果需要参考患者数的差异
■ 纳入人群的广度决定了疗效数据的代表性:那西妥单抗的两项疗效评估研究中,所纳入患者的病灶仅局限于骨或骨髓;达妥昔单抗β研究所纳入的患者为整个RR患者群体,包括了具有原发、转移软组织灶、骨、骨髓转移病灶的患者
■ 研究终点全面与否也是循证证据的重要评判指标:那西妥单抗的疗效评估结果呈现为短期缓解,达妥昔单抗β的疗效评估同时包括短期缓解与随访生存数据
此外,GD2单抗还可与化疗联合用药治疗复发/难治性神经母细胞瘤,缓解数据罗列如下:
■ 达妥昔单抗+IT(伊立替康+替莫唑胺)化疗+GM-CSF:ORR为41.5%,CR率为20.8%(非免疫治疗组ORR为5.6%,无患儿达到CR)¹⁶;
■ 达妥昔单抗β长期输注+TTo(拓扑替康+替莫唑胺)化疗(未联用细胞因子):ORR为34.8%,CR率为11.6%,与TTo治疗随机对照组差异显著¹⁷;
■ 达妥昔单抗β长期输注+IT化疗:ORR为63.2%,CR率为31.6%¹⁸;
■ 那西妥单抗输注+IT化疗+GM-CSF(HITS):最佳ORR为37%,CR率为26%¹⁹
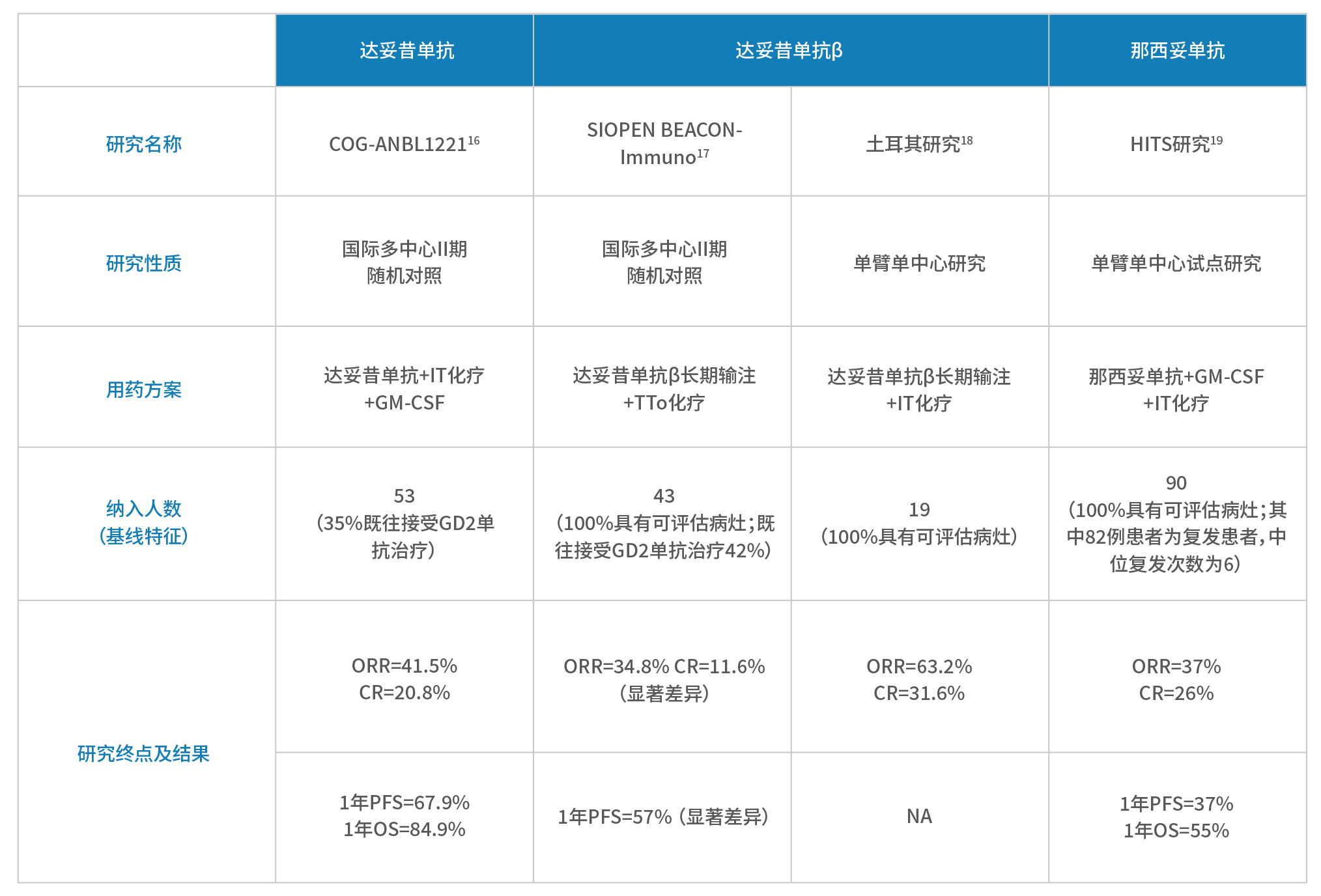
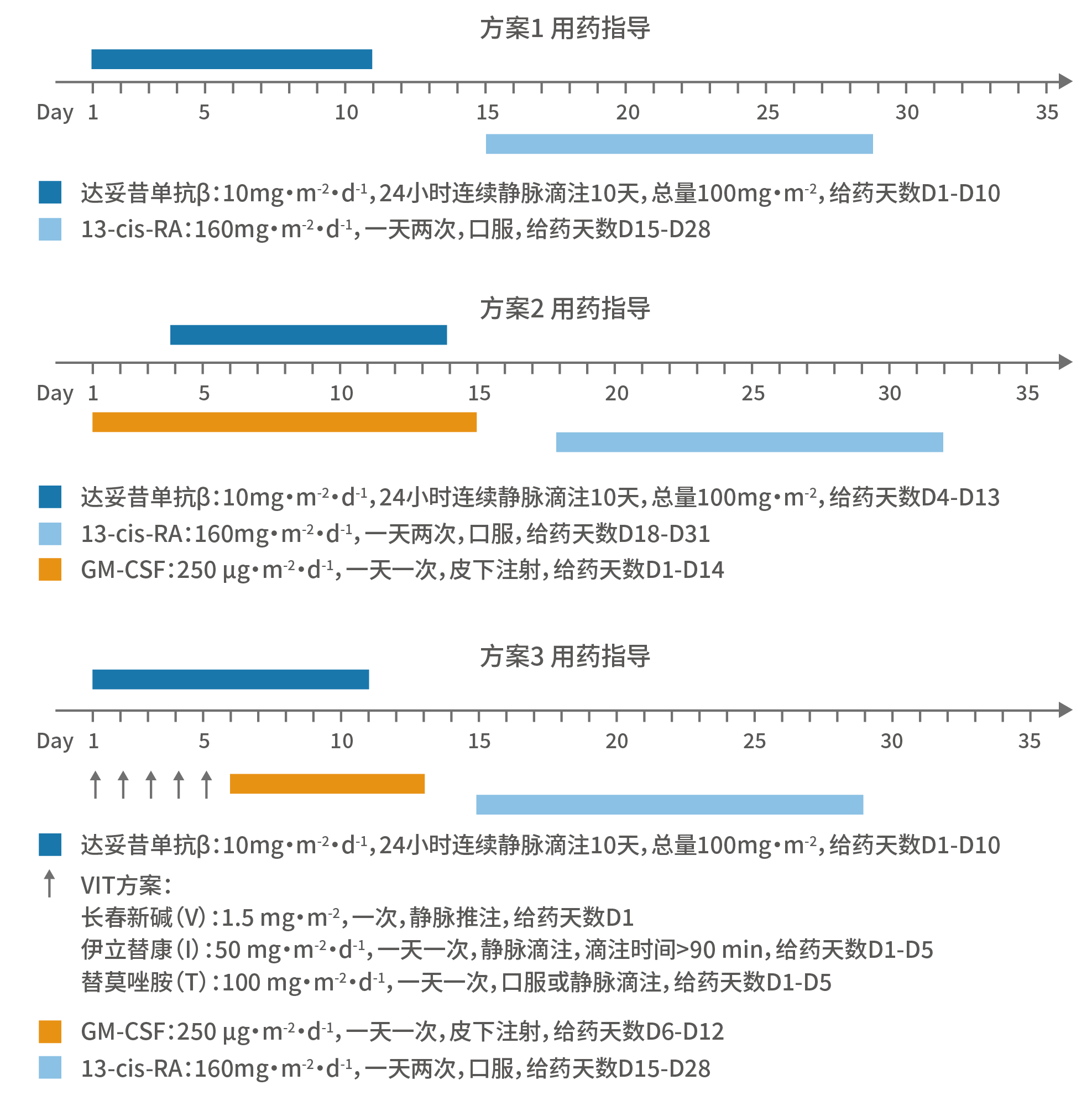
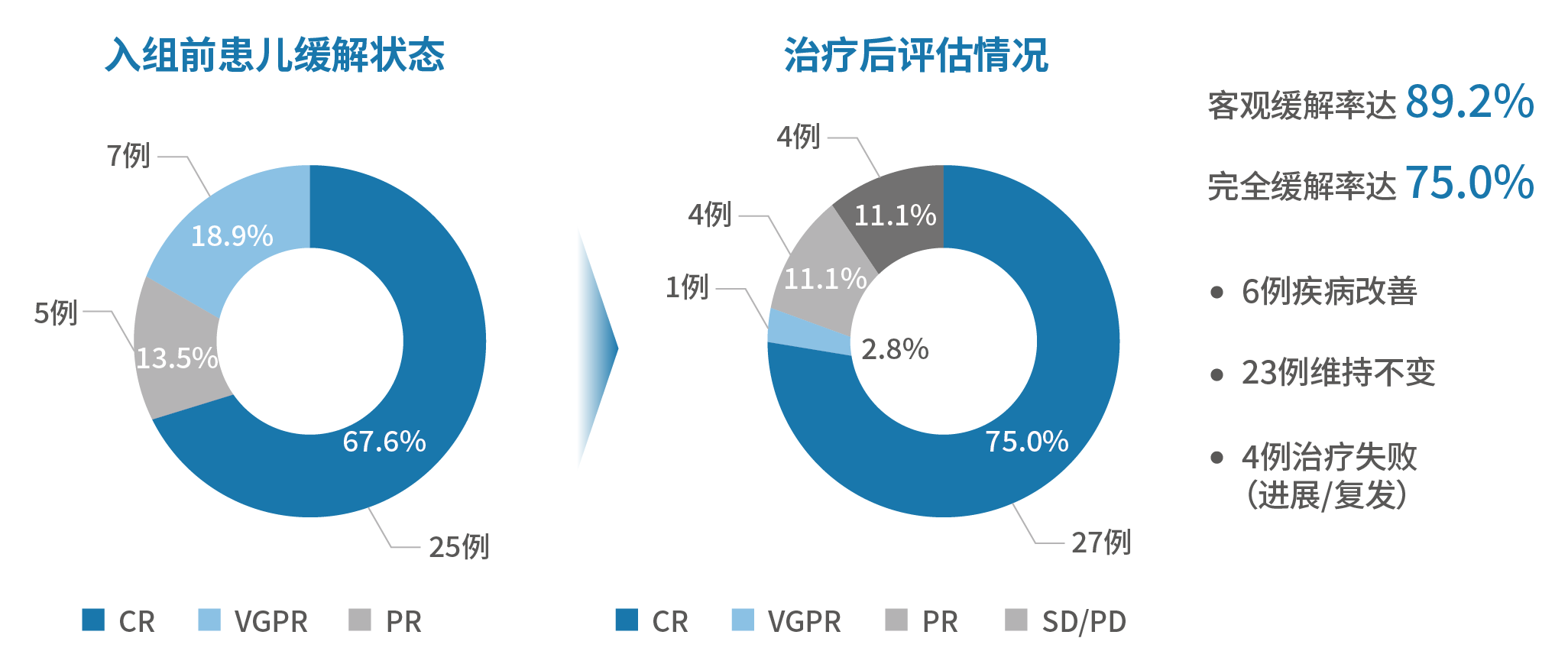
表7. 3种GD2单抗联合化疗针对复发/难治性NB的关键研究汇总部分上述研究的患儿基线水平相对较差,例如复发患者居多,既往接受过免疫治疗;可以说,免疫治疗联合方案有望为更多复发/难治性患儿争取获益。1.Yu AL, et al. Clin Cancer Res. 20212.Ladenstein R, et al. Lancet Oncol. 2018; 19: 1617-29.3.Ladenstein RL et al. Cancers. 2020, 12, 309.4.2019 ASCO:Ladenstein R, et al. J Clin Oncol 37, 2019 (suppl; abstr 10013).5.Mora J, et al. Pediatr Blood Cancer. 2021 Oct;68(10):e29121.6.Mueller I, et al. MABS. 2018; 10(1): 55-61.7. Lode H, et al. Oral Presentation at ASCO 2019.8.Holger Lode, Karoline Ehlert, Stephanie Huber, et al. SIOP 2022 abstract. O147 / #13439.https://clinicaltrials.gov/ct2/show/NCT0274342910.Flaadt T, et al. J Clin Oncol . 2023 Feb 28;JCO2201630.11.Kushner BH, et al. JAMA Oncol. 2018;4:1729–1735.12. DANYELZA® (naxitamab-gqgk) injection, for intravenous use, prescribing information13.2020 SIOP abstract. High-Dose Naxitamab (Humanized-3F8) Plus Stepped-Up Dosing of Granulocyte-Macrophage Colony-Stimulating Factor (GM-CSF) for Resistant Osteomedullary Neuroblastoma: Major Responses and Outpatient Treatment in a Phase II Trial.#86314. 2022 SIOP abstract. NAXITAMAB PIVOTAL CLINICAL TRIAL: INTERIM ANALYSIS REPORT OF SUBGROUP OUTCOMES IN RELAPSED OR REFRACTORY HIGH-RISK NEUROBLASTOMA.15.Naxitamab NDA/BLA Multi-disciplinary Review and Evaluation 2020.3 submited16.Mody R, et al. Lancet Oncol. 2017;18:946–95717.Juliet Gray, et al. 2022 ASCO PEDIATRIC ONCOLOGY 10002.18.Olgun N, et al. Front Oncol. 2022 Dec 23;12:1041443.19.Shakeel Modak, et al. 2022 ASCO PEDIATRIC ONCOLOGY 10028.20.Borregón M, et al. Cancer Chemother Pharmacol. 2022 May;89(5):577-58421.Lode H,et al. ABSTRACT BOOK ANR2023. – POSTER PRESENTATIONS AND RAPID FIRE SESSIONS.P305■ 2022年中国专家团队在《中国转移性肿瘤杂志》中发表了题为“GD2单抗治疗中国高危及复发难治神经母细胞瘤儿童的临床研究”的研究成果,初步评价了达妥昔单抗β治疗中国高危和复发/难治神经母细胞瘤儿童的安全性和有效性,为其在中国上市后的临床研究设计和给药方案的确定提供依据¹。■ 该研究共纳入37例NB患儿(高危26例,复发5例,难治6例),其中25例免疫治疗前评估为CR,5例为VGPR,7例为PR,根据患儿既往的治疗经过及入院前的评估结果选用免疫治疗方案。图6. 不同NB患儿的达妥昔单抗β推荐用药方案
疗效评估显示,ORR达89.2%,CR率达75.0%,6例患儿病情改善,23例维持不变,2例疾病进展,2例复发。图7. “先行先试”研究高危及复发/难治性NB经达妥昔单抗β治疗后缓解情况
SD,疾病稳定;PD,疾病进展
总体来说,国内关于达妥昔单抗β使用的探索,总体的短期疗效佳,长期获益可期。
1.Collaborative Group on GD2 antibody dinutuximab-β in the treatment of neuroblastoma. China J Metastatic Cancer. 2022; 5(1): 14-20.章节小结:
■ 达妥昔单抗在初治高危患者群体具有明确的临床获益循证,目前尚未获国内批准上市。
■ 那西妥单抗在初治高危患儿中仅具有较小样本、单中心、已达到完全缓解患者的循证支持,目前尚未获得一线治疗的适应症批准;而基于客观缓解率和缓解持续时间的短期疗效证据,那西妥单抗获FDA批准用于伴骨/骨髓转移的复发/难治性NB,长期疗效数据仍待进一步随访分析。
■ 达妥昔单抗β循证证据充分,该药在初治高危患儿中具有多项多中心III期对照研究,总体纳入患儿在1000例以上,包括大比例具有可评估病灶的患儿,循证支持力度强,代表性高;在复发难治性患儿研究中,纳入患者范围大,且治疗缓解率和长期生存获益明显,数据完整,因此获批的适应症最为宽泛。
⭐GD2单抗治疗骨或骨髓病灶有用吗?3F8对骨或骨髓的疗效更好吗?
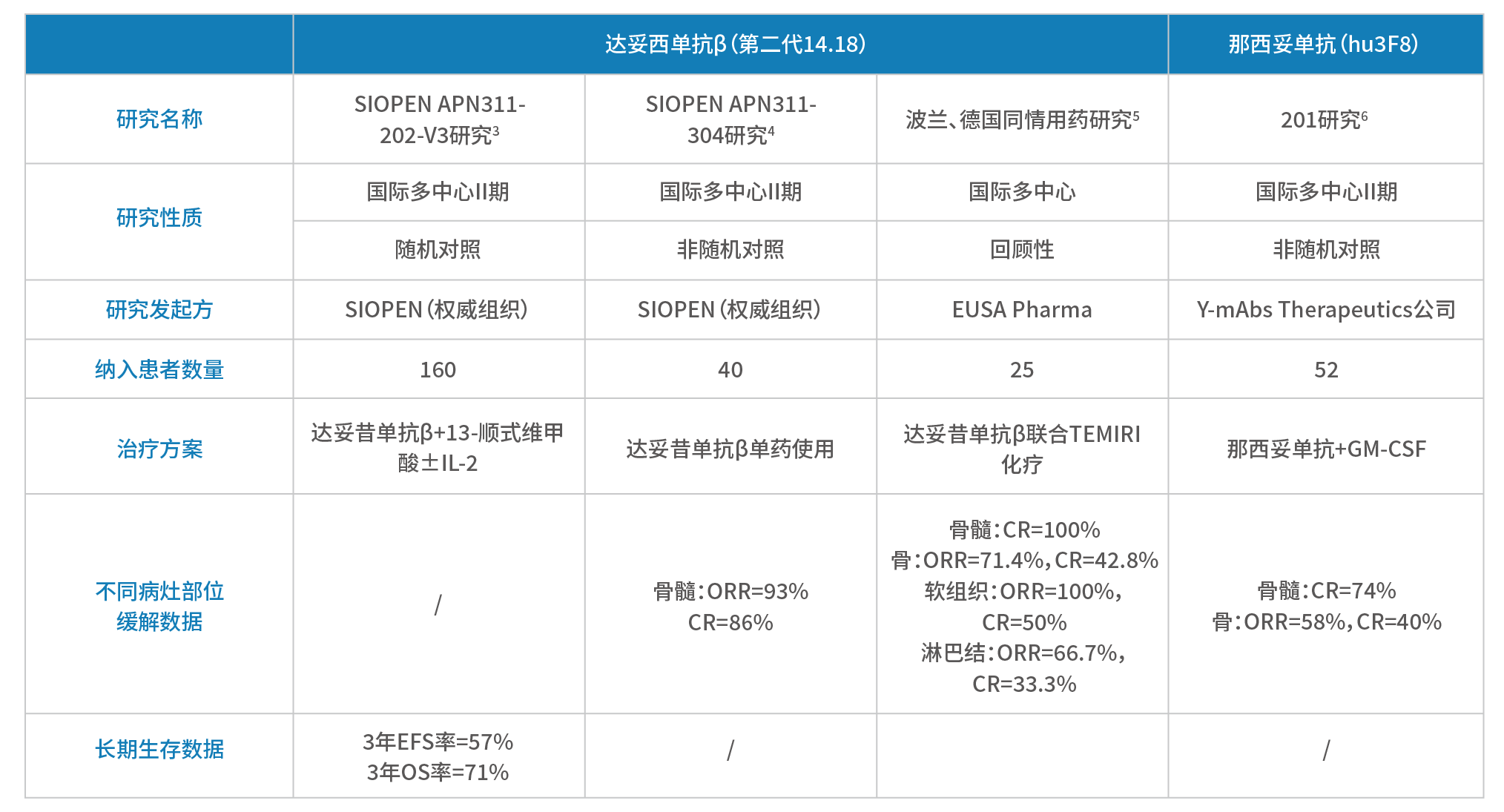
GD2单抗治疗伴骨或骨髓残留病灶的NB疗效确切,是其发挥作用最显著的战场之一。目前国内可及的两种GD2单抗,针对NB的骨或骨髓残留病灶均具有适应症¹,²;疗效数据方面,针对复发/难治性NB的多项临床研究,纳入人群均包含骨或骨髓病灶残留的患者,其中
■ 达妥昔单抗β单药长期输注(不联合13-顺式维甲酸和细胞因子)治疗的研究中,骨髓受累复发/难治性患者中, 93%达客观缓解,86%为完全缓解³;达妥昔单抗β+13-顺式维甲酸治疗复发/难治性患者,3年EFS为57%,3年OS为71%⁴;达妥昔单抗β联合化疗治疗复发/难治性高危患者,对骨骼、骨髓、软组织、淋巴结病灶等不同部位病灶均表现出疗效,其中治疗骨髓转移病灶完全缓解率达100%,治疗骨骼病灶71.4%达客观缓解, 42.8%达完全缓解⁵。
■ 那西妥单抗联合GM-CSF治疗骨髓转移患者,客观缓解及完全缓解率为75%,其中骨转移患者65%达客观缓解,44%达完全缓解⁶,暂无长期生存数据。
表8. 2种GD2单抗治疗NB骨/骨髓病灶的关键研究汇总
TEMIRI化疗方案,伊立替康50 mg/m²/d+替莫唑胺100 mg/m²/d
综上,目前并无任何证据显示那西妥单抗(hu3F8)对治疗骨或骨髓能够获得更优的疗效。
2.DANYELZA Prescribing Information. 20203.Holger Lode, Karoline Ehlert, Stephanie Huber, et al. Single agent activity of the Anti-GD2 antibody dinutuximab beta long-term infusion in high-risk neuroblastoma patients with relapsed and refractory disease. A multicenter phase II trial. SIOP 2022 abstract. O147 / #13434.Lode H, et al. Oral Presentation at ASCO 2019.5.Wieczorek A, et al. ront Oncol. 2023;13:1082771.6.2022 ASCO abstract. Naxitamab (NAX) treatment for refractory/relapsed (R/R) high-risk neuroblastoma (HR-NB): Response data and efficacy in patient (pt) subgroups⭐初治高危阶段,患儿并没有达到完全缓解,做免疫治疗的意义大不大?完全缓解(CR)是免疫治疗前我们希望患儿达到的理想状态,免疫治疗前CR患儿的长期生存情况确实于PR和VGPR(非常好的部分缓解),但即使未达CR,免疫治疗仍有很大获益。基于达妥昔单抗β是国内唯一获得初治高危NB适应症且循证充足的GD2单抗,下文只援引达妥昔单抗β的数据作讨论。以达妥昔单抗β治疗高危患儿的III期研究为例,纳入病例中42%的患儿未达CR,但总体生存获益已在研究中被证实,5年无事件生存率可达57%,与非免疫治疗相比,显著提升了15% ¹。此外,达妥昔单抗β在中国的“先行先试”研究中显示,37例高危及复发/难治性患儿中,6例患儿疾病改善,其中3例从PR转为CR或VGPR,另有23例患儿维持CR²。那么未达CR的患者适合使用哪种治疗方案呢?国外研究显示,不论是达妥昔单抗β单药(即无细胞因子和异维甲酸辅助)、联合异维甲酸,还是联合IT化疗,治疗未达CR的复发/难治性神经母细胞瘤均具有良好治疗反应,并大幅改善患者的长期生存³⁻⁵:■ APN 311-304研究显示,达妥昔单抗β单药长期输注(即无细胞因子和异维甲酸辅助下)治疗未达到CR的复发/难治性患者,伴骨髓受累患者客观缓解率达93%,完全缓解率达86%,3年PFS和OS分别为31.5%和65.5%,能有效杀伤复发/难治性神母病灶,尤其对骨髓微小残留病灶具有强效清除作用。■ APN 311-202 V3研究显示,达妥昔单抗β长期输注联合异维甲酸治疗复发难治性患者(大部分患者未达CR),3年EFS达57%,3年OS达71%,大幅改善患儿生存。■ 一项土耳其研究中,达妥昔单抗β长期输注联合IT化疗治疗未达到CR的复发/难治性患者,ORR为63.2%,CR率为31.6%具体治疗方案的选择,建议根据患者的治疗阶段和实际情况,遵循临床医师的医嘱。1.Ladenstein R, et al. Cancers. 2020, 12, 309.2.Collaborative Group on GD2 antibody dinutuximab-β in the treatment of neuroblastoma. China J Metastatic Cancer. 2022; 5(1): 14-20.3.Holger Lode, Karoline Ehlert, Stephanie Huber, et al. SIOP 2022 abstract. O147 / #13434.Lode H, et al. Oral Presentation at ASCO 2019.5.Olgun N, et al. Front Oncol. 2022 Dec 23;12:1041443.
⭐免疫治疗后复发了,再用GD2单抗还有效吗?
对于本文提及的前述研究所纳入的NB人群中,不乏既往治疗包括GD2单抗免疫治疗的患儿:
■ 达妥昔单抗β长期输注联合TTo化疗,42%既往使用过GD2单抗(100%具有可评估病灶),研究显示相较于非免疫治疗组,免疫治疗组患儿客观缓解率提升近一倍,1年PFS提升一倍以上,达57%¹。
■ 达妥昔单抗β联合TEMIRI化疗方案,既往接受过免疫治疗的14例患者,有4例CR,6例PR,最佳ORR为71%²。
■ 达妥昔单抗+IT化疗+GM-CSF(超适应症使用)也有类似的数据,35%的患儿既往使用过GD2单抗(59%具有可评估病灶),1年PFS也达到了67.9%,1年OS为84.9%³。
■ 那西妥单抗+IT化疗+GM-CSF(HITS方案)同样纳入了部分接受过既往接受免疫治疗的复发/难治性患者(82/90为复发患者),1年PFS为37.0%,1年OS为55.0%⁴。
因此,即使之前已使用过GD2单抗,再次接受免疫治疗仍然具有临床获益。
1.Juliet Gray, et al. 2022 ASCO PEDIATRIC ONCOLOGY 10002.2.Wieczorek A, et al. Frontiers in Oncology, 03 February 2023, 13: 366.3.Mody R, et al. J Clin. Oncol. 2020;38:2160–21694.Shakeel Modak, et al. 2022 ASCO PEDIATRIC ONCOLOGY 10028.⭐免疫治疗可能出现哪些不良反应?临床上一般怎样应对?
国外数据显示,神经性疼痛和过敏是GD2单抗的两大主要不良反应。在临床上,除了密切监测患儿的症状和体征外,对于不同免疫治疗方案也有相应的不良反应处理措施。
疼痛:
■ 达妥昔单抗β:以国内的专家共识所述为例,针对治疗期间可能引起的疼痛,患儿需提前3天口服加巴喷丁,在GD2单抗输注前2小时及输注期间静脉给予吗啡镇痛,并且按需给予非阿片类镇痛剂(口服对乙酰氨基酚或布洛芬)¹。长期输注方案从第3周期开始基本无需使用吗啡²。
■ 那西妥单抗:部分患儿接受标准镇痛治疗(即吗啡、加吧喷丁及其他非阿片类镇痛剂)后,症状仍未得到良好控制,例如Sant Joan de Déu巴塞罗那医院的115例患儿接受那西妥单抗治疗的过程中,21例需要额外使用氯胺酮+咪达唑仑+利多卡因+阿托品联合方案,其中前三类均为麻醉用药,阿托品用于解除吗啡过量导致的呼吸抑制³。
此外,临床运用于麻醉的药品还包括盐酸瑞芬太尼,该药物为超短时、强效镇痛剂,起效迅速,适用于全身麻醉及ICU镇痛镇静。
总结来说,达妥昔单抗β治疗期间引起的疼痛,绝大多数通过前2周期的吗啡可得到良好控制,无需借助麻醉药品;部分患者在使用那西妥单抗时,需使用联合麻醉用药,具有额外的潜在风险,因此必须由麻醉师或有经验的急诊医师使用,并进行全程的严密监护。
氯胺酮:全身麻醉用药,对于多发伤和体能状态较差的患者需要减少剂量,常见症状包括血液、心率增加,暂时性心动过速、喉部痉挛等。
咪达唑仑:说明书警示可引起呼吸抑制和呼吸暂停;与阿片类药物联用时可导致深度镇静、呼吸抑制、昏迷和死亡,应检测患儿的呼吸抑制及镇静情况。
盐酸瑞芬太尼:可引起呼吸抑制和窒息,制剂中的甘氨酸可抑制脊髓运动神经元和中间神经元的兴奋性,引起一过性麻痹;因起效迅速的药代动力特点,不推荐单次静脉推注,只能采用静脉持续输入法给药,2岁以下儿童禁用。
■ 过敏处理方面,GD2单抗输注也需提前使用静脉(苯海拉明、氯苯那敏)及口服抗组胺药物(例如苯海拉明、西替利嗪、氯雷他定)¹。此外,那西妥单抗推荐第一周期前输注糖皮质激素⁴(激素的免疫抑制作用可能会影响单抗的疗效)。■ 截至目前,由于较为严重的输注反应和神经毒性,达妥昔单抗(第一代14.18)被FDA予以黑框警告,而那西妥单抗则同时被FDA和NMPA予以黑框警告提示风险⁴,⁵,⁶。因此,临床医生对GD2单抗治疗所产生的不良反应管理格外重视。■ 属于免疫治疗中非常常见的症状,在排除感染、粒细胞减少的情况下,通常认为发热是机体发挥免疫反应的表现之一,通过测量患儿体内的细胞因子水平也可间接证明这一点,因此在临床中,需进行针对性病原体检查,并按需予以退热处理(如风扇、冷风、对乙酰氨基酚)⁷,不将其作为危害较大的不良反应。■ 另一些不良反应的发生比较罕见,包括毛细血管渗漏综合征(CLS)、眼部症状(瞳孔散大或虹膜麻痹)、其他中枢或外周神经毒性等,患儿出现浮肿、视力异常、感觉麻痹等疑似症状时须立即告知临床医生⁴,⁵,⁸。综合不同GD2单抗的临床数据显示,随着治疗周期的延长,各类不良事件的发生率总体呈下降趋势,许多副反应的出现集中在前几个周期。注:黑框警告是对某种药物严重或可能致命的风险的总结,使用加黑加粗的边框加以突出,并位于药品说明书顶端的醒目位置。该警告形式主要基于FDA收到的不良事件评估报告制定,是FDA对处方提出的最为严重的警告,旨在警示该药物可能产生的严重或危及生命的副作用。
参考文献:
1.GD2单抗治疗神经母细胞瘤临床应用协作组. 临床儿科杂志, 2022, 40(1): 14-20.
2.Holger Lode, Karoline Ehlert, Stephanie Huber, et al. SIOP 2022 abstract. O147 / #1343
3.Mora J. Presented at The International Society of Paediatric Oncology Virtual Congress. 14–17 October, 2020. Poster 0400;
4.DANYELZA Prescribing Information. 2020.
5.Unituxin Prescribing Information. 2015.
6.那西妥单抗注射液说明书
7.Giuseppe Barone, et al. Paediatr Drugs . 2021 Nov;23(6):537-548.
8.达妥昔单抗β说明书
首先我们要先明确移植的概念,造血干细胞移植和免疫治疗是两类截然不同的治疗方法,它们在作用机制、适用治疗阶段和操作步骤上都具有本质的区别,但两者运用范围具有一些共性,即均可消除微小残留病灶,减少肿瘤复发风险。造血干细胞移植分为大剂量清髓化疗和干细胞输注两个步骤,根据干细胞类型,移植可分为自体和异基因移植。如前文所提及的,自体干细胞移植是高危NB规范治疗巩固阶段的主力军,如果由于自体采干不允许的患儿则可尝试接受异基因移植。国内外多项研究显示,移植对高危患儿的长期生存具有显著的改善作用:■ 国内一项回顾性分析纳入北京儿童医院的203例初治伴骨髓转移高危患儿(2007.1~2016.12),结果显示移植组5年总生存率显著优于未移植组(44.3% 比35.5%,p<0.05);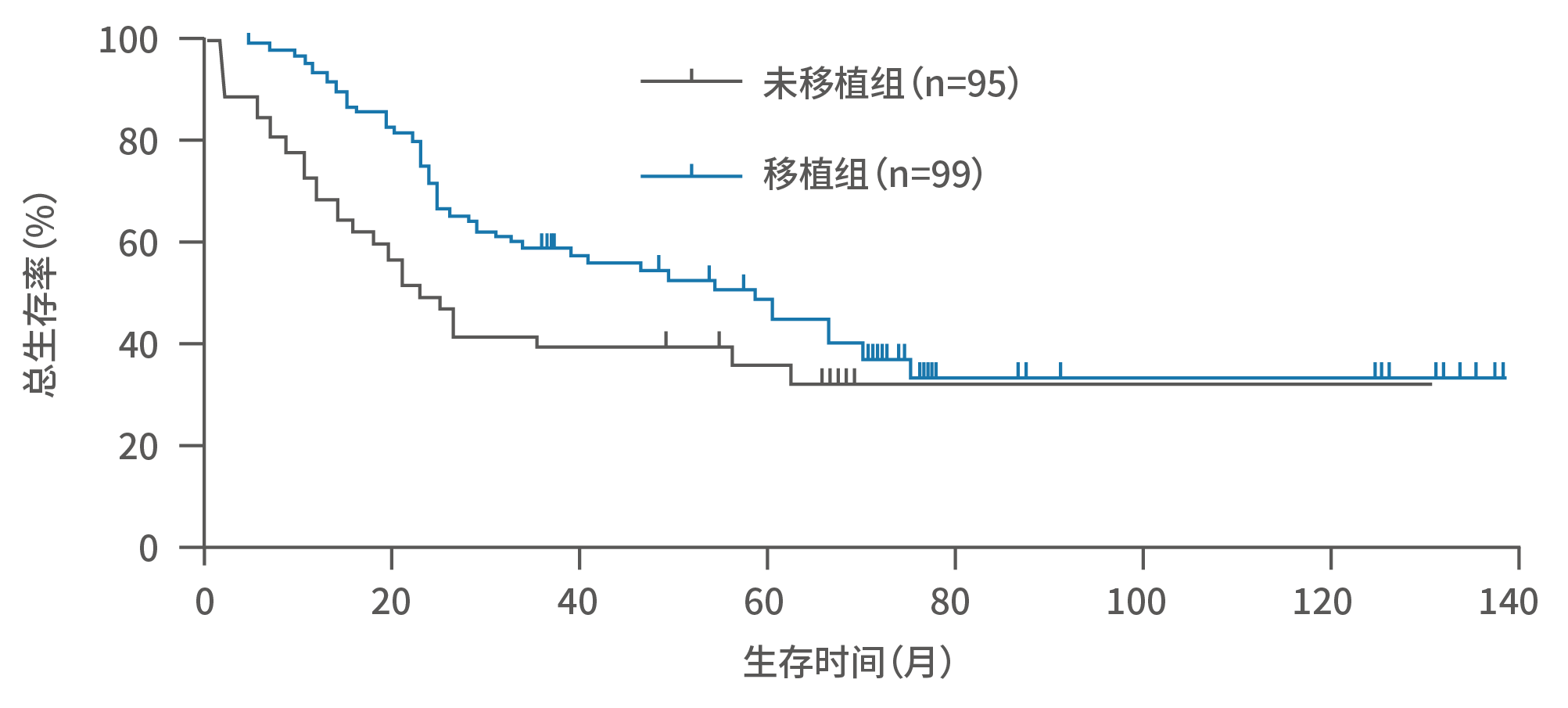
图9.北京儿童医院初治伴骨髓转移高危NB研究中移植/未移植组的生存曲线
■ GPOH(德国儿科肿瘤学和血液学协会)长期随访数据显示,移植显著提升高危NB患儿的10年无事件生存率21%,提升10年总生存率18%。
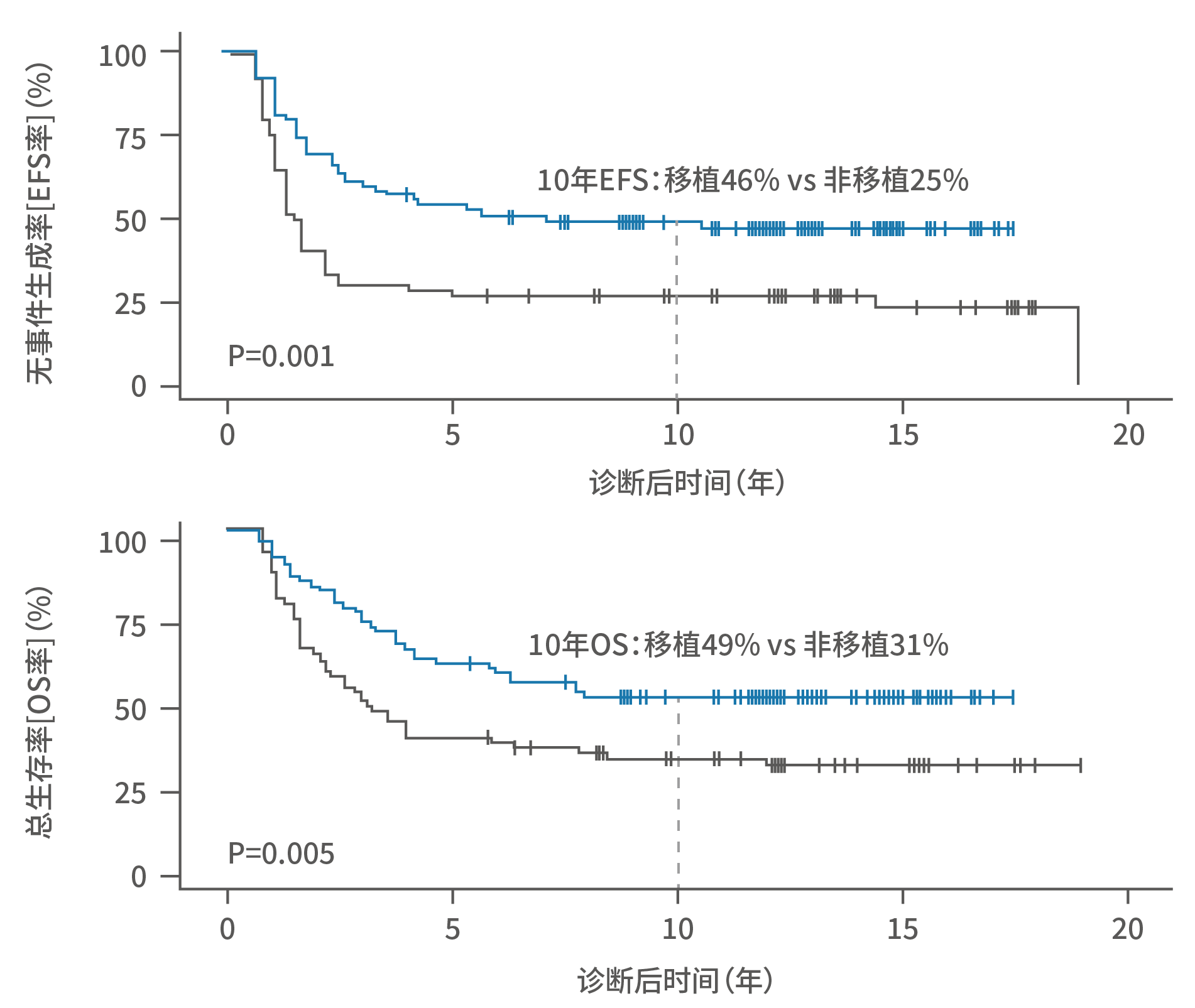
图10. GPOH长期随访研究中移植/非移植组高危NB生存曲线
■ 根据治疗方案,移植还可分为单次移植和串联移植(两次移植),其中串联移植包括两次化疗和两次干细胞输注。COG研究显示, 高危NB患儿接受串联移植,3年无事件生存率可达61.6%。
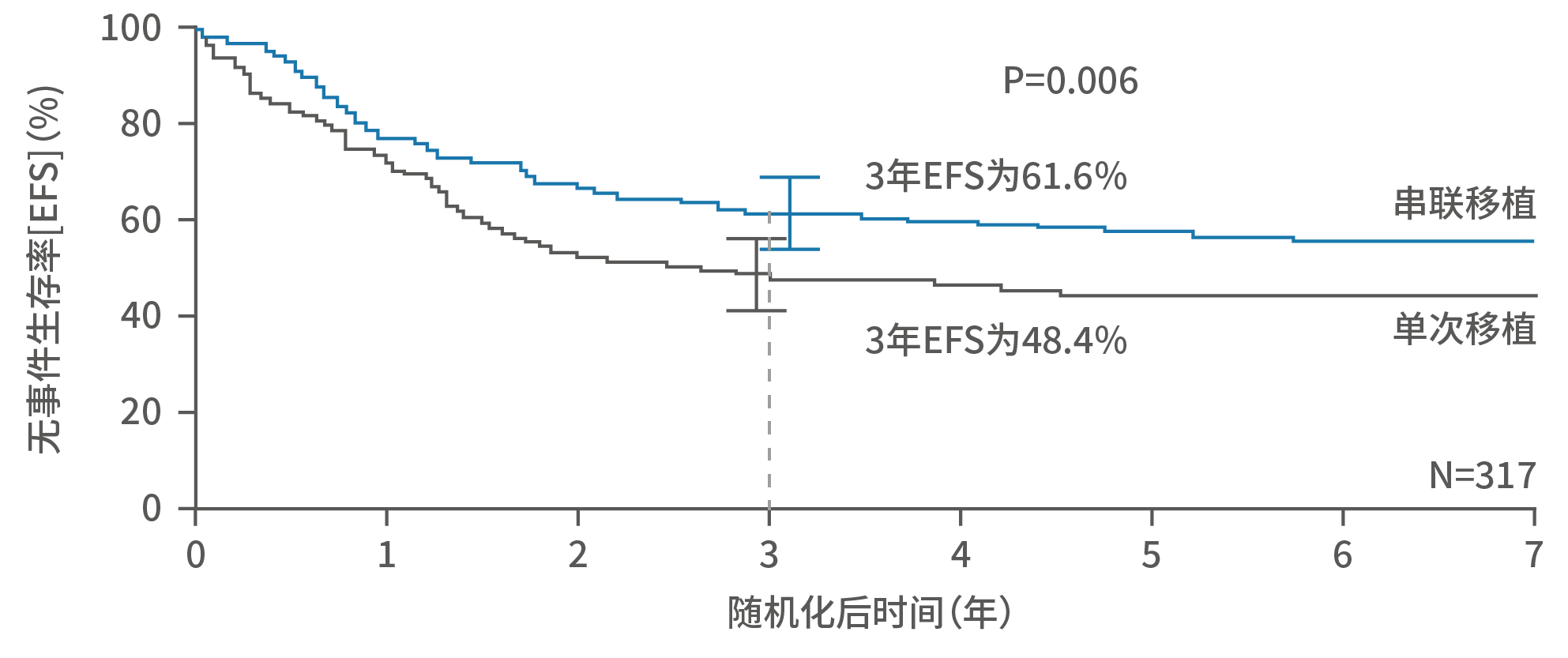
图11. COG研究中单次移植/串联移植组高危NB生存曲线
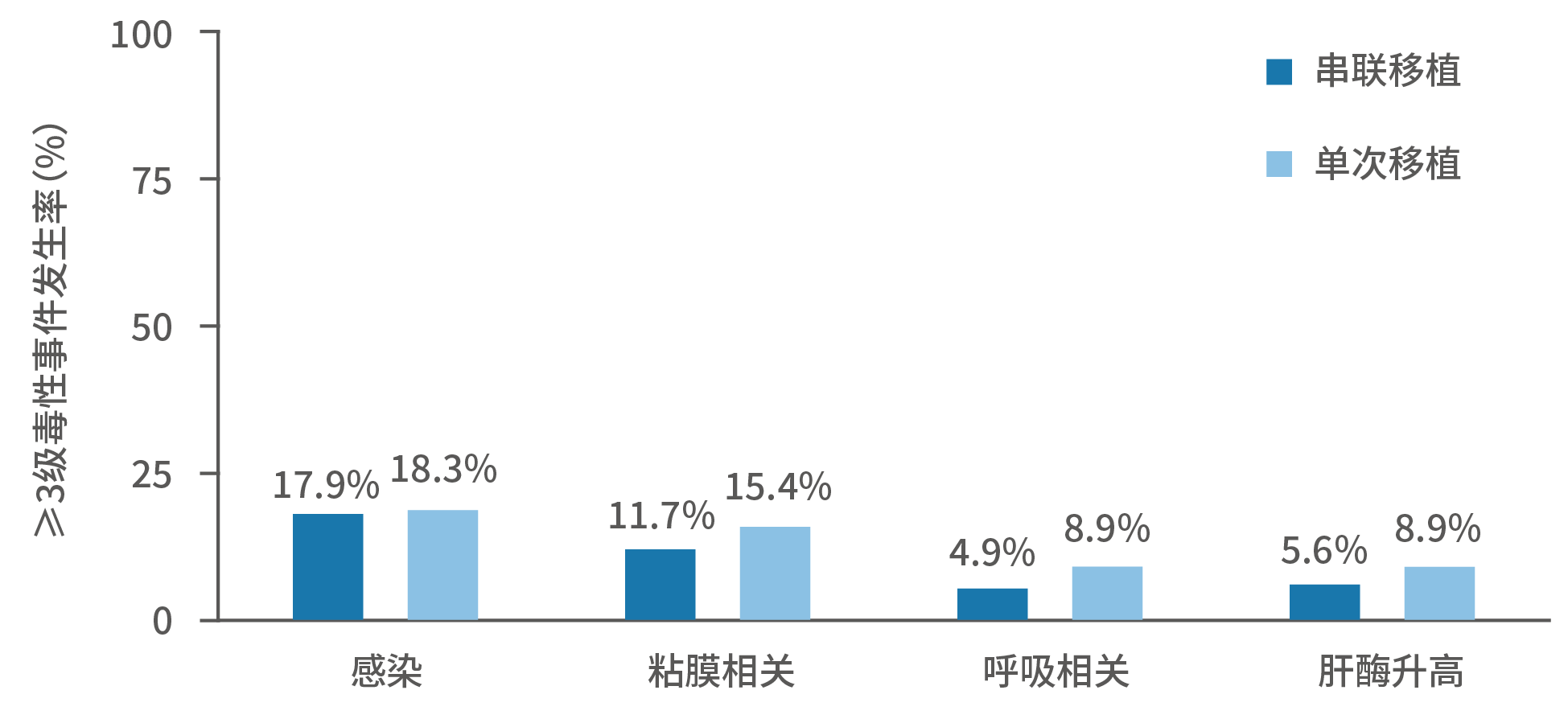
在疗效明确的条件下,移植的安全性也是患儿家长所集中关注的。干细胞移植需要大剂量化疗,在强力杀伤肿瘤的同时,对患儿的免疫系统也存在巨大打击,因此需要随后进行干细胞输注以重建免疫系统,整个过程也离不开移植仓内的严格管理和监测。数据显示,绝大多数患儿的粒细胞水平能在10余天恢复,安全性也总体可控。具体来说,不论是串联移植还是单次移植,≥3级的不良事件发生率都处于较低水平,且与强化化疗相比,干细胞移植未增加住院时间(平均住院时间:移植组47天 vs 强化化疗组45天)。图12. COG研究中高危NB患儿接受单次/串联移植≥3级不良反应发生情况
鉴于移植的晚期效应需要长时间监测,故目前开展的相关研究较为局限。据一项纳入145名高危NB幸存者的法国单中心、长期随访研究显示,移植后20年患者的总生存率达89%。但在中位随访15年期间,部分患者出现牙齿发育不良、生长迟缓、严重听力损伤等晚期效应。同时,需要警醒的是,有7.6%(11/145)的患者在移植后出现了第二恶性肿瘤,因而移植后患者必须接受规范化的长期随访和疾病监测以实现早发现、早处理的目的。
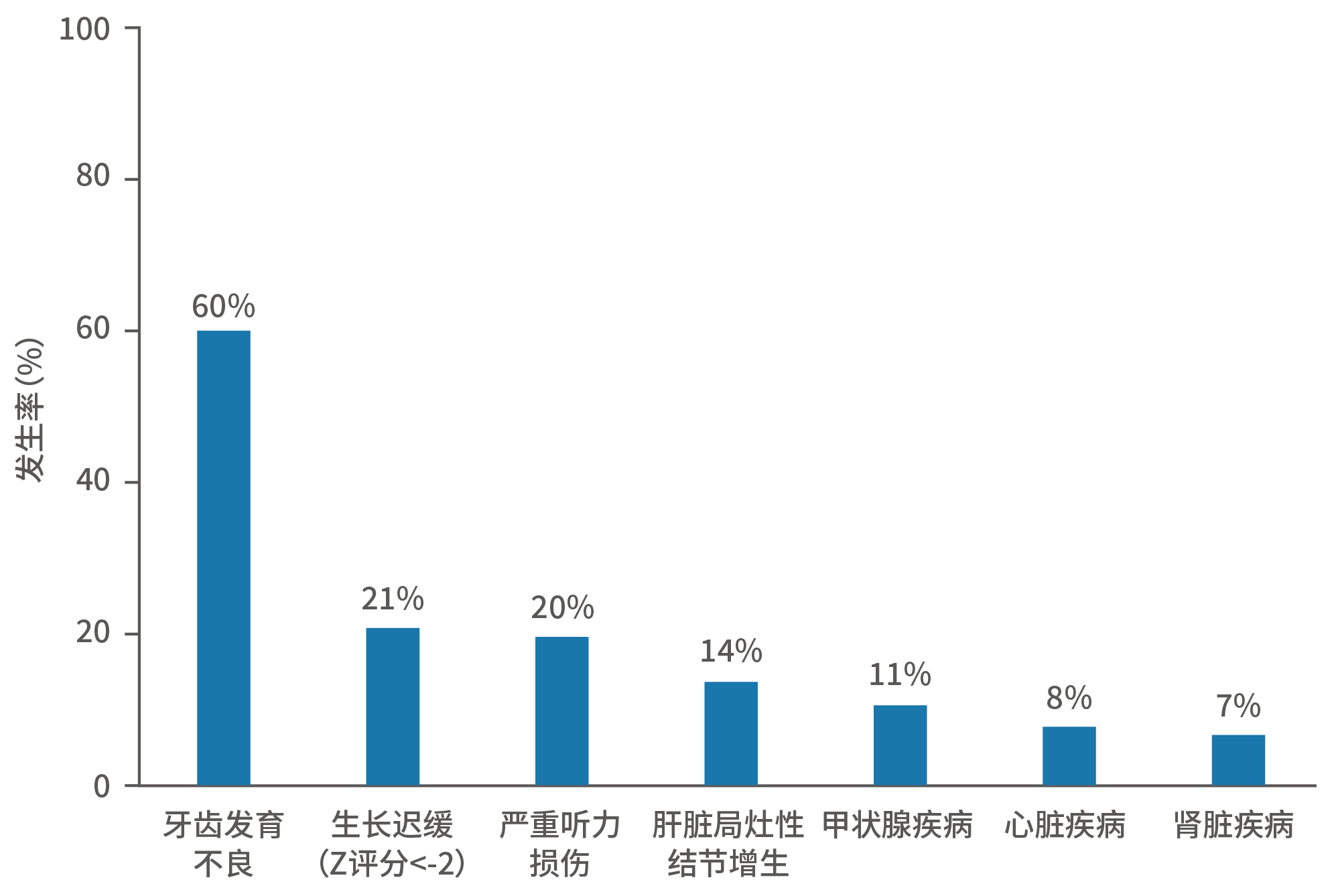
图13.高危NB患者的晚期效应发生率
Z评分是一种儿童营养状况评价指标:Z评分<-2为过低,-2~2为正常,>2为过高
尽管移植有潜在的晚期效应,但鉴于移植显著的生存获益,仍然不建议家长因顾虑治疗对患儿的晚期影响而放弃接受移植。
参考文献:
1.范洪君等, 中华儿科杂志, 2019, 57(11): 863-869.
2.Berthold F, et al. br j cancer. 2018 Aug;119(3):282-290.
3.Julie R, et al. JAMA 2019;322(8):746-755.
4.Matthay KK, et al. N Engl J Med. 1999 Oct 14;341(16):1165-73.
5.Haghiri S, et al. Bone Marrow Transplant. 2021 Aug;56(8):1984-1997.
根据中国、北美和欧洲权威指南推荐的最新高危NB标准方案,在囊括了GD2单抗后,自体造血干细胞移植仍然是巩固治疗的关键手段,甚至美国COG推荐串联移植的效果优于单次移植¹⁻³。由此可见,目前全球权威学术观点认为,免疫治疗不是移植的替代疗法。由于高危神母肿瘤负荷高,病情凶险,标准治疗中任何一个步骤都是必要的。省略步骤,残余肿瘤负荷清除不彻底,便可能出现额外的复发风险。目前,有了免疫治疗就可以不接受自体干细胞移植的观点并没有足够的循证医学证据予以支持。从循证数据来看,SIOPEN Asia 2022会议中香港儿童血液及肿瘤科学会治疗4期NB患儿的经验显示,移植+GD2单抗组的总生存率大于单纯移植组,因此对于高危NB患儿,GD2单抗能够在移植的显著获益基础上,更进一步提升患儿的生存获益⁴。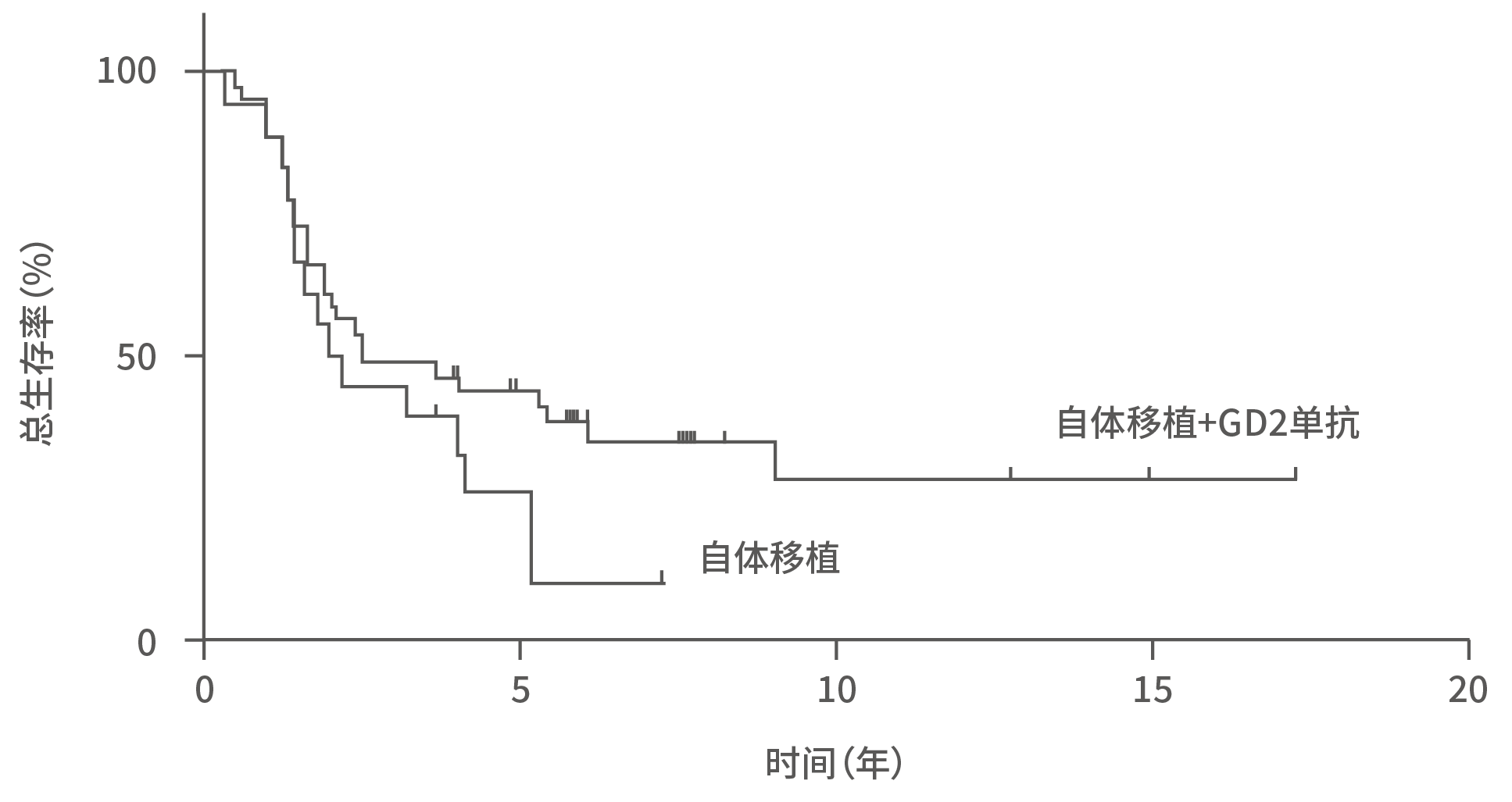
图14. 香港儿童血液及肿瘤科学会治疗4期NB患儿移植±GD2单抗治疗
复发/难治性患儿的移植数据相对较少,但也有文献显示,与单纯异体移植相比,异体移植后接受GD2单抗治疗的复发难治患儿生存更优⁵,进一步说明两种治疗手段并不冲突,依次运用是相辅相成的。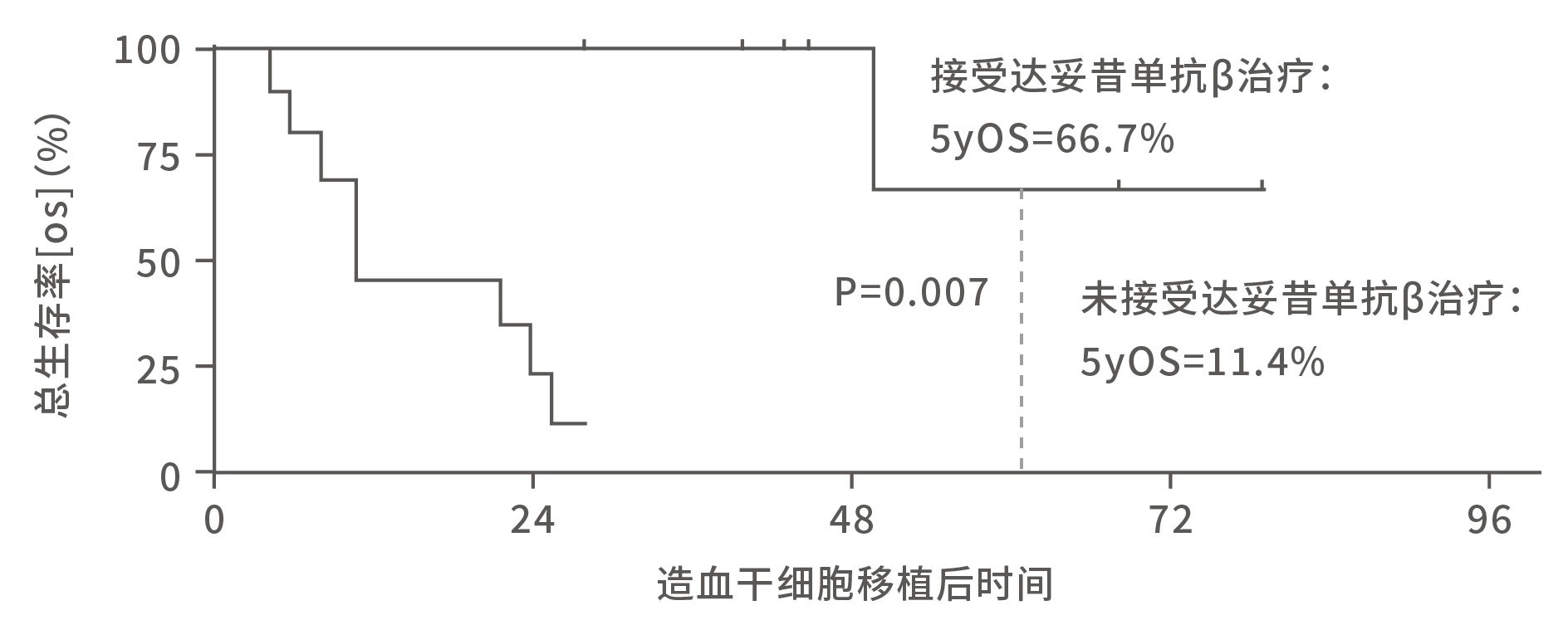
图14. 复发/难治性患儿移植后接受/未接受达妥昔单抗β治疗总生存率
参考文献:
1.Ladenstein R, et al. Lancet Oncol. 2017 Apr;18(4):500-514.
2.ClinicalTrials.gov.NCT00567567.
3.中国抗癌协会小儿肿瘤专业委员会等. 中华小儿外科杂志,2022,43(7):588-598.
4.https://siopasia2022.sciconf.cn/
5.Wawrzyniak-Dzierżek E, et al. Biol Blood Marrow Transplant . 2019 Sep;25(9):1792-1797.
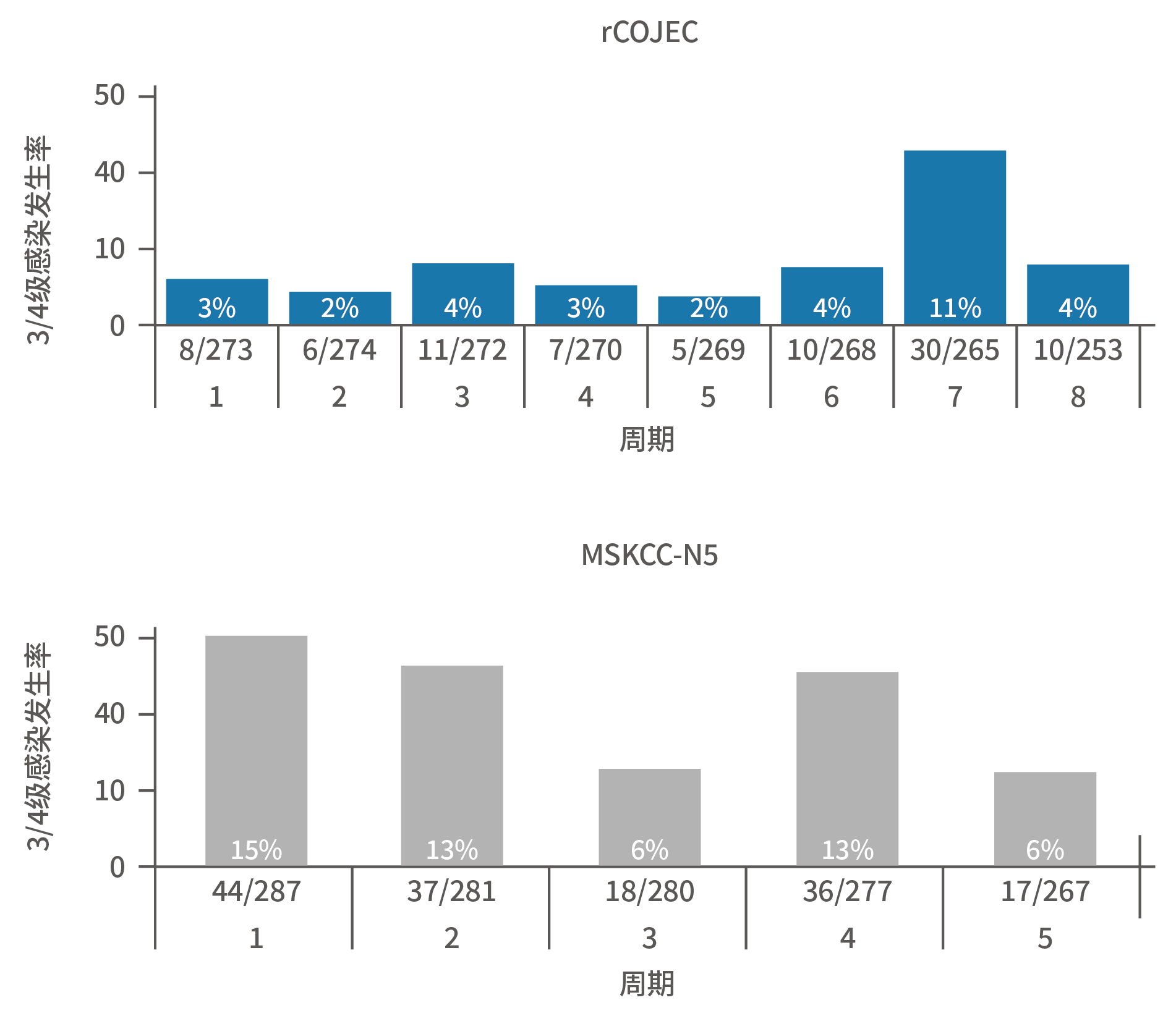
这是一个较常见的误解。这个误解往往指的是“3F8可以治疗初治高危患者,并且不需要接受移植”。首先,那西妥单抗(hu3F8)不可用于初治高危NB患者的巩固治疗,由于缺乏证据,没有任何国家批准该适应症。根据全球各国权威指南,初治高危NB的标准治疗方案是先接受干细胞移植,再使用达妥昔单抗或达妥昔单抗β治疗³⁻⁵。对于每个初治的患者来说,是否合适接受移植,需要遵循临床医师的医嘱,而不是盲目地追求减少治疗步骤。如前述,目前没有任何证据能够充分证明GD2单抗可以代替移植。对于复发/难治性NB患儿,无论使用或不使用何种GD2单抗,都没有既往需使用移植的要求¹,²。因此,关于初治高危NB患者的标准治疗,以及移植的概念,切不可与复发/难治性NB的治疗互相混淆。为何会存在这个误解?在那西妥单抗目前仅有的初治高危NB临床研究中,纳入了部分未经过移植的患儿⁶。但是,从整个研究治疗方案来看,使用那西妥单抗的患儿,在诱导阶段所接受的纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center,MSKCC)方案具有多药叠加的特点,实际上意味着通过更大的化疗强度,以达到类似移植的清髓治疗的效果⁷,仅仅是省略了自体干细胞回输的步骤。图15. 快速COJEC与MSKCC诱导阶段的治疗方案数据显示相较于达妥昔单抗β规范治疗前的快速COJEC治疗组,那西妥单抗所对应的MSKCC组的患儿3-4级不良事件发生率更高,包括血液学毒性和非血液学毒性(感染和胃肠道副反应)⁸,这也间接显示MSKCC化疗方案强度更大。
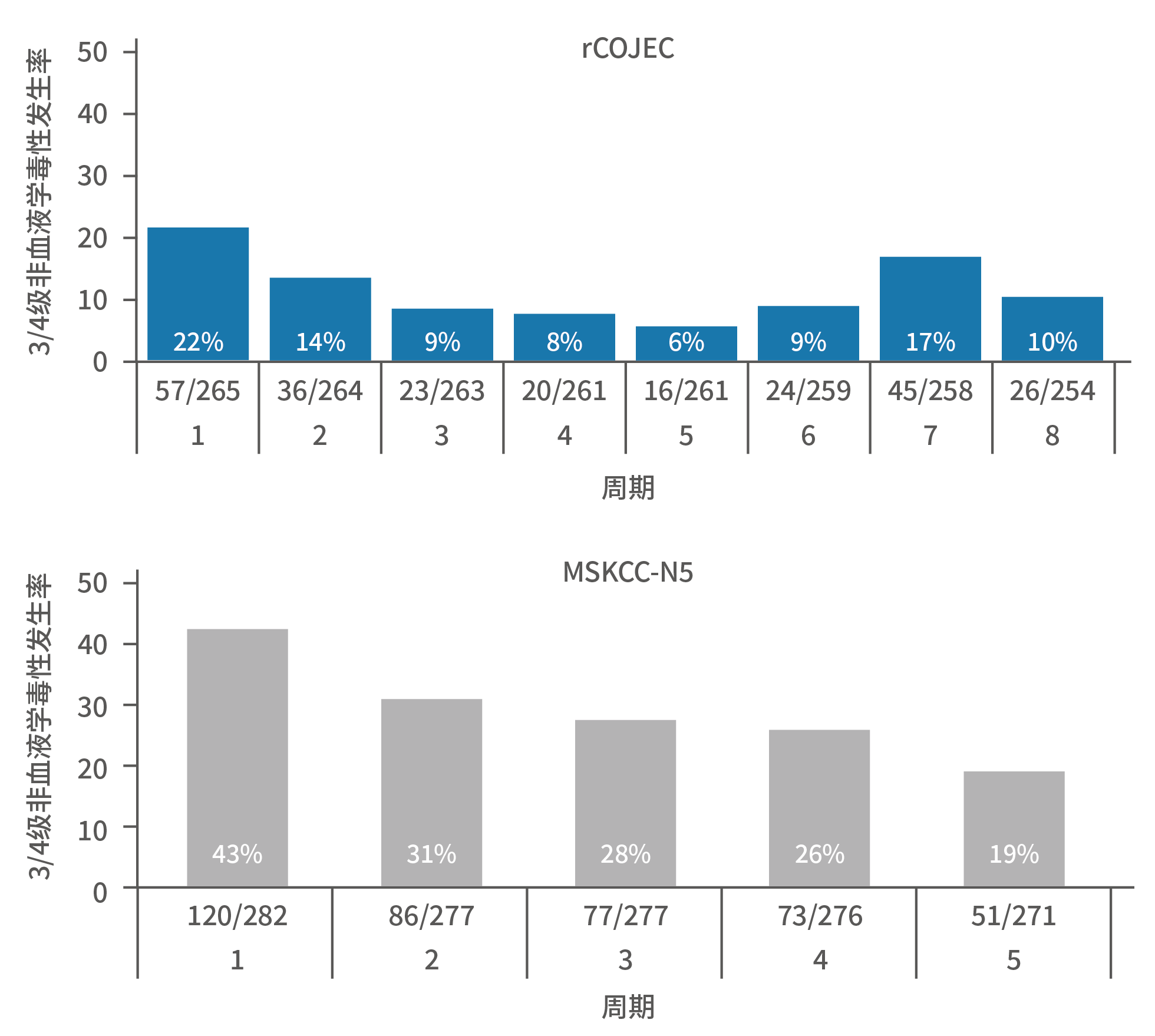
图16. 两类诱导化疗方案中3-4级不良反应发生情况图17.两类诱导化疗方案中3/4级感染发生率
综上,对于初治高危NB,仍推荐经过移植/大剂量清髓治疗,随后进行达妥昔单抗或达妥昔单抗β免疫治疗。对个体而言,移植与否需要根据具体情况,遵循临床医师的医嘱。参考文献:
1.DANYELZA Prescribing Information. 2020.
2.达妥昔单抗β说明书
3.Ladenstein R, et al. Lancet Oncol. 2017 Apr;18(4):500-514.
4.ClinicalTrials.gov.NCT00567567.
5.中国抗癌协会小儿肿瘤专业委员会等. 中华小儿外科杂志,2022,43(7):588-598.
6.Mora J, et al. Pediatr Blood Cancer. 2021 Oct;68(10):e29121.
7.Park JR, et al. J Clin Oncol. 2011 Nov 20;29(33):4351-7.
8.Garaventa A, et al. J Clin Oncol. 2021 Aug 10;39(23):2552-2563.
高危NB患者需要抓住初治机会,通过完整、规范的治疗和严格的全程管理,包括传统的放化疗、手术、干细胞移植以及目前逐渐可及的免疫治疗新药,对于综合治疗中的每个手段都不可或缺。
近年来,GD2单抗给国内NB治疗注入新的活力。希望本文为更多临床医生和患者提供参考,为患者们创造更多治愈的机会。对于患者而言,我们始终建议尊重和相信科学证据,尽可能避免踏入误区。同时,我们也期待未来有更多证据,进一步优化免疫治疗在高危神母治疗中的作用,不断提高患者的生存获益。
为尽可能带来客观详尽的科学信息,本综述为独立科学评估报告,所引用数据均为公开发表,拒绝一切商业合作。