高危神经母细胞瘤的治疗需要综合多种手段,包括诱导治疗、巩固治疗和维持治疗 1 。 GD2在神经母细胞瘤中100%特异性表达,而在其他正常组织中限制性表达,是神经母细胞瘤免疫治疗的理想靶点3 。GD2单抗作为近年来治疗高危神经母细胞瘤的重要进展,已被引入维持治疗阶段,显著提高了患者的5年无事件生存率(EFS) 2 。 本文将介绍一例经过诱导及巩固治疗达到完全缓解(CR)后,继续接受GD2单抗(达妥昔单抗β)免疫维持治疗的M期初治高危神经母细胞瘤病例。
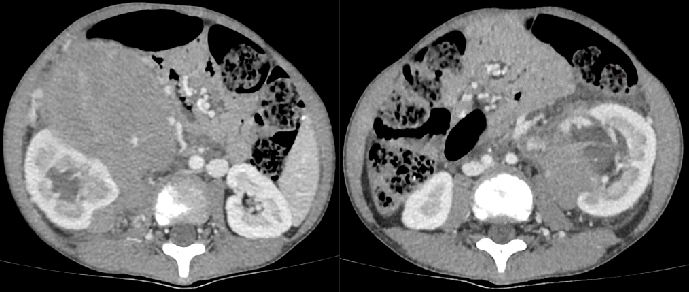
患儿,男性,现年4岁7个月,既往身体健康状况良好。 首次因发热8天伴腹痛3天于2021年7月31日入院。 患儿无明显诱因下出现发热,最高体温达39°C,在当地诊所接受口服小儿豉翘清热颗粒治疗后,体温虽有短暂下降但反复升高,每日高热3~4次,需口服布洛芬方能恢复正常体温。 鉴于病情持续未见好转,患儿被转诊至当地某中心医院进行进一步检查,初步考虑可能患有左肾上腺神经母细胞瘤。 为寻求更专业的诊治,患儿随后转至我院。 腹部检查发现,患儿腹部微隆,上腹部触及10x10cm大小包块,质硬,边界尚清,活动度差。 PET/CT检查显示左肾上极稍低密度肿块,伴异常放射性浓聚,考虑恶性肿瘤,尤其是肾母细胞瘤。 腹部彩超及CT复查后,倾向于左肾上腺神经母细胞瘤诊断(如图1,全腹部CT平扫+增强结果)(如图1所示)。
实验室检查中,神经元特异性烯醇化酶( NSE)水平显著升高,超过370ng/ml。骨髓细胞学检查提示瘤细胞可能骨髓转移,免疫表型分析显示CD45-CD56+细胞占核细胞59.81%,同时表达GD2、CD9、CD81,符合神经母细胞瘤细胞特征。FISH检测发现N-MYC基因扩增,11q23基因未缺失。DNA倍体检测为二倍体,染色体核型分析显示存在染色体畸变的复合核型。经穿刺活检,病理诊断为差分化型神经母细胞瘤,伴坏死、钙化。综合各项检查结果,最终确诊为神经母细胞瘤M期,高危组 。 FISH检测:荧光原位杂交技术(Fluorescence in situ hybridization, FISH)是根据已知微生物不同分类级别上种群特异的DNA序列,以利用荧光标记的特异寡聚核苷酸片段作为探针,与环境基因组中DNA分子杂交,检测该特异微生物种群的存在与丰度。
CTX:环磷酰胺;TOPO:拓扑替康;CDDP:顺铂;VP16:依托泊苷;DOXO:多柔比星;VCR:长春新碱;CAV:环磷酰胺、多柔比星联用长春新碱;CVP:环磷酰胺、长春新碱联用泼尼松
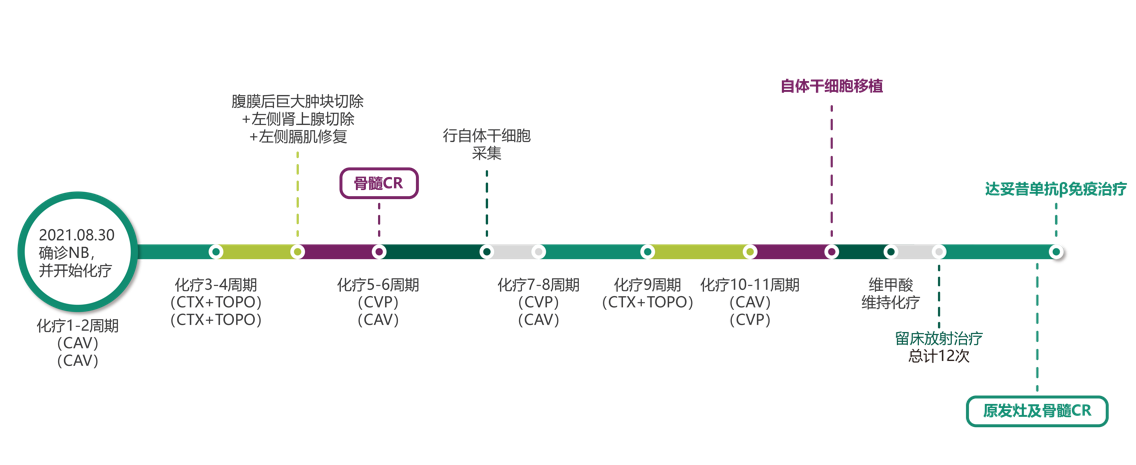
自 2021年8月30日起,该患儿开启了为期11个周期的化疗之旅。 在历经前四个化疗周期的精心治疗后,医生决定进行手术干预,成功切除了腹膜后的巨大肿块、左侧肾上腺,并修补了左侧膈肌。 手术之后,患儿继续接受化疗。 至第5、6周期化疗结束时,经过严谨的评估,确认患儿的骨髓已达到完全缓解(CR)状态。 基于此积极的治疗效果,医生随后为患儿进行了两次自体干细胞采集,并继续实施了5个周期的化疗方案 (如图 2 所示)。
进入巩固治疗阶段,患儿于 2022年6月28日顺利接受了自体干细胞移植手术。 此后,为巩固疗效,患儿又接受了维甲酸维持化疗,并完成了12次的瘤床放疗。 经过这一系列的治疗和再次评估,确认患儿的原发灶以及骨髓病灶均已达到完全缓解状态(CR),治疗效果显著 (如图 2 所示)。
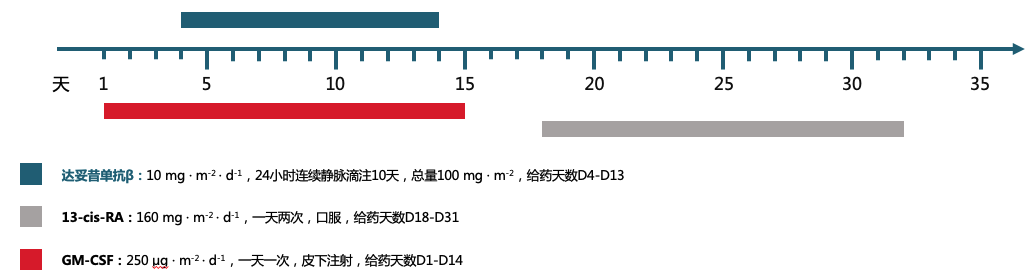
在完成诱导和巩固治疗后,根据免疫治疗前的全面评估结果,该患儿被纳入了达妥昔单抗 β 的临床专家共识推荐方案二进行治疗。 该方案结合了达妥昔单抗β、粒细胞-巨噬细胞集落刺激因子(GM-CSF)以及13-顺式维甲酸(13-cis-RA)的联合治疗(治疗方案详见图3)。 每个治疗周期持续35天,患儿共完成了5个周期的治疗。 截至目前,该患儿已圆满完成了全部5 个周期的达妥昔单抗β免疫治疗,治疗进程顺利,为患儿的康复之路奠定了坚实的基础。
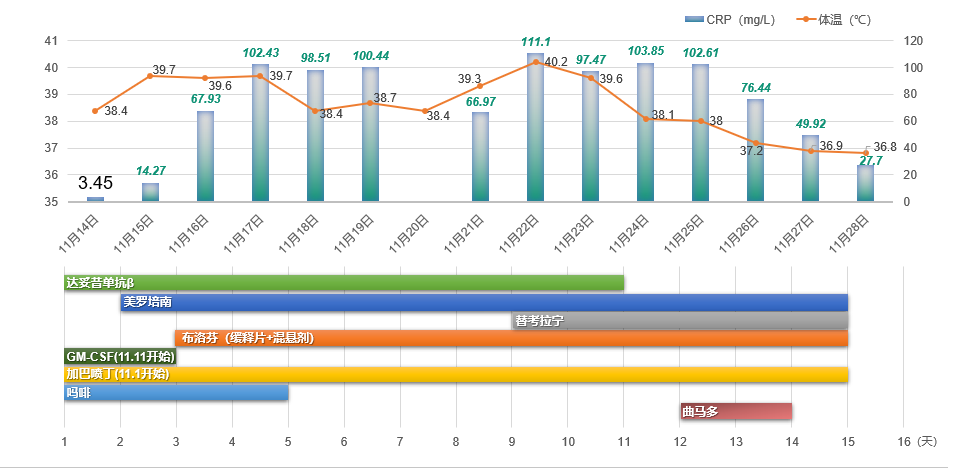
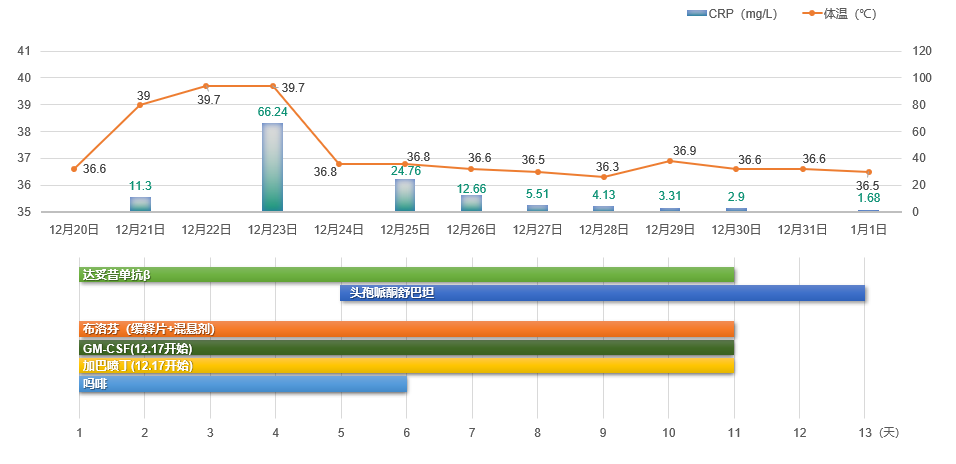
· 第一周期: 患儿经历了持续且反复的高热,体温峰值达到 40.2°C,伴随剧烈的炎症反应,C-反应蛋白水平显著升高。 针对此情况,医疗团队迅速采用美罗培南和替考拉宁进行强有力的抗感染治疗,并联合布洛芬缓释片与口服混悬剂以有效控制体温。 经过精心治疗,患儿的体温逐渐恢复正常,炎症反应也明显减轻。 在整个治疗周期内,加巴喷丁被用作基础镇痛药物,同时,在治疗初期的前5天,额外叠加使用了吗啡以加强镇痛效果。 达妥昔单抗β治疗结束后,患儿出现腿痛症状,为此继续接受了2天的曲马多治疗以缓解疼痛 (如图 4 所示)。
图4 . 第一周期达妥昔单抗β免疫治疗(2 022.11.14~11.24 ) · : 患儿发热情况较第一周期得到明显改善, 发热主要集中在治疗的前 4天,体温最高达到39.7°C,C-反应蛋白最高值为66.24mg/L。 此次,医疗团队选择了头孢哌酮舒巴坦进行抗感染治疗,并继续采用布洛芬缓释片与口服混悬剂来控制体温。 经过治疗,患儿的体温稳定在36.6°C左右,C-反应蛋白水平也趋于正常。 镇痛方面,继续使用加巴喷丁,并在治疗前6天叠加使用吗啡 (如图 5 所示)。
图5. 第二周期达妥昔单抗β免疫治疗(2022.12.20~12.30)
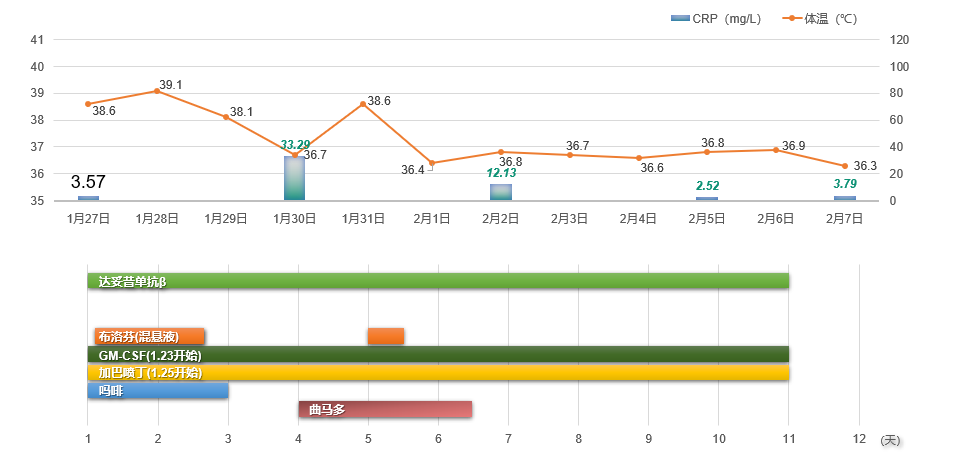
· 第三周期 : 患儿的发热症状进一步减轻,仅偶尔出现发热,体温最高达到 39.1°C,C-反应蛋白最高值为33.29mg/L。 此次,仅使用布洛芬混悬液即可有效控制体温,无需使用抗生素。 镇痛方面,继续以加巴喷丁为基础药物,但吗啡的使用时间缩短至前3天。 停用吗啡后,患儿出现了剧烈的背痛和腿痛,考虑为吗啡的戒断症状,而非药 物本身所致。 为此,医疗团队及时使用曲马多进行镇痛治疗,疼痛症状随后明显减轻 (如图 6 所示)。
图6 . 第三周期达妥昔单抗β免疫治疗(2 023.1.27~2.6 )
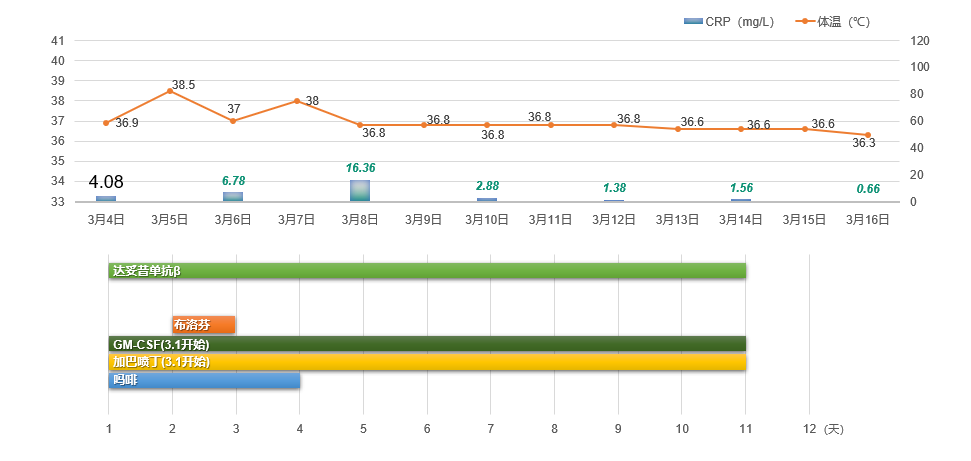
· : 患儿的病情进一步好转。 偶尔出现的发热症状也较轻,体温最高仅为 38.5°C,C-反应蛋白最高值降至16.36mg/L。 在这一周期中,患儿仅需接受1次布洛芬治疗即可控制体温。 镇痛方面,继续以加巴喷丁为主,吗啡的使用时间进一步缩短至前4天。 停用吗啡后,患儿再次出现戒断症状,但此次 通过给予安慰剂(生理盐水)即可迅速缓解疼痛(如图7 所示 ) 。
图7 . 第四周期达妥昔单抗β免疫治疗(2 023.3.4~3.14 )
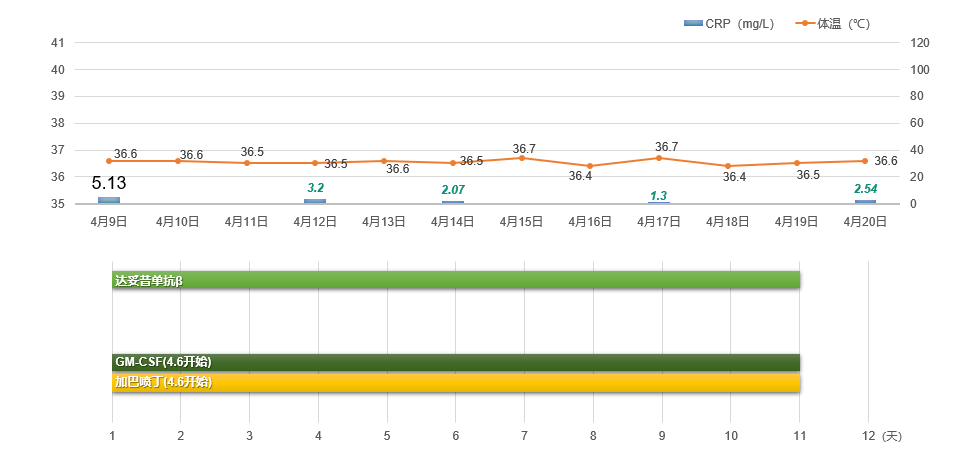
· : 患儿的体温保持平稳,维持在 36.6°C左右,C-反应蛋白水平也保持在正常范围内。 这表明患儿的病情得到了有效控制,无需再使用解热镇痛药物(如图8 所示 )。
图8 . 第五周期达妥昔单抗β免疫治疗(2 023.4.9~4.19 )
在 完成达妥昔单抗 β免疫维持治疗后,通过MIBG(间碘苄胍)进行的疾病评估显示,MIBG显像结果为阴性,Curie评分为0分,这表明患者体内未出现复发或转移的活性病灶。 患儿已成功完成了包括化疗、手术、放疗以及达妥昔单抗β免疫治疗在内的全部治疗流程。 在门诊随访的半年时间里,患儿持续保持完全缓解(CR)状态,目前仍在接受规律的随访观察。 本病例涉及一名初治高危神经母细胞瘤患儿,该患儿同时伴有骨髓转移。经过系统而规范的诱导化疗、手术切除、自体干细胞移植以及放疗等巩固治疗,患儿的原发灶及骨髓转移灶均达到了完全缓解( CR)状态。基于此,患儿符合达妥昔单抗β的适应症,并随后接受了5个周期的达妥昔单抗β免疫治疗。在整个免疫治疗过程中,患儿未出现任何严重的不良反应,仅在治疗初期出现高热和疼痛症状,但随着治疗周期的推进,这些症状逐渐减轻,至第5个周期时已成功停用吗啡。免疫治疗结束后,以及随后的6个月随访中,患儿均维持了CR状态。
本文由 湖南省人民医院儿童医学中心 的 贺湘玲教授 担任点评专家,文章以非商业研究及教育为目的,不用作商业用途,欢迎阅读、分享!
1. 中国抗癌协会小儿肿瘤专业委员会等 . 中华小儿外科杂志 ,2022,43(7):588-598. 2. Lode HN, et al. Cancers (Basel). 2023 Jun 27;15(13):3364. 3. Modak S, et al. Cancer Invest. 2007 Feb;25(1):67-77 .