神母中国之声:鱼鹰舰队捕捉“漏网之鱼” ——1例青少年高危神经母细胞瘤患者的险胜之旅
高危神经母细胞瘤由于其恶性程度高、侵袭性强,病灶往往难以完全清除。残留病灶与肿瘤的转移、复发密切相关,导致患者普遍预后较差。临床上,针对高危患者,综合治疗手段如化疗、手术、移植、放疗及免疫治疗等,是国内外权威共识一致推荐的治疗方案。同时,对于不易被识别的微小残留病灶,高特异性和敏感性的影像学评估手段对治疗方案的选择及预后判断至关重要。


患者,男性,初诊年龄15岁,既往健康。于2020年10月10日首次入院,主诉为便秘伴阵发性腹痛1月余。腹部增强CT检查提示右侧腹膜后占位,考虑为间叶来源可能性。进一步完善PET/CT检查,显示右侧腹膜后占位病灶,同时累及右肾及胰腺,后腹膜及肠系膜淋巴结转移。为明确诊断,患者接受了后腹膜肿块穿刺活检。病理结果提示小细胞恶性肿瘤,结合形态学及酶标检测,确诊为分化型神经母细胞瘤,伴坏死及钙化。分子生物学检查显示N-MYC无异常扩增、11q无缺失,但存在1p缺失。骨髓评估包括骨髓细胞学、免疫表型及骨髓活检,结果均为阴性。
诱导治疗
1.化疗
我院为该患者制定的初始治疗方案遵循了CCCG-NB-2015方案。患者共接受了8个疗程的化疗(见表1),其中在第4个疗程结束后,进行了手术切除。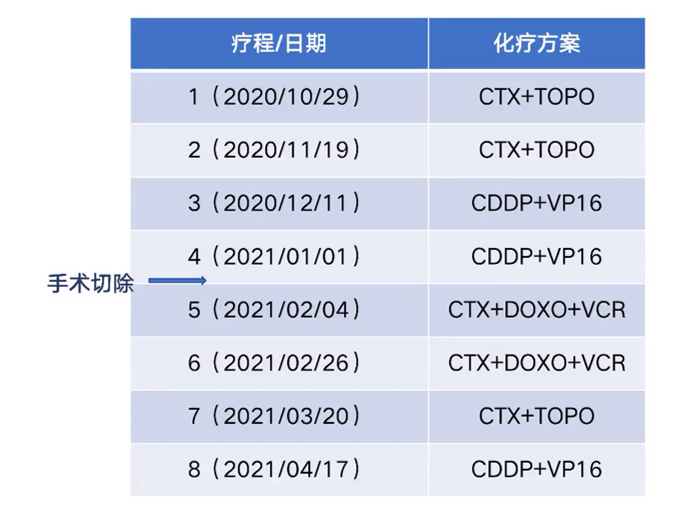
表1:第一次化疗的疗程安排和给药方案
CTX:环磷酰胺;TOPO:拓扑替康;CDDP:顺铂;VP16:依托泊苷;DOXO:多柔比星;VCR:长春新碱
2.第一次手术
2021年1月28日,患者在全麻下接受了腹膜后恶性肿瘤切除术、腹膜后淋巴结清扫术及腹腔引流术。术中发现肿瘤包膜不清,肿瘤与周围组织分离困难,沿腰大肌深面结扎离断后切除肿瘤。术后病理结果显示为节细胞神经母细胞瘤,结节型。部分神经母细胞瘤呈分化差型,部分则呈分化型改变(见图1)。术后1个月复查腹部增强MRI显示原腹膜后肿瘤已完全切除,但胰头后方仍见小淋巴结,大小约为1×0.6cm。
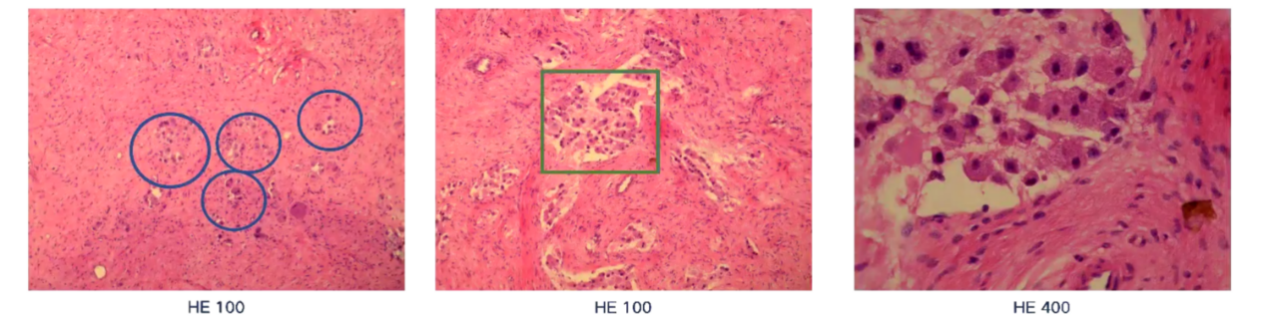
图1:第一次手术后的病理组织切片结果
在完成8个疗程的化疗后,患者于2021年5月接受了第一次自体造血干细胞移植,清髓方案采用了白消安和马法兰。
巩固治疗
1.第一次自体造血干细胞移植
结束8疗程化疗后,患者于2021年5月接受了第一次自体造血干细胞移植,清髓方案采用了白消安加马法兰。
2.放疗
患者于2021年7月8日起,开始为期2个多月的放疗。治疗区域主要包括术前瘤床区和腹膜后淋巴结区域,总剂量为36Gy。放疗结束后,患者进行了腹部MRI评估,结果显示原发肿瘤已完全消失,但胰头后方仍存在小淋巴结,大小约为11×5mm。该淋巴结被认为是转移瘤治疗后的改变,其大小与手术前相比无明显变化。患者于2021年10月开始了第二次自体造血干细胞移植,预处理方案包括卡铂、依托泊苷和环磷酰胺。
3.第二次自体造血干细胞移植
患者于2021年10月开始了第二次的自体造血干细胞移植,采用了卡铂、依托泊苷和环磷酰胺的预处理方案。
维持治疗
1.免疫维持治疗前的评估
在开始免疫维持治疗前,我院对患者进行了全面评估。PET-CT结果显示完全缓解,骨髓穿刺评估结果为阴性,NSE值、24小时VMA和HVA值均在正常范围内,因此评估结果为完全缓解。
2.免疫维持治疗方案及常规准备
根据2021版《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识》,该患者属于初治高危病例,并且在前期治疗中已达到完全缓解,符合达妥昔单抗β的治疗适应症。因此,自2022年1月起,患者开始接受达妥昔单抗β联合顺式维甲酸的五个周期免疫治疗,每35天重复一个治疗周期(见图2)。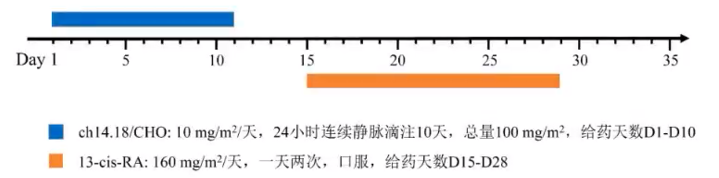
图2:达妥昔单抗β的治疗方案
ch14.18/CHO:达妥昔单抗β;13-cis-RA:13-顺式维甲酸
在开始免疫维持治疗前,患者需要进行常规准备,包括心电监护和吸氧装置的配备,以确保治疗过程中的安全性。同时,为了方便患者在治疗过程中使用吗啡,医院设置了外周留置针。吗啡的使用从达妥昔单抗β给药前2小时开始。达妥昔单抗β的输注需要通过中心静脉导管进行,并使用加压袋辅助输注。如果需要,还可开放第二条中心静脉导管进行化疗。
3.免疫维持治疗期间的副反应管理
1)疼痛管理
所有接受免疫治疗的患者均使用数字评分法进行疼痛评估。在第1个治疗周期开始时,患者接受了30μg/kg/h的吗啡,后续根据疼痛评分逐步调整吗啡剂量。在治疗的第7和第8天,患者出现了戒断反应,因此减缓了剂量下调的速度。在第2至第5治疗周期中,患者的吗啡剂量和使用时间较前减少,且在整个治疗过程中未出现明显的疼痛主诉(见图3)。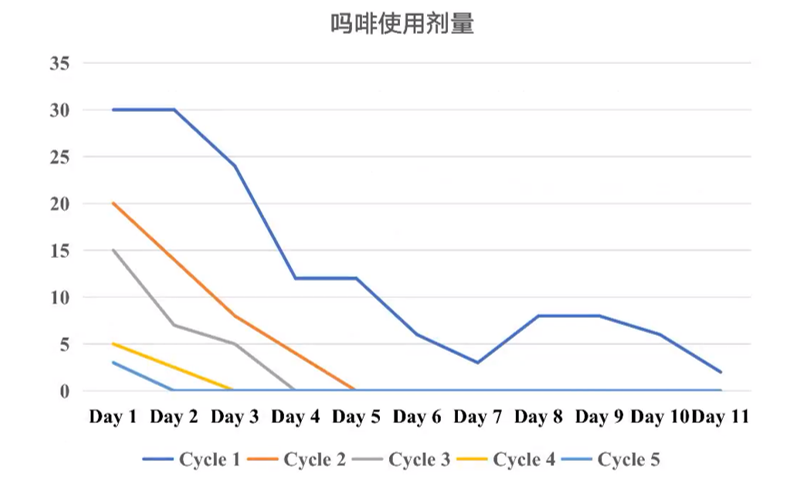
图3:5个治疗周期中患者的吗啡使用剂量变化
在使用达妥昔单抗β期间,患者出现了药物相关性发热。第1周期的第3至第5天,患者出现了反复高热,体温最高达到38.7℃;第2周期的第8至第11天,体温最高达到39℃。在这两个周期中,患者反复发热,我们进行了血常规、C反应蛋白(CRP)、降钙素原、真菌内毒素及血培养检查,结果均为阴性,排除感染引起的发热。治疗中仅给予布洛芬对症治疗,未使用抗生素。第3至第5周期时,患者未再出现发热现象。4.疗效评估
在GD2免疫治疗期间,医院每个治疗周期均监测患者的肿瘤相关指标,包括NSE、LDH、VMA和HVA(见图4)。在第三个周期结束后,患者再次接受腹部MRI评估,结果显示原胰头后方的小淋巴结伴局部强化,大小无显著变化,约为10×4mm。
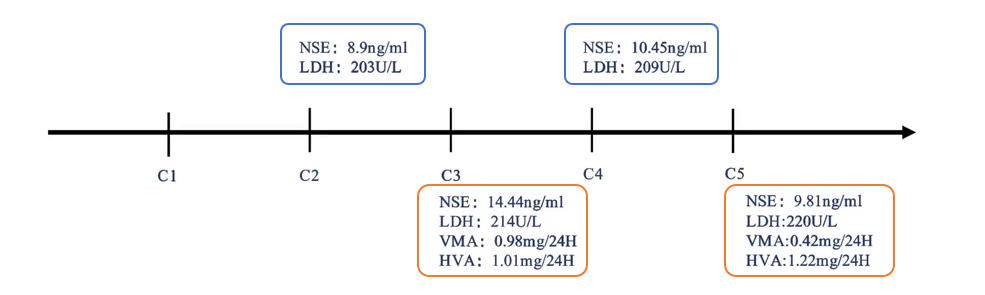
图4:免疫维持治疗期间肿瘤相关指标的评估结果
NSE:神经元特异性烯醇化酶;LDH:乳酸脱氢酶;VMA:香草扁桃酸;HVA:高香草酸
在回顾该患者的治疗路径(见图5)后,我们发现,在经历了化疗、手术、移植、放疗和免疫治疗等多重治疗后,胰头后方的小淋巴结始终反复出现在影像学检查中,尽管其体积没有变化,但它的存在引发了治疗团队的关注。
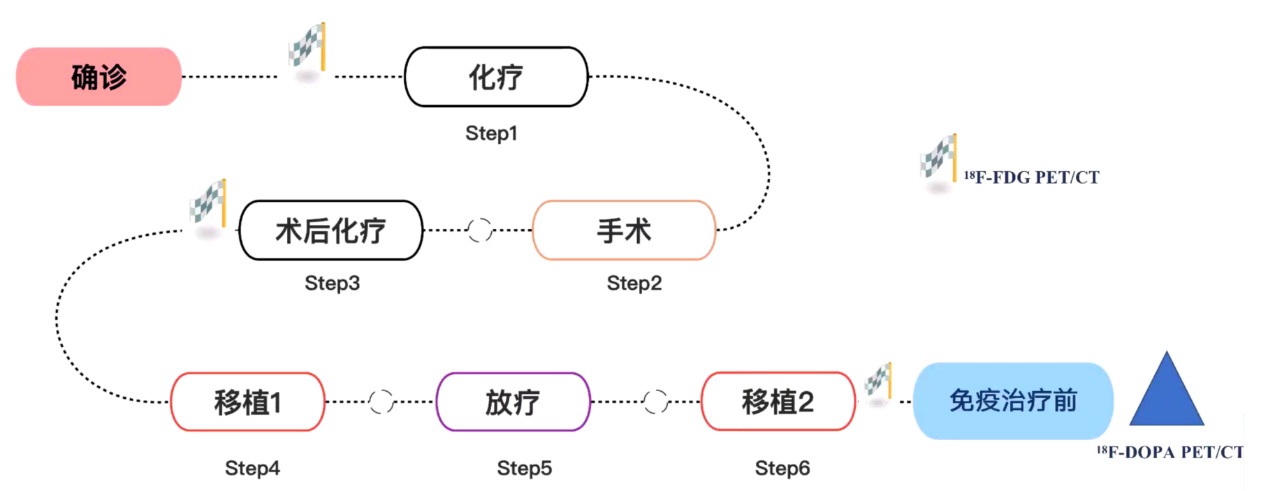
图5:治疗路径及大评估节点
MIBG和PET-CT是神经母细胞瘤指南中一致推荐的两种核医学成像方法。MIBG具有高灵敏度和特异性,特别是在评估患儿治疗后骨转移灶时,表现出显著优势。然而,它也存在一定的局限性,特别是对于MIBG阴性的患者。该患者使用了18F-FDG PET/CT和18F-DOPA PET/CT进行核医学评估。18F-FDG PET/CT通常用于恶性肿瘤的评估,适用于MIBG阴性的神经母细胞瘤患者,但其对骨髓病灶的评估较为困难,且由于大脑的高生理性摄取,颅内病灶难以评估。相比之下,18F-DOPA PET/CT通过多巴的类似物DOPA进行显像,具有较高的敏感性和特异性,可有效区分炎性灶、反应性增生性淋巴结等,因此有可能成为替代MIBG的最佳PET显像剂。初诊时,患者接受了18F-FDG PET/CT评估,结果显示右侧腹膜后原发灶存在,且18F-FDG摄取不均匀,SUVmax为13.3。后腹膜淋巴结转移显示,胰头后方的淋巴结大小为10×8mm,FDG摄取稍高(SUVmax:4.4)(见图6)。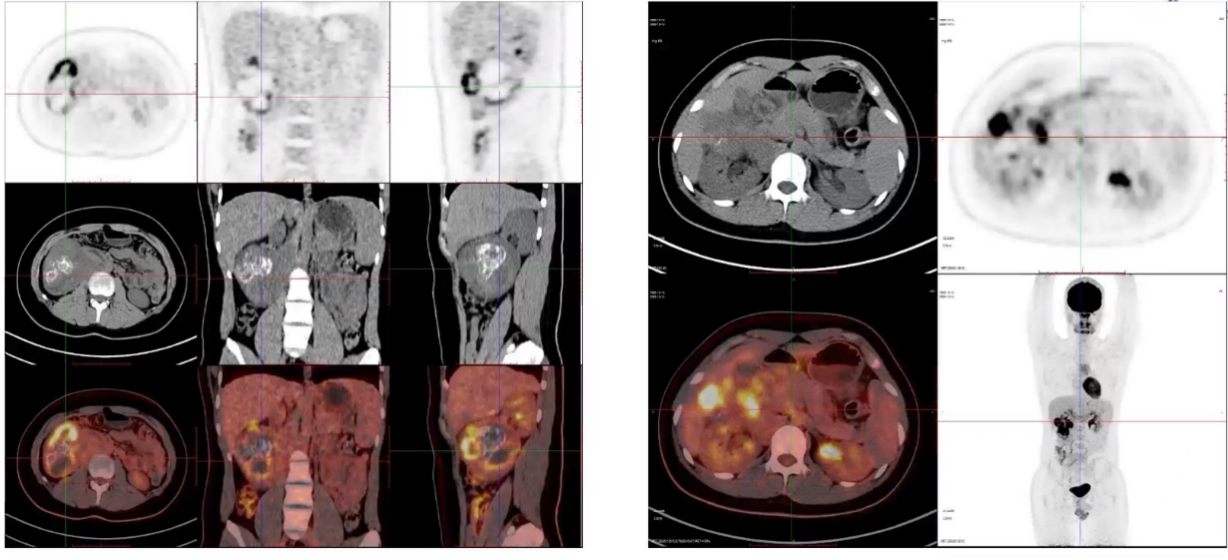
图6:患者初诊时18F-FDG PET/CT评估的图像
移植之前的18F-FDG PET/CT评估显示,腹膜后淋巴结的高代谢区大小为9×6mm(SUVmax:4.0),与之前影像相比变化不大,首先考虑为转移灶。MRI评估证实了胰头后方小淋巴结,总体变化不大(见图7)。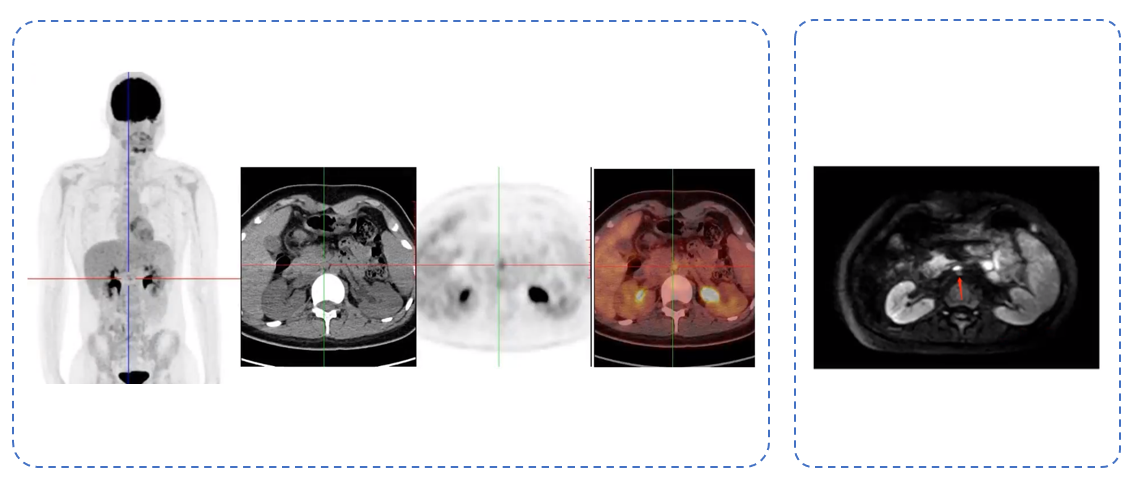
图7:左为患者移植前18F-FDG PET/CT评估的图像;右为患者移植前腹部增强MRI评估的图像、
免疫治疗前的18F-FDG PET/CT评估显示胰头后方淋巴结仍然存在,但FDG摄取不高,考虑患者达到了完全缓解。腹部MRI评估显示该淋巴结的变化较前不大(见图8)。
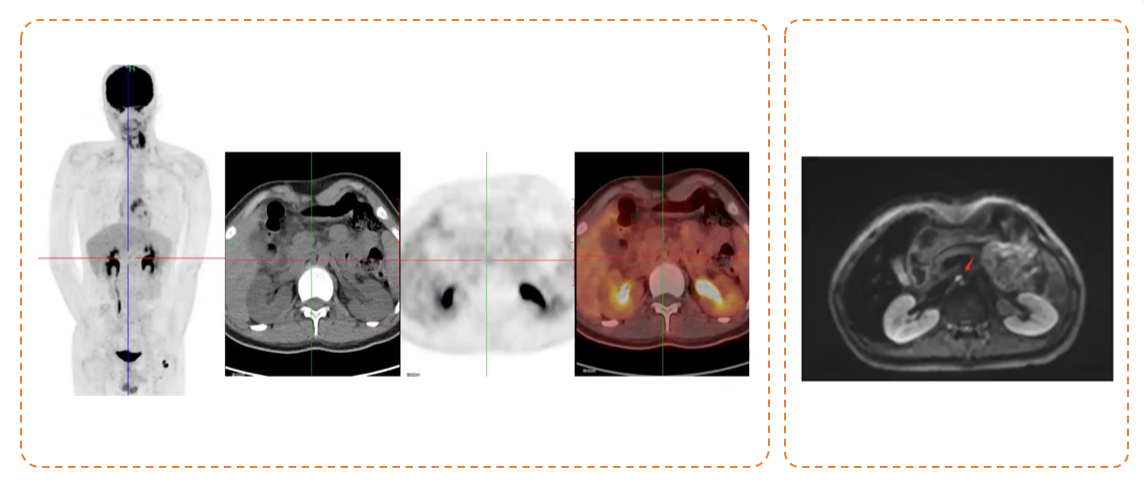
图8:左为患者免疫治疗前18F-FDG PET/CT评估的图像;右为患者免疫治疗前腹部增强MRI评估的图像
然而,在免疫治疗后,患者接受了18F-DOPA PET/CT检查,结果与18F-FDG PET/CT不同。18F-DOPA PET/CT显示该淋巴结处DOPA摄取增高(SUVmax:4.3),并且在主动脉腔静脉间隙、L2腰大肌旁的软组织灶也出现了DOPA摄取稍高(SUVmax:2.3),提示可能存在肿瘤残留(见图9)。
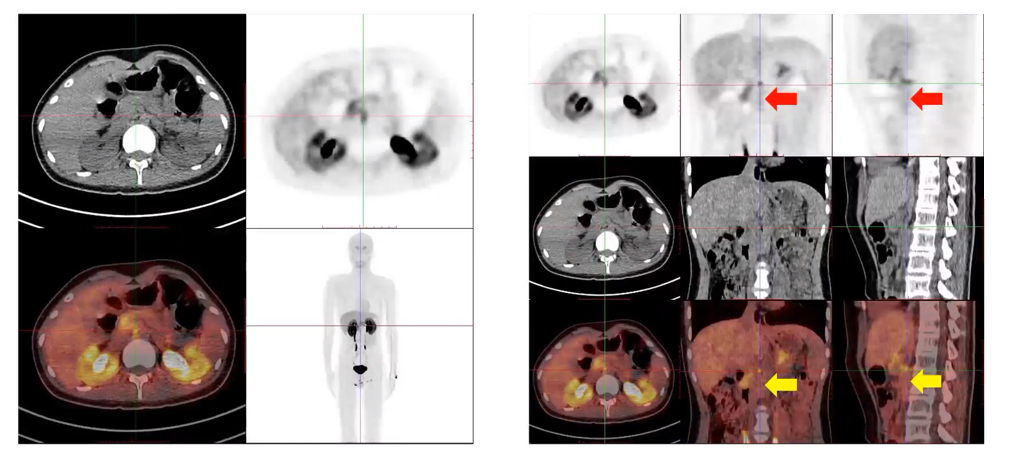
图9:患者免疫治疗后18F-DOPA PET/CT评估的图像
根据儿童肿瘤多学科团队的会诊意见,结合18F-DOPA PET/CT的影像学结果,提示胰头后方淋巴结可能仍具有肿瘤活性,团队决定对患者进行再次手术。2022年8月,患者在全麻下接受了腹膜后病灶切除、腹膜后淋巴结清扫、肠粘连松解术及腹腔引流术。术中发现,右肾蒂下方和下腔静脉与腹主动脉之间的区域存在肿瘤组织(大小约为3.5*2*1.8cm),同时右侧腰大肌也发现了肿瘤组织(直径1-2.5cm)。术后病理检查结果显示,肿瘤以节细胞神经瘤(成熟中节细胞)为主,小灶呈节细胞神经母细胞瘤形态,伴有钙化(见图10)。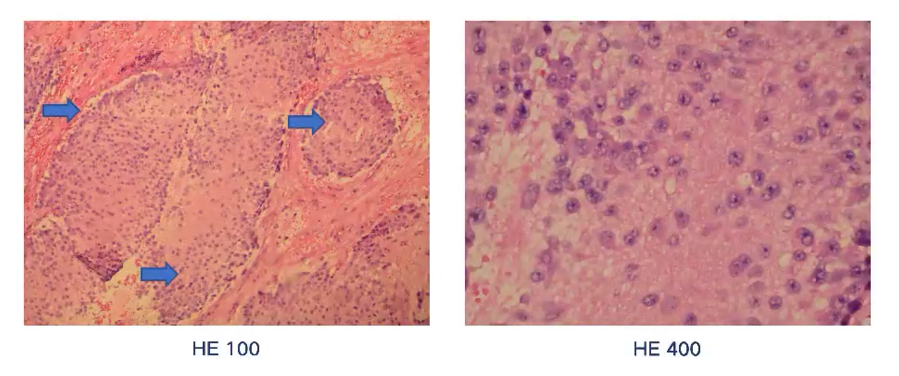
图10:第二次手术后的病理组织切片结果
术后,患者接受了3个疗程的VIT方案化疗(见图11),并再次进行了腹部MRI评估。评估结果显示,腹膜后术后改变,未见明显活性病灶,患者已达到完全缓解。患者在完成3轮顺式维甲酸治疗后结束了所有治疗,目前患者已结疗3个月,近期评估未见任何肿瘤病灶残留。
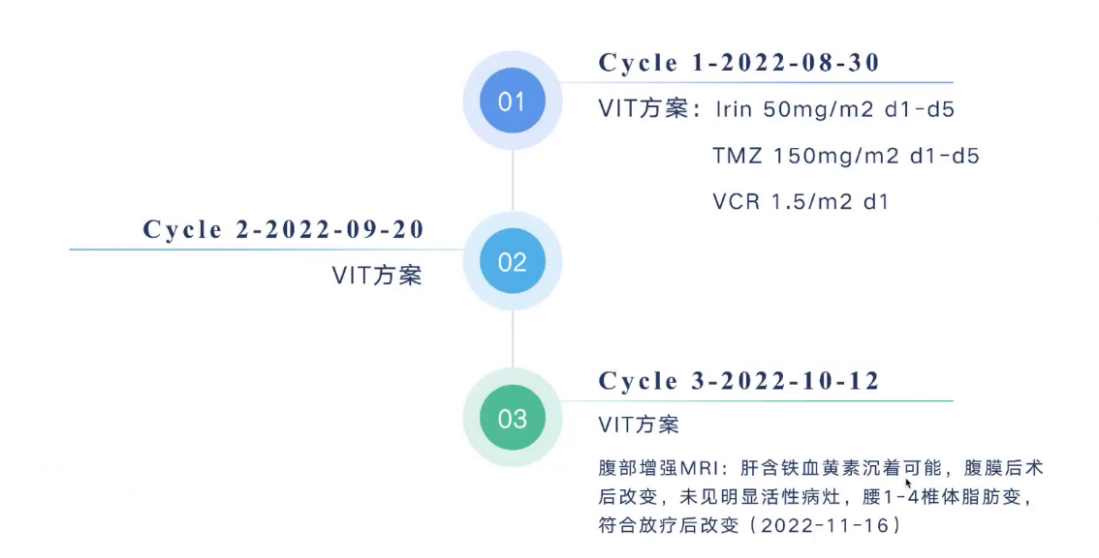
图11:第二次化疗的给药方案
VCR:长春新碱;TMZ:替莫唑胺;Irin:伊立替康
此例青少年神经母细胞瘤高危患者,经过化疗、手术、造血干细胞移植、放疗及免疫治疗等多手段的规范化治疗后,成功达到了完全缓解。该病例提示,在大年龄/大体重的神经母细胞瘤患者中,规范使用GD2免疫治疗是安全可靠的,但应特别注意治疗期间吗啡剂量的逐步调整。此外,淋巴结是神经母细胞瘤常见的浸润和转移部位。该患者在整个治疗过程中,胰头后方的小淋巴结大小约1cm,持续存在。提示,在治疗过程中应采用多种影像学评估方式进行甄别,以避免漏诊,确保肿瘤活性灶的“捕获”。本例中,18F-DOPA PET/CT的敏感性和特异性为这一治疗决策提供了重要依据,进一步手术和病理结果验证了该评估方式的准确性。
本文由上海交通大学医学院附属新华医院儿血液肿瘤科的袁晓军主任担任点评专家,文章以非商业研究及教育为目的,不用作商业用途,欢迎阅读、分享!

■ 国家卫生健康委儿童实体肿瘤专家委员会委员; ■ 中国抗癌协会小儿肿瘤专业委员会常委;
■ 主要从事儿童实体肿瘤的化疗、免疫治疗及造血干细胞移植;
■ 执笔撰写CCCG肝母细胞瘤2009方案、2016方案和中国抗癌协会CACA-肝母指南; ■ 曾获得中华医学科技三等奖、上海医学科技二等奖、上海市科学技术进步二等奖; ■ 第十届宋庆龄儿科医学奖; 第四届上海市抗癌协会科技奖三等奖;上海医学科技奖三等奖。多阶段综合治疗已成为国内外高危神经母细胞瘤的规范化治疗方案。然而,由于高危神经母细胞瘤具有高度侵袭性等特点,部分患者在经历了诱导化疗、手术、移植、放疗等治疗后,仍难以完全清除病灶,这为临床治疗带来了巨大的挑战。GD2单抗免疫治疗已被证明能够进一步清除残留病灶,改善神经母细胞瘤的预后。本病例患者在经过诱导和巩固治疗后,达到了完全缓解(CR),并接受了达妥昔单抗β免疫治疗。在免疫治疗期间,患者耐受良好,且肿瘤相关指标均恢复至正常水平。值得注意的是,治疗期间,患者的影像学检查多次显示胰头后方有一个小的淋巴结。最终,通过18F-DOPA PET/CT的评估结果,判断该淋巴结存在肿瘤活性,并通过二次手术实现了病灶的彻底清除。这一过程提示,临床评估神经母细胞瘤时,应结合多种影像学评估手段,尤其是对于高度怀疑存在活性病灶的患者,采用联合评估能够显著提高检测的精确性,降低肿瘤残留的风险。案例来自上海市新华医院,本文仅供学术分享使用,不能作为诊断、治疗的依据,请谨慎参阅
作者:歆语健康



























