高危神经母细胞瘤(HR-NB)的治疗通常分为三个阶段:诱导治疗阶段包括化疗和手术,巩固治疗阶段包括造血干细胞移植和放疗,维持治疗阶段则采用免疫治疗和维甲酸等。然而,即便经历了这些多阶段、多模式的综合治疗,HR-NB患者仍面临复发或进展的风险,总体生存率较低。未能彻底清除微小病灶是导致神经母细胞瘤复发的主要原因,这也是影响患者远期生存的关键因素。
现将1例多次复发、并接受自体造血干细胞移植和GD2免疫维持治疗的4期HR-NB病例报告如下。



患儿为5岁女童,2020年7月因“食欲减退、面色苍白近1月”入院就诊。入院时查体神志清楚,面色苍白,无水肿,浅表淋巴结无肿大,咽部无充血,呼吸对称且正常,心率90次/分,心律整齐,未闻及杂音。腹部形态饱满,柔软,无压痛或反跳痛,肝脏和脾脏肋下未触及,腹部未见包块。血常规检查结果显示:白细胞计数(WBC)8.04×10^9/L,血红蛋白(Hb)70 g/L,血小板计数(PLT)510×10^9/L,中性粒细胞计数(NSE)2.38×10^9/L。生化及肿瘤标志物检查显示肝肾功能正常,铁蛋白68 ng/mL,乳酸脱氢酶(LDH)582 U/L,神经元特异性烯醇化酶(NSE)180.3 ng/mL,24小时香草基扁桃酸(VMA)49.65 mg/24h。LDH、NSE和24小时VMA较正常值均明显升高。骨髓细胞学检查发现,双侧髂后上嵴可见“菊花团状”分布的细胞,占46%,且免疫表型9.9%表达GD2阳性,骨髓活检证实神经母细胞瘤骨髓浸润,骨髓染色体为46 XX,骨髓NMYC未见异常信号。影像学检查显示腹膜后实性肿块,跨中线生长,大小约为51 mm×50 mm×120 mm;前中颅底肿块,大小约为34 mm×22 mm×26 mm;双侧颈部及胸廓入口处见多个结节,最大径约21 mm×12 mm。此外,颅骨、颌面骨、双侧肱骨、肩胛骨、右第1肋、左第6肋前端、右锁骨胸骨端、胸骨、各椎体、盆骨及双侧股骨等全身多处可见异常骨质代谢活跃灶,并有多发骨质破坏,提示恶性肿瘤骨、骨髓转移。结合上述检查结果,最终该患儿诊断为神经母细胞瘤4期,高危组(骨、骨髓、腹膜后、颈部、胸廓入口、颅底、头颅骨及软组织等多发转移)。

目前HR-NB的治疗包括诱导治疗、巩固治疗以及维持治疗三个阶段(见图2)。诱导治疗包括化疗以及化疗期间的手术和干细胞采集,化疗药物使用顺铂、环磷酰胺、多柔比星、依托泊苷、拓扑替康和长春新碱类药物。巩固治疗包括清髓性预处理、自体造血干细胞移植和放疗。维持治疗阶段采用GD2单抗免疫治疗和异维甲酸治疗。
Ch14.18 mab:达妥昔单抗;subq:皮下注射;GM-CSF:粒细胞巨噬细胞集落刺激因子;IV:静脉注射;IL-2:白细胞介素-2;Ch14.18/CHO mab:达妥昔单抗β
在诊断后,该患儿于2020年8月开始接受9个周期的诱导化疗(见图3),治疗方案包括环磷酰胺、阿霉素、长春新碱、顺铂、依托泊苷和托泊替康。
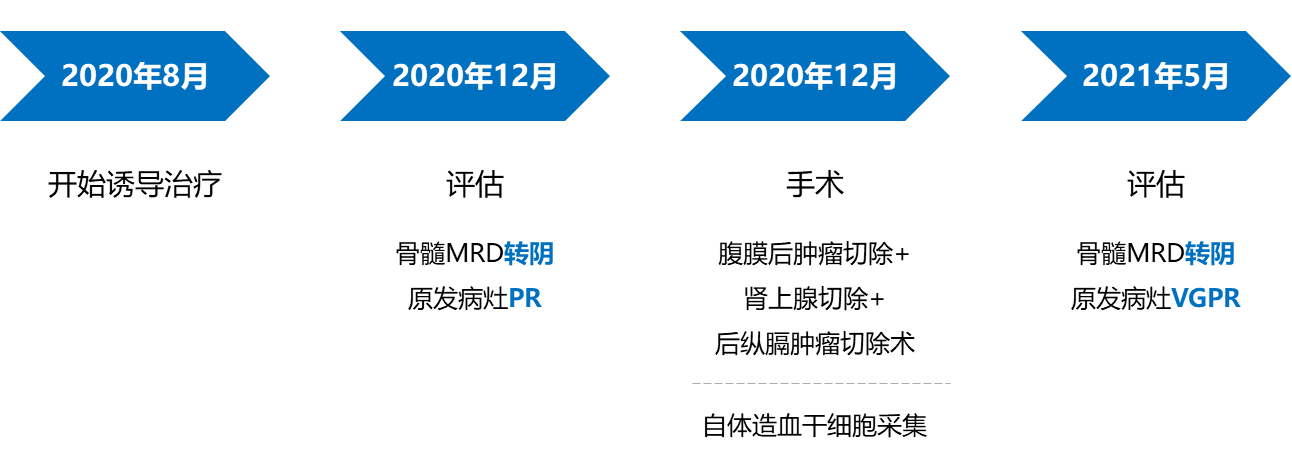
图3. 患者诱导治疗过程
PR:部分患者;VGPR:非常好的部分缓解
经过5个周期的诱导化疗后,患儿于2020年12月进行了骨髓微小残留病灶(MRD)检测,结果显示骨髓MRD转阴,原发病灶也达到了部分缓解(PR)。胸腹部CT扫描显示,腹膜后病灶缩小至34mm×24mm×60mm,骨显像显示双侧肱骨、肋骨、肩胛骨及颅骨的病灶有好转。6个周期诱导化疗后,患儿于2021年1月接受了腹膜后肿瘤切除术、肾上腺切除术及后纵膈肿瘤切除术。经过7个周期的诱导化疗,患儿完成了自体造血干细胞采集;9个周期诱导化疗结束时,患儿骨髓MRD持续阴性,原发病灶达到了非常好的部分缓解(VGPR)。9个周期诱导化疗结束时,患儿进行了PET-CT检查,显示“双侧颈部小淋巴结代谢无异常增高;后纵膈脊柱旁、双侧膈肌脚及腹膜后有多发结节状高密度影像及稍厚软组织影像,部分代谢轻度增高;颅骨、双侧肱骨中上段、双侧肩胛骨、胸骨、双侧髂骨、坐骨、髋关节和双侧股骨的骨质密度不均,代谢无局限性异常增高”。综合考虑,治疗后大部分病灶的活性被抑制,患儿达到了VGPR状态。诱导治疗前,患儿的NSE为180.3 ng/mL,VMA为49.65 mg/24h,明显高于正常值;诱导治疗结束后,这两个指标基本恢复至正常水平(见图4),进一步证实了诱导治疗的有效性。
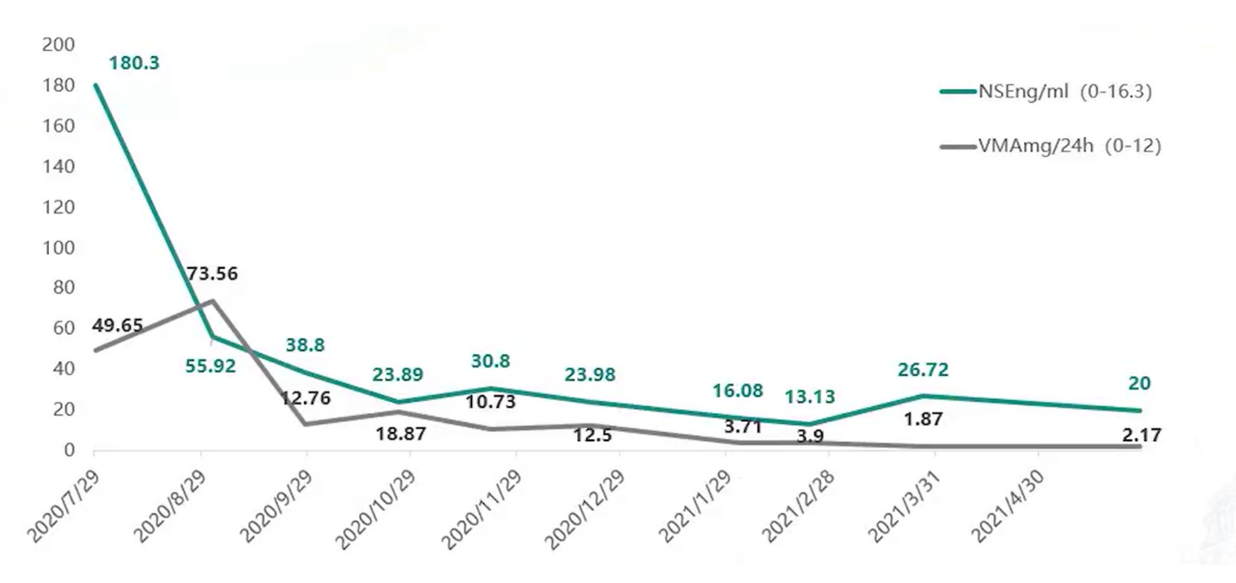 图4. 诱导治疗期间肿瘤标志物变化情况
图4. 诱导治疗期间肿瘤标志物变化情况
NSE:神经元特异性烯醇化酶;VMA:香草基扁桃酸
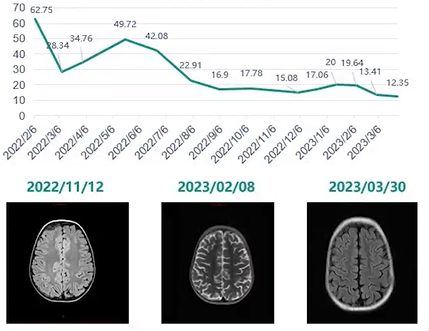
患儿于2021年6月开始接受白消安+马法兰的清髓性预处理方案,随后回输自体外周血干细胞,CD34+细胞数为1.8×10^6/kg。2021年8月至2022年1月,患儿接受了颈部、胸部和腹部(26Gy/13Fx)以及颅底(30Gy/15Fx)的瘤床放疗。由于放疗期间患儿血象较低(粒细胞缺乏、骨髓抑制、血小板减少),放疗实施过程中采取了间断治疗,放疗总周期持续了四个月。放疗结束后,患儿于2022年2月出现反复低热,伴左侧小腿疼痛。复查发现,NSE升至62.75 ng/mL,VMA升至16.7 mg/24h。胸腹部CT检查显示原发病灶为阴性;骨显像提示胸骨、双侧髂骨、坐骨、髋关节和双侧股骨的骨质代谢稍有活跃;骨髓穿刺检查显示神经母细胞瘤细胞占比0.05%。考虑到这些变化,怀疑为早期骨、骨髓复发。复发后,患儿于2022年2月至4月接受了2个周期的化疗,分别使用VIT方案和COAP方案,期间骨髓MRD始终未转阴,GD2阳性细胞占比为0.07%-0.1%。骨髓细胞学检查显示“菊花团状”分布的细胞,同时患儿的骨髓抑制较为严重,WBC为1.84×10^9/L,Hb为64 g/L,PLT为26×10^9/L,三系血细胞计数明显偏低。尽管接受了多次二线化疗,患儿的骨髓MRD始终未转阴,且肿瘤标志物NSE在短暂下降后再次升高。由于在诱导治疗、自体造血干细胞移植、原发病灶放疗及复发后二线化疗后,骨髓增生欠佳且三系血细胞减少,患儿已无法耐受大剂量化疗,建议转为GD2单抗免疫治疗。
神经母细胞瘤的免疫治疗包括主动免疫(如细胞因子和肿瘤疫苗)、被动免疫(如单克隆抗体GD2单抗)、过继细胞疗法、免疫检查点抑制剂等。GD2单抗是目前较为成熟的免疫治疗方法之一。该患儿接受了GD2单抗免疫治疗,治疗方案为达妥昔单抗β+VIT化疗+GM-CSF+异维甲酸联合治疗,每个周期为35天,共治疗5个周期(见图5)。
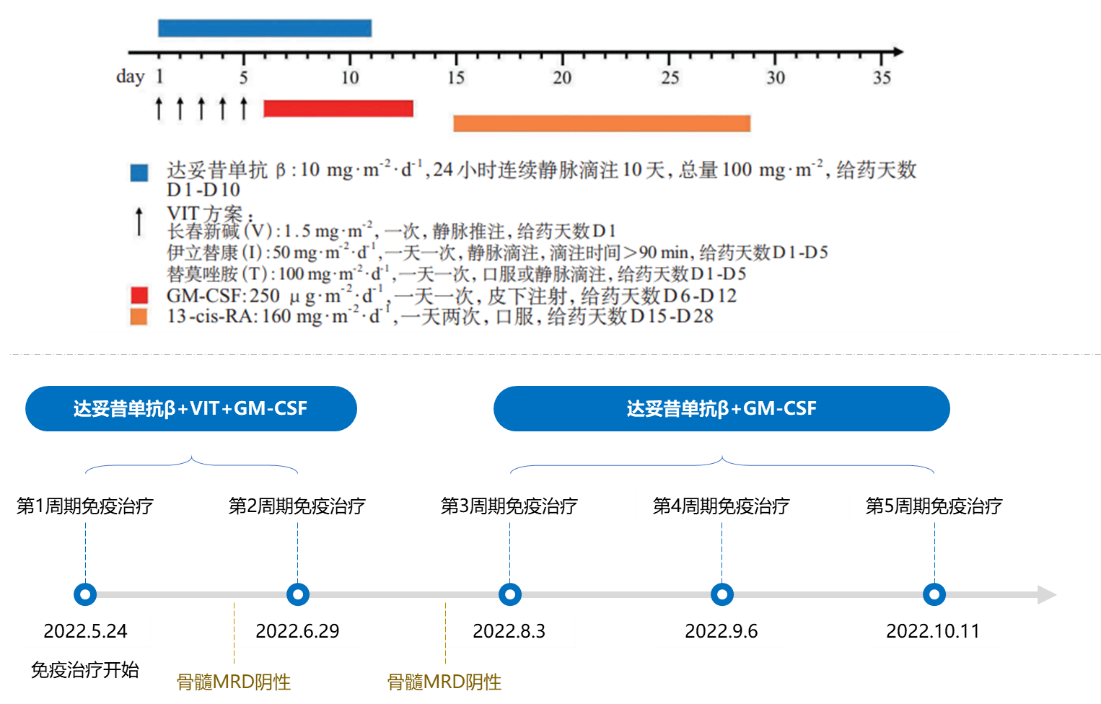
图5. 神经母细胞瘤患儿复发后5个周期达妥昔单抗β免疫治疗方案
在第一周期免疫治疗开始的第1天,患儿出现高热;第2天,患儿出现血压下降、血氧饱和度下降及肺水肿表现,暂停输注达妥昔单抗β并给予对症处理后症状得到显著缓解。随后,继续进行了达妥昔单抗β治疗,患儿耐受良好(见图6)。
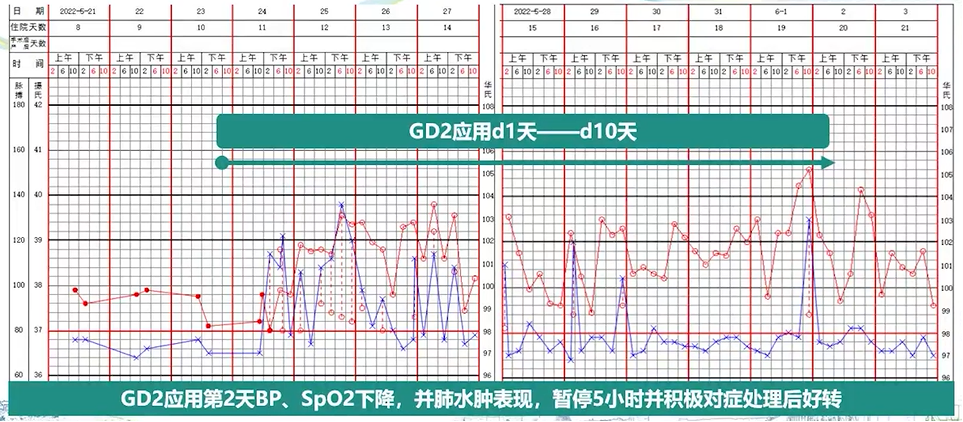
图6. 第一周期免疫治疗期间患儿体温变化及不良反应发生情况
在第一周期免疫治疗第3天,患儿细胞因子释放和LDH水平均达到最高水平;第6天,由于毛细血管渗漏,患儿出现一过性黄疸。经过对症处理,约10天后,TBIL恢复正常(见图7)。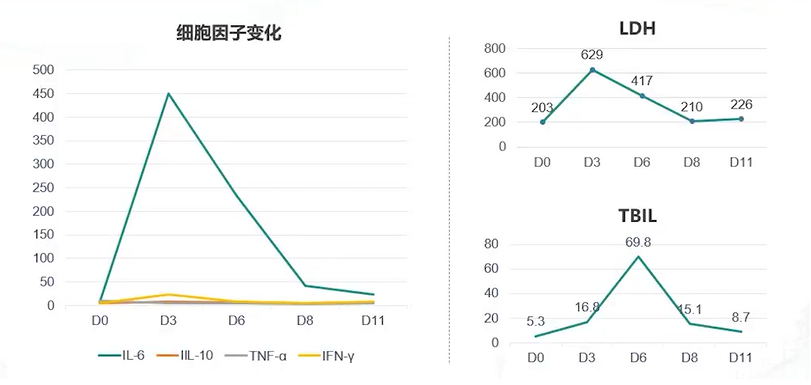
图7. 第一周期免疫治疗期间患儿细胞因子释放及LDH、TBIL水平变化情况
在第二周期免疫治疗期间,除发热外,患儿未出现明显的血氧饱和度下降、毛细血管渗漏等不良反应,耐受性良好(见图8)。
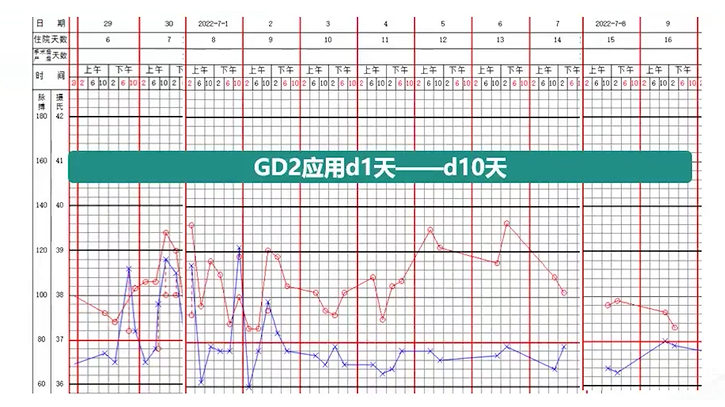
图8. 第二周期免疫治疗期间药物治疗及体温变化情况达妥昔单抗β免疫治疗的主要不良反应为发热、心率增快和毛细血管渗漏,疼痛表现不显著,一般通过3-4天的吗啡治疗可以得到缓解。
每个免疫治疗周期结束后,患儿均进行了骨髓MRD检测。第一周期免疫治疗结束后,骨髓MRD转阴,未见GD2阳性表型细胞;第二周期免疫治疗结束后,骨髓MRD维持阴性。达妥昔单抗β给药后,肿瘤标志物NSE持续下降,并基本维持在正常范围内(见图9)。
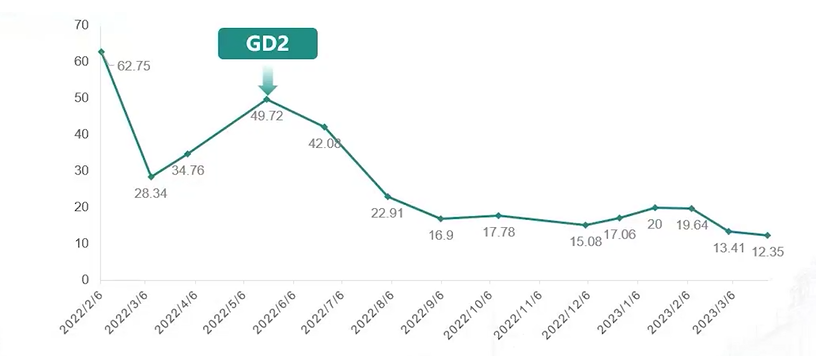
图9. 达妥昔单抗β免疫治疗前后NSE水平变化情况
GD2单抗使用达妥昔单抗β
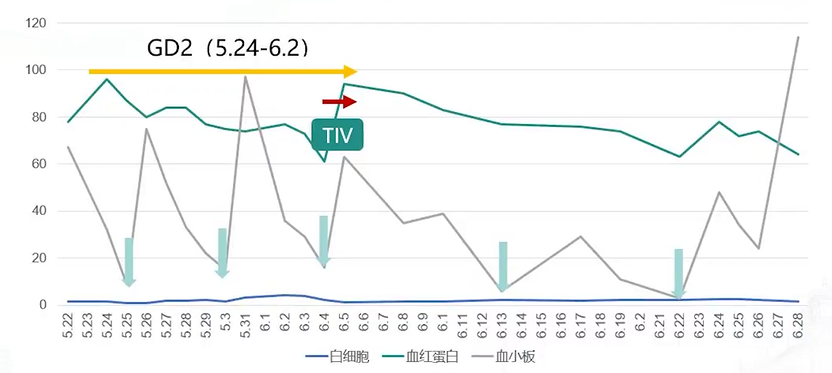
此外,免疫治疗期间,患儿的血小板输注时间间隔逐渐延长,表明骨髓功能有一定恢复(见图10)。
图10. 第一周期免疫治疗期间白细胞、血红蛋白、血小板变化趋势及血小板输注情况
患儿于2022年11月再次出现发热,并诉有头痛及右大腿疼痛。复查骨髓MRD阴性,未见“菊花团状”分布的细胞;腹部及纵膈影像学检查显示原发病灶阴性;头颅MRI显示右侧额骨及额顶部脑膜局部新增一异常信号影像;骨显像也显示右侧额骨局部骨质代谢异常。与2022年5月的检查结果比较,出现了新发活跃病灶。患儿随后接受了TIV、CD方案交替化疗(姑息治疗)3个周期。经过治疗后,头颅MRI显示额顶部颅骨及脑膜的异常信号影像范围逐渐缩小,且骨髓维持在缓解状态(见图11)。图11. 患儿首次复发后NSE变化趋势(上图)及二次复发后头颅MRI显像(下图)

达妥昔单抗β在中国已获批用于初治高危、复发或难治性神经母细胞瘤的免疫治疗。本病例为一名4期高危神经母细胞瘤(HR-NB)患儿,存在骨、骨髓、腹膜后、颈部、胸廓入口、颅底、头颅骨及软组织等多发转移。经过9个周期的诱导化疗和手术治疗后,患儿达到了极微小残留病灶缓解(VGPR),骨髓微小残留病灶(MRD)阴性。随后,患者接受了自体造血干细胞移植(ASCT)巩固治疗和放疗,但仍出现复发,符合使用达妥昔单抗β的适应症。复发后,患儿接受了多次二线化疗,但骨髓MRD始终无法转阴。根据《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识》,选择了方案三,即达妥昔单抗β联合VIT化疗、GM-CSF和异维甲酸进行免疫治疗。免疫治疗第1周期后,骨髓MRD转阴,第2周期后骨髓MRD维持阴性。然而,经过5个周期的免疫治疗后,患者出现了右侧额骨的新发病灶,随后接受了TIV和CD方案交替化疗3个周期,逐渐好转,骨髓维持缓解状态。
目前,高危神经母细胞瘤(HR-NB)的治疗模式遵循诱导治疗、巩固治疗和维持治疗三个阶段。GD2单抗在清除骨髓MRD方面具有明显的优势,并能够持续保持这一优势,这可能与骨髓局部免疫细胞的丰富程度有关。同时,本患儿采用达妥昔单抗β治疗后,骨髓功能得到了恢复,免受化疗的影响。不同治疗方法在HR-NB的治疗中相辅相成,临床医生应扬长避短,结合多种治疗手段,为患儿带来更好的长期获益。
本文由武汉儿童医院儿童肿瘤科的李晖主任担任点评专家,文章以非商业研究及教育为目的,不用作商业用途,欢迎阅读、分享!
高危神经母细胞瘤的治疗难度大,预后差。即使患者经历了包括化疗、手术、放疗、造血干细胞移植等多轮综合治疗,部分患者仍会出现疾病进展或复发。以本病例为例,虽然诱导治疗阶段反应良好,但骨髓中可能仍存在微小残留病灶,这导致后续治疗过程中的多次复发,给临床治疗带来了巨大挑战。达妥昔单抗β免疫治疗在第1周期后有效清除骨髓中的MRD,并且能够维持MRD阴性,同时促进骨髓功能的恢复,充分显示了达妥昔单抗β在复发性伴有骨、骨髓转移的高危神经母细胞瘤中的有效性,并彰显了其在清除骨髓MRD方面的巨大优势。总的来说,骨或骨髓是高危神经母细胞瘤常见的复发部位,复发后治疗难度更大。GD2单抗免疫治疗能够显著提高患者再次缓解和治愈的可能性,为高危神经母细胞瘤患者的治疗提供了重要的临床支持。
案例来自武汉儿童医院,本文仅供学术分享使用,不能作为诊断、治疗的依据,请谨慎参阅
1. https://www.ncbi.nlm.nih.gov/books/NBK65747/#CDR0000062786__7062. 袁晓军,等.中华转移性肿瘤杂志,2022,05(1):14-20.3. Sung KW. Korean J Pediatr. 2012;55(4):115-120.4. Kushner BH, et al. Oncoimmunology. 2015;4(7):e1016704.





 图4. 诱导治疗期间肿瘤标志物变化情况
图4. 诱导治疗期间肿瘤标志物变化情况