多项临床研究表明,酸性鞘磷脂酶(ASM)与包括阿尔茨海默病(AD)在内的众多神经退行性疾病在病理学上存在相关性。然而,ASM如何具体作用,影响疾病的产生仍然尚未明确。近日,来自韩国庆北大学KNU阿尔茨海默病研究所的团队在Nature Communications上发表了相关研究报告,阐述了阿尔茨海默病小鼠模型中ASM的具体病理机制。
此前众多的临床研究表明,循环因子在衰老和老年性神经退行性疾病(如阿尔茨海默病)的发病机制中占据十分重要的地位。年轻小鼠个体的血液对衰老和/或年龄相关的神经退行性脑疾病的个体有着强大的恢复作用。与此相对应,将年轻小鼠暴露于老年野生型(WT)或AD小鼠的血液中会加速脑功能障碍,引起诸多病理学改变。这些发现表明,向目标输注年轻个体的血液或血液中发现的特定循环因子可能是年龄相关神经源性疾病的一种有前途的治疗策略。
酸性鞘磷脂酶是一种鞘脂代谢酶,能够催化鞘磷脂水解为神经酰胺。高活性的酸性鞘磷脂酶(ASM)存在于老年/年轻人或小鼠的血液和大脑中。研究表明,微血管中的血脑屏障内皮细胞(BBB-ECs)是老年小鼠大脑ASM活性的主要调控因素。AD患者以及小鼠模型中也同时检测到ASM活性的升高。相对应的,老年或AD患者大脑中ASM活性的升高可能会导致脑白细胞渗漏、BBB-EC凋亡、神经吞噬细胞功能障碍和神经损伤。“共生手术”——探寻血浆ASM与AD联系的研究方法
研究团队首先测量了AD患者血浆中ASM的活性,并证实了ASM的活性会随着疾病的进展而逐渐增加。令人惊讶的是,研究团队并未检测到AD患者的血浆神经酰胺水平出现显著变化。
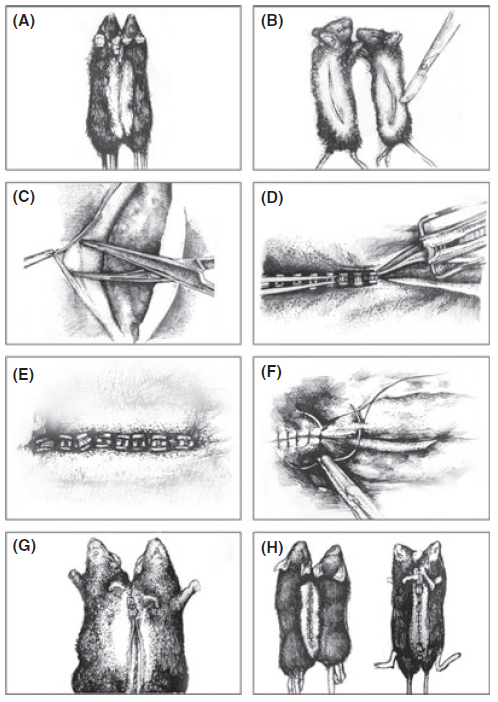
为了探究血浆ASM与AD之间的联系,研究团队采取了“共生手术”,即将两只动物的循环系统配对,进行“共生”处理,以测定一只动物对另一只动物的系统或循环因子的影响(图1)。APP/PS1小鼠是一种经过充分验证并投入研究的AD小鼠模型,其血浆中ASM活性较高,但是血浆神经酰胺并不会随着小鼠年龄的增长产生显著差异,这与上述阿尔茨海默病患者测定的结果相一致。为了增加血浆ASM活性,研究小组使用了内皮细胞特异性过度表达ASM的条件转基因小鼠(Tie2-cre;Smpd1ox/ox小鼠),并通过共生手术将这些小鼠的体循环与三个月大的WT或APP/PS1小鼠结合起来(图2)。
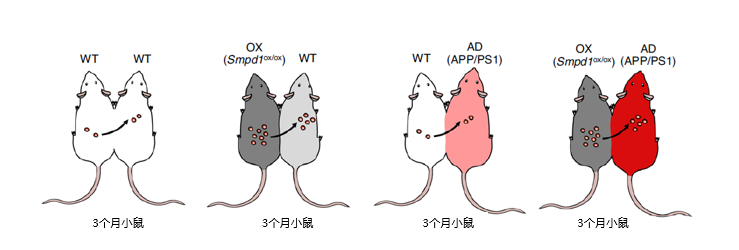
图2. 采用共生手术将小鼠分成WT-WT、OX-WT、WT-AD、OX-AD组别
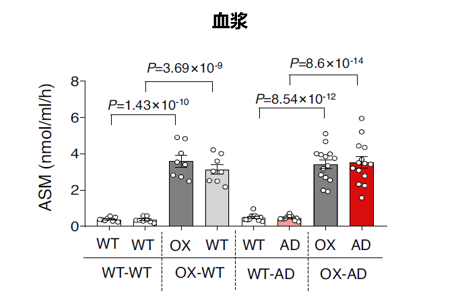
研究人员发现,在进行共生手术后的五周内,与WT-WT和WT-AD共生小鼠相比,OX–WT和OX-AD共生小鼠组的血浆ASM活性发生了明显增加(图3)。
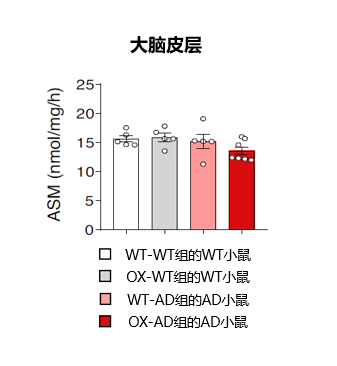
图3. WT-WT、OX-WT、WT-AD、OX-AD小鼠的血浆ASM活性与此同时,研究人员在小鼠血浆中并未发现神经酰胺水平出现显著差异。为了确定血浆ASM活性的增加是否伴随着大脑内指标的变化,研究人员测量了这些小鼠大脑皮层中ASM的活性程度。与血浆ASM的测定结果相反,大脑皮层中的ASM活性没有差异,这表明通过与ASM过度表达小鼠的共生关系而结合的年轻的WT和APP/PS1小鼠的血浆ASM活性的增加具有特异性(图4)。图4. WT-WT、OX-WT、WT-AD、OX-AD小鼠的大脑皮层ASM活性
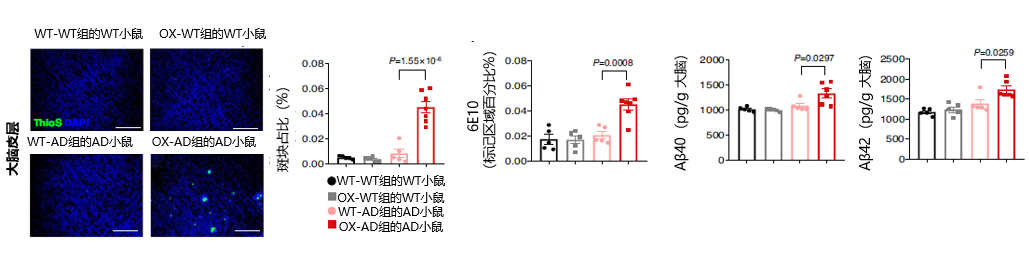
进一步研究发现,尽管大脑皮层ASM活性没有变化,但与ASM过度表达Tie2-cre;Smpd1ox/ox小鼠的血液交换的年轻APP/PS1小鼠的海马体中发生早期Aβ积聚和小胶质细胞活化(图5)。
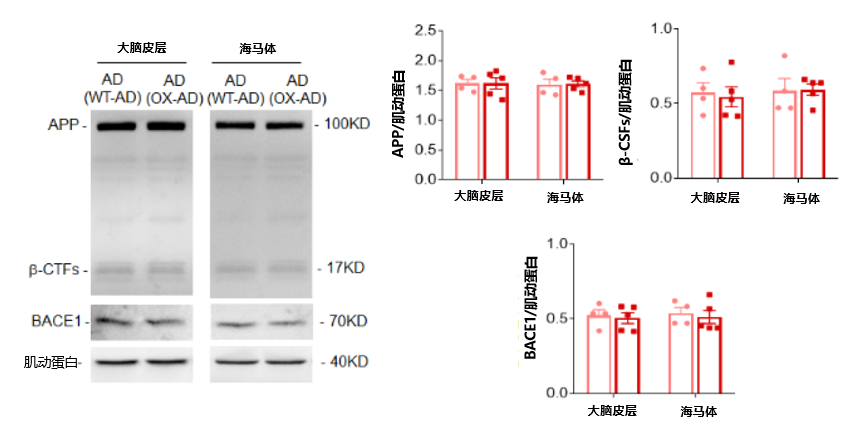
总的来说,这些结果表明,尽管脑组织ASM活性没有升高,但血浆ASM活性的过度表达加速了年轻APP/PS1小鼠大脑中Aβ的积累、神经炎症和小胶质细胞吞噬功能的降低。研究小组对Aβ积聚的情况进行进一步研究,发现这些小鼠大脑皮层的早期Aβ积累与APP以及Aβ生成酶BACE-1的表达无关(图6)。图6. 实验组小鼠大脑皮层与海马体中APP、BACE1等的表达情况血浆ASM升高诱导CD4+T细胞凋亡和致病性Th17细胞分化
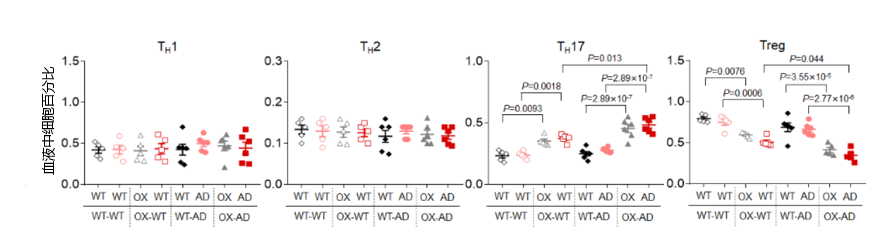
此前相关研究表明,在AD患者和小鼠模型的大脑中发现了血液来源的免疫细胞,包括中性粒细胞、单核细胞和淋巴细胞。此外,一些白细胞亚群的变化也与AD脑组织中Aβ的积聚、小胶质细胞介导的神经炎症有关。研究人员发现,与WT-WT和WT-AD小鼠相比,OX-WT和OX-AD小鼠的血液中出现CD4+T细胞显著减少。其他白细胞亚群如中性粒细胞、单核细胞、巨噬细胞、CD8+T细胞和B220 B细胞的变化在不同组别的小鼠之间没有显著差异。研究团队进一步探究小鼠中CD4+T细胞的亚群细胞的改变,发现与WT–AD和WT–WT小鼠相比,OX-WT和OX-AD组小鼠血液中的Th17细胞显著增加,Treg细胞显著减少(图7)。这些发现表明,血浆ASM升高可能影响年轻APP/PS1小鼠脾脏和血液中CD4+T细胞的存活和Th17细胞的分化,并且血液中的相关可能导致大脑中继发出现类似的变化。此外,对OX-AD组的AD小鼠的相关数据进行分析,可以推断,血液来源的Th17细胞可能参与了小胶质细胞介导的神经炎症和早期的Aβ积聚。随后,研究人员进一步证实,血浆ASM活性的升高能够增强CD4+T细胞向Th17细胞的分化。CD4+T细胞膜ASM活性和神经酰胺的提高,能够通过刺激下游信号如STAT3、JNK、AKT和mTOR,进而导致细胞凋亡和致病性Th17细胞分化。研究人员随后研究了在共生情况下血浆ASM抑制对AD相关病理的影响。研究人员设置了Smpd1−/−小鼠,其体内存在ASM抗体,因此该类小鼠的体循环为ASM抑制状态。ASM敲除-AD(Smpd1−/−–APP/PS1)小鼠对比AD-AD与WT–AD小鼠出现了血浆ASM的降低。此外,ASM敲除-AD小鼠出现了血管周围脑区致病性Th17细胞的减少。AD患者通常在血脑屏障中会出现的病理损伤(血脑屏障紧密连接的渗透性破坏以及血管结构破坏)也随之减少。大脑皮层和海马体中的小胶质细胞和星形胶质细胞活化降低,其相关的吞噬功能也进一步恢复。此外,这些保护作用可预防APP/PS1小鼠的早期Aβ积聚、脑淀粉样血管病,甚至突触丢失。这些发现表明,基于抗体抑制血浆ASM活性,可以减少APP/PS1小鼠血液和大脑中的致病性Th17细胞,从而防止血脑屏障的破坏、神经炎症、Aβ积聚和突触丢失。
在该研究中,研究团队使用共生小鼠模型揭示了血浆ASM活性升高对AD神经病理学关键特征的影响。年轻的AD小鼠在暴露于ASM过度表达小鼠的血液后,表现出Aβ的加速积聚与神经炎症的加速发生。血液中过度表达的ASM诱导CD4+T细胞分化为致病性Th17细胞,并加速了年轻AD小鼠大脑的病理变化。通过与ASM敲除小鼠共享循环系统,研究团队还发现,ASM抑制的环境能够对AD小鼠的各种病理特征产生预防作用。
研究表明,靶向血浆ASM的抗体免疫疗法可能成为一种具有临床应用价值的AD预防和治疗方法。在AD的小鼠模型中,该疗法的应用可降低ASM含量,从而调节Th17细胞以达到预防AD的效果。当然,关于靶向血浆ASM的抗体免疫疗法仍需要更多的相关研究来证实其疗效,在攻克阿尔茨海默病难关的道路上,我们仍需坚定前行。