CAR-T疗法(嵌合抗原受体T细胞疗法)是一种精准、高效的免疫疗法。CAR能够靶向GD2(双唾液酸神经节苷脂)并激活T细胞,通过基因技术可将T细胞改造为表达CAR的CAR-T细胞,从而精准杀伤表达GD2的肿瘤。CAR-T疗法是复发/难治性或转移性神经母细胞瘤等实体瘤患者的重要选择之一。
GD2在健康组织中表达极低,而在神经母细胞瘤等多种肿瘤细胞外膜上高度表达,这种差异使其成为抗神经母细胞瘤治疗的理想靶点1。既往研究已经表明,抗GD2免疫治疗与高危神经母细胞瘤患者的生存率显著增加有关2-3。
2023年4月,Francesca Del Bufalo 团队在New England Journal of Medicine 上发表了题为GD2-CART01 for Relapsed or Refractory High-Risk Neuroblastoma 的文章,揭示了临床应用第三代靶向GD2的自体CAR-T细胞治疗复发/难治性高危神经母细胞瘤的可行性和安全性4。

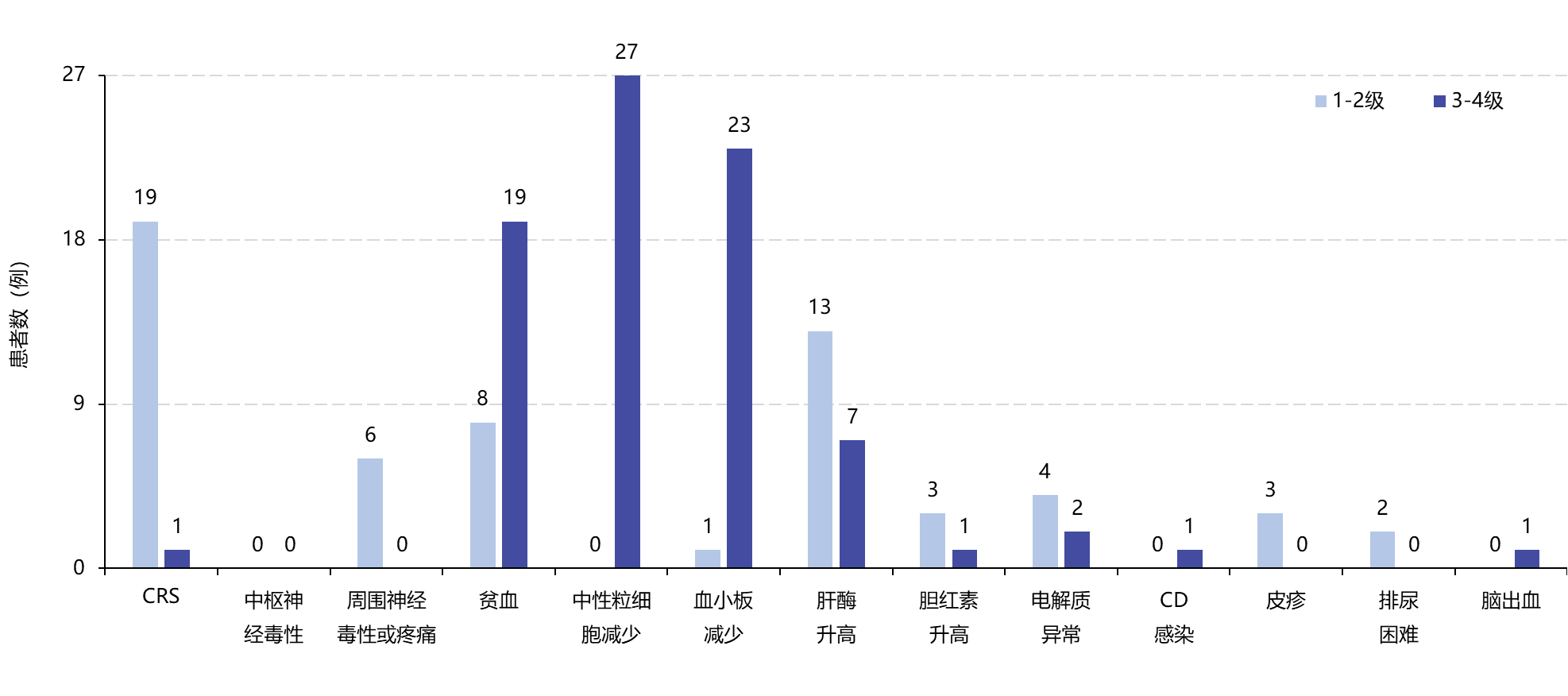
本研究是一项开放标签、1/2期临床研究,纳入27例复发或难治性高危神经母细胞瘤患者,包括复发性患者14例,难治性患者12例,一线治疗后无疾病证据的患者1例;其中78%的患者伴骨受累,44%的患者伴骨髓受累。患者接受氟达拉滨+环磷酰胺的淋巴衰竭化疗后,进行第三代靶向GD2的自体CAR-T(CAR-T01)细胞输注。第三代CAR构建物包含CD28和4-1BB两个共刺激结构域,同时引入诱导型Caspase 9(iC9)自杀基因作为“安全开关”。1期治疗剂量为3×106/kg、6×106/kg或10×106/kg,旨在评估CAR-T01治疗复发/难治性高危神经母细胞瘤的安全性和可行性;2期使用推荐剂量10×106/kg,旨在评估CAR-T01输注6周后的抗肿瘤效果及患者远期生存情况。所有患者均成功制备CAR-T01细胞。1期研究确定了CAR-T01细胞的推荐治疗剂量为10×106/kg。研究期间,患者整体安全性可控,未见剂量限制性毒性。所有患者均出现严重血液学毒性反应,这与淋巴衰竭有关;最常见的不良反应为细胞因子释放综合征(CRS)。见图1。图1. 复发/难治性高危神经母细胞瘤患者首次输注CAR-T01后不良事件发生情况CRS:细胞因子释放综合征;CD:艰难梭菌感染
研究人员通过流式细胞仪检测,发现CAR-T01输注后1-2周可观察到T细胞扩增的峰值,见图2。其中75%的可评估患者CAR-T01持续至少3个月。说明CAR-T01细胞可在神经母细胞瘤患者体内大量增殖。
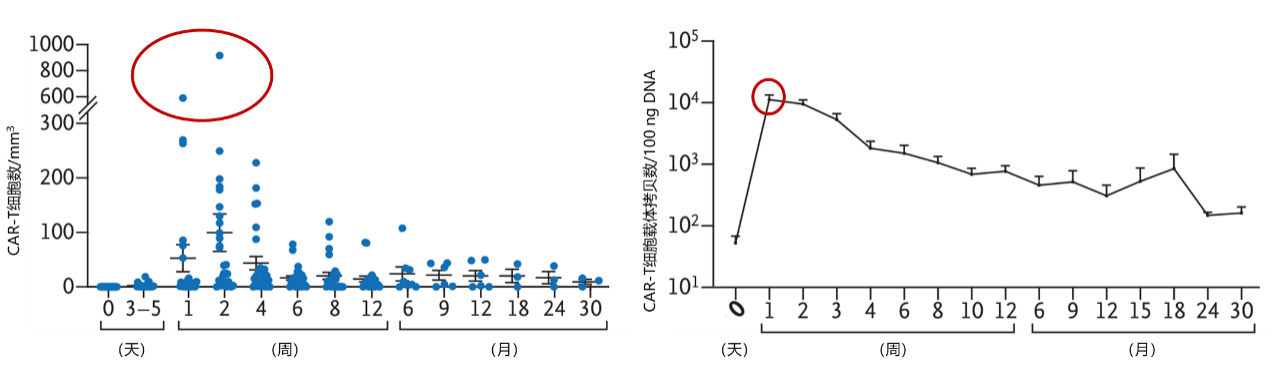
图2. CAR-T01输注后的扩增情况
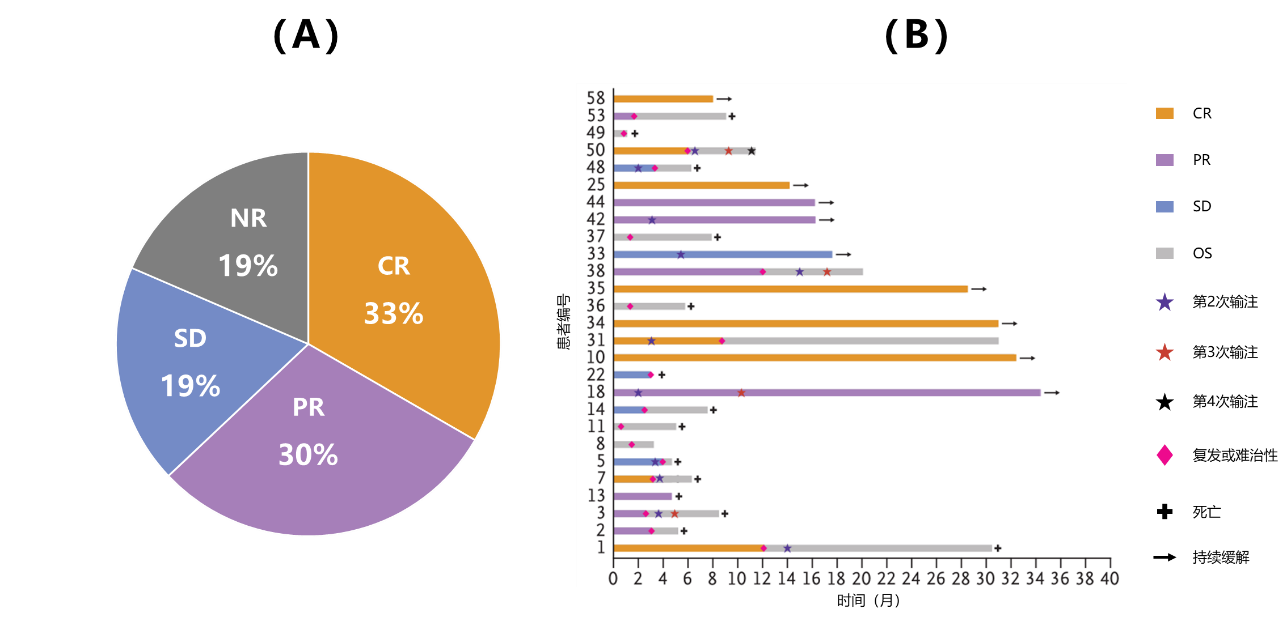
研究人员发现,CAR-T01输注6周后,完全缓解(CR)率为33%,客观缓解(ORR)率为63%;中位随访1.7年,仅有5例(19%)患者维持CR。见图3。
图3. 复发/难治性高危神经母细胞瘤患者接受CAR-T01治疗6周后的缓解情况(A)以及每位患者的治疗结果(B)CR:完全缓解;PR:部分缓解;SD:疾病稳定;NR:无反应;OS:总生存研究者进一步发现,治疗后患者MIBG亲和性明显降低,见图4。1例患者颈部和锁骨上淋巴结病灶最大径从88mm减少到58mm(减少34%);另1例患者腹腔病灶最大径从88mm减少到48mm(减少46%),MIBG亲和性明显降低。说明肿瘤大小和MIBG亲和性降低相关。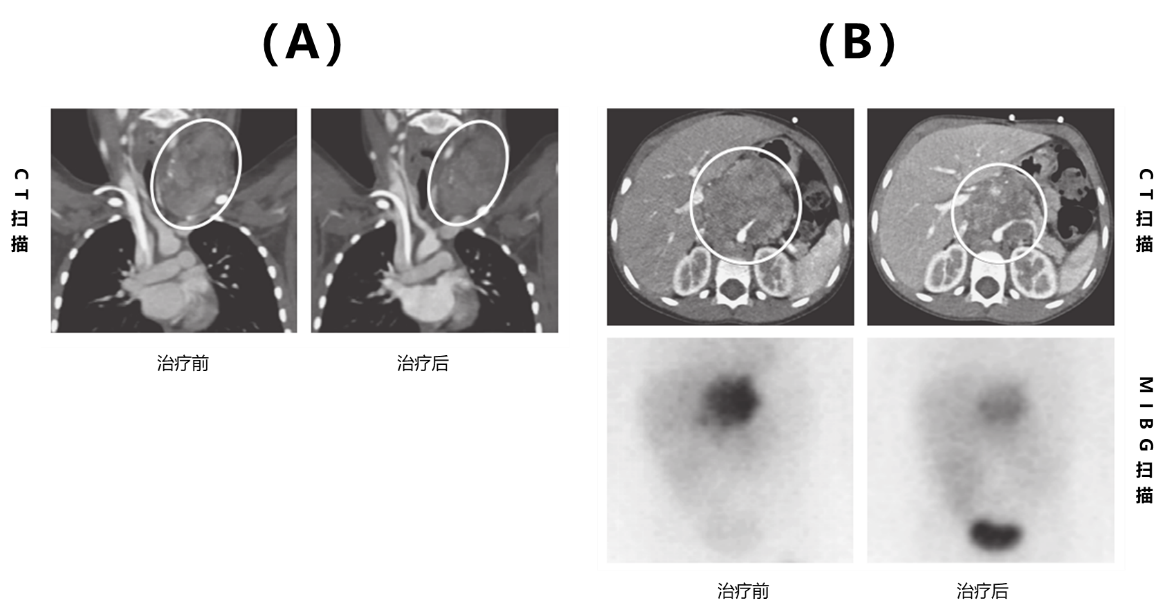
图4. CAR-T01治疗后复发/难治性高危神经母细胞瘤患者颈部和锁骨上淋巴结(A)及腹腔肿块(B)的影像学扫描
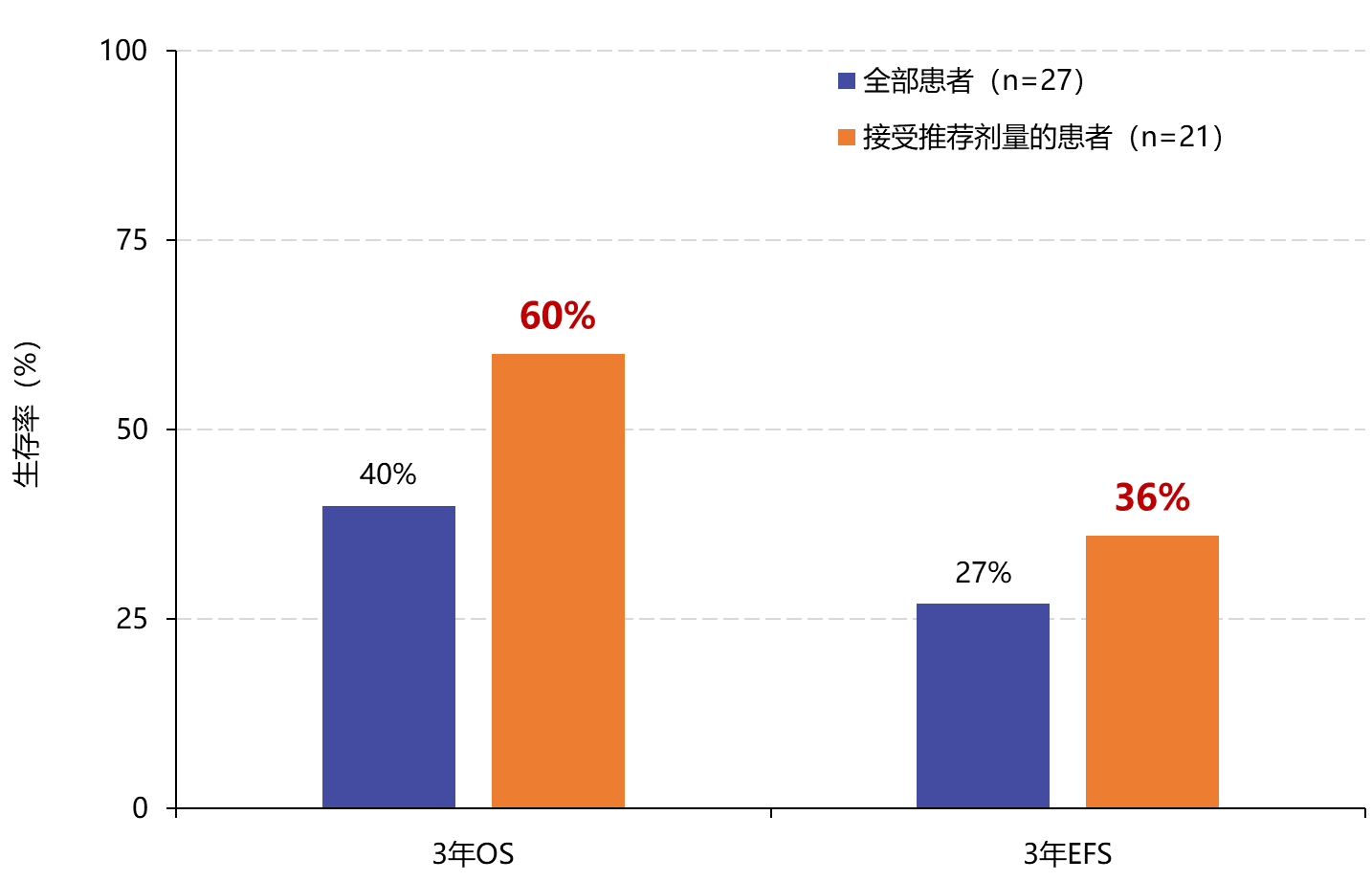
接下来,研究者发现,接受CAR-T01(10×106/kg)治疗的患者3年总生存(OS)率为60%,3年无事件生存(EFS)率为36%,见图5,说明CAR-T01细胞可诱导免疫相关反应,引起持续的临床反应。
图5. 复发/难治性高危神经母细胞瘤患者接受CAR-T01治疗的远期生存情况EFS:无事件生存
研究者还发现,肿瘤负荷低的患者生存期显著优于肿瘤负荷高(肿瘤最大径≥5cm或骨髓浸润>50%或MIBG SIOPEN评分>7分)的患者,见图6。肿瘤负荷低的患者3年OS(67%)和3年EFS(58%)均显著高于肿瘤负荷高的患者(0%,0%)。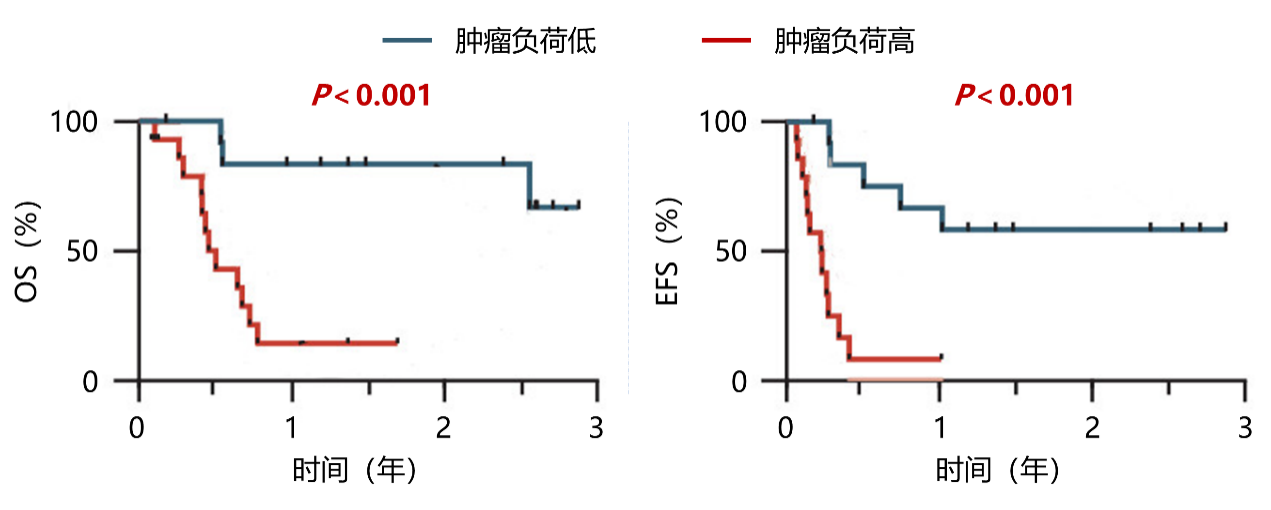 CAR-T01细胞能在体内大量增殖,具有持续抗肿瘤作用,治疗复发/难治性高危神经母细胞瘤可行性高,输注6周时CR率为33%,随访1.7年,19%的患者维持CR。CAR-T01治疗后,患者3年OS率为40%,3年EFS率为27%;且肿瘤负荷低的患者生存期显著优于肿瘤负荷高的患者。
CAR-T01细胞能在体内大量增殖,具有持续抗肿瘤作用,治疗复发/难治性高危神经母细胞瘤可行性高,输注6周时CR率为33%,随访1.7年,19%的患者维持CR。CAR-T01治疗后,患者3年OS率为40%,3年EFS率为27%;且肿瘤负荷低的患者生存期显著优于肿瘤负荷高的患者。
安全性方面,CAR-T01细胞治疗虽无中枢神经毒性和剂量限制性毒性,且不良反应可控,但该疗法的副作用不容忽视,本研究的大多数患者会出现CRS,CRS与白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、干扰素-γ和肿瘤坏死因子-α等细胞因子的血清峰值水平密切相关,且IL-6、IL-10水平也与CRS的严重程度相关。此外,所有患者均出现淋巴衰竭引起的严重血液学毒性反应,这主要与患者输注CAR-T01治疗前接受了化疗的疾病负荷较高,以及骨髓常见疾病等有关。
本研究表明CAR-T01疗法可能对部分复发或难治性神经母细胞瘤患者具有持续的抗肿瘤效果,临床正在探索其在高危神经母细胞瘤多模式治疗中的作用。然而,CAR-T细胞在每个患者体内的代谢适应度是未知的,并非所有神经母细胞瘤患者使用CAR-T疗法均具有良好的疗效。此外,神经母细胞瘤治疗过程中,GD2抗原丢失或突变会导致CAR-T01的靶向性丧失,免疫抑制细胞因子、骨髓来源的抑制细胞、T调节细胞等也可能影响疗效,造成CAR-T疗法的抗神经母细胞瘤效果不足。总而言之,CAR-T细胞疗法在多个方面仍然存在挑战,我们期待未来进一步增强其抗肿瘤活性、最小化其毒性、最大化其治疗范围,给更多神经母细胞瘤患者带来更好的疗效。
参考文献:
1. Yeku OO, Longo DL. CAR T Cells for Neuroblastoma. N Engl J Med. 2023;388(14):1328-1331.2. Holger Lode, Karoline Ehlert, Stephanie Huber, et al. Single agent activity of the Anti-GD2 antibody dinutuximab beta long-term infusion in high-risk neuroblastoma patients with relapsed and refractory disease. A multicenter phase II trial. SIOP 2022 abstract. O147 / #13433. Wieczorek A, Zaniewska-Tekieli A, Ehlert K, et al. Dinutuximab beta combined with chemotherapy in patients with relapsed or refractory neuroblastoma. Front Oncol. 2023;13:1082771.4. Del Bufalo F, De Angelis B, Caruana I, et al. GD2-CART01 for Relapsed or Refractory High-Risk Neuroblastoma. N Engl J Med. 2023;388(14):1284-1295.gan