导 语
神经母细胞瘤以其迅速的进展、不良的预后以及早期转移的高发性而著称,近半数患者在确诊时就已发现肿瘤转移。更为关键的是,治疗初期的转移状况与患者的预后紧密相关。因此,在神经母细胞瘤的整个诊疗过程中,对病灶的准确评估显得尤为重要,它对于疾病的诊断、治疗、随访监测以及预后评估都具有举足轻重的意义1-3。
核医学成像
MIBG和PET-CT
与传统影像学检查相较,核医学成像技术以其更高的敏感性和特异性,在神经母细胞瘤的诊断中展现出了显著优势。其中,碘-间碘苄胍(I-MIBG)全身显像和正电子发射计算机断层扫描(PET-CT)更是被国内外神经母细胞瘤诊疗指南一致推荐为重要的核医学成像方法5-6。
碘-间碘苄胍(I-MIBG)全身显像可明确显示神经母细胞瘤在患儿全身软组织、骨骼等处分布的位置、数量和大小,其诊断敏感性为88%~92%,特异性为83%~92%7,是检测高危神经母细胞瘤残留骨转移病灶最灵敏的方法8。
然然而,值得注意的是,约有10%的神经母细胞瘤病灶并不具有MIBG活性,这在一定程度上限制了MIBG的应用范围。对于这部分不摄取MIBG的患者,PET-CT则成为了一种有效的替代检测手段。PET-CT虽然特异性略低于MIBG,但其空间分辨率高、成像速度快、辐射负荷小等显著优点,使其在神经母细胞瘤的诊断中同样具有重要价值6-7。
一项纳入了40项研究、共计1134例神经母细胞瘤患者的荟萃分析,对MIBG和PET-CT在神经母细胞瘤诊断中的效能进行了全面比较。结果显示,两者在整体诊断效能上相当,但在具体病灶的分析上,PET-CT展现出了更高的精确性。因此,该分析认为PET-CT可能是神经母细胞瘤分期的首选方式9。这一结论为神经母细胞瘤的精准诊断提供了有力依据,也进一步凸显了核医学成像技术在神经母细胞瘤诊疗中的重要地位。
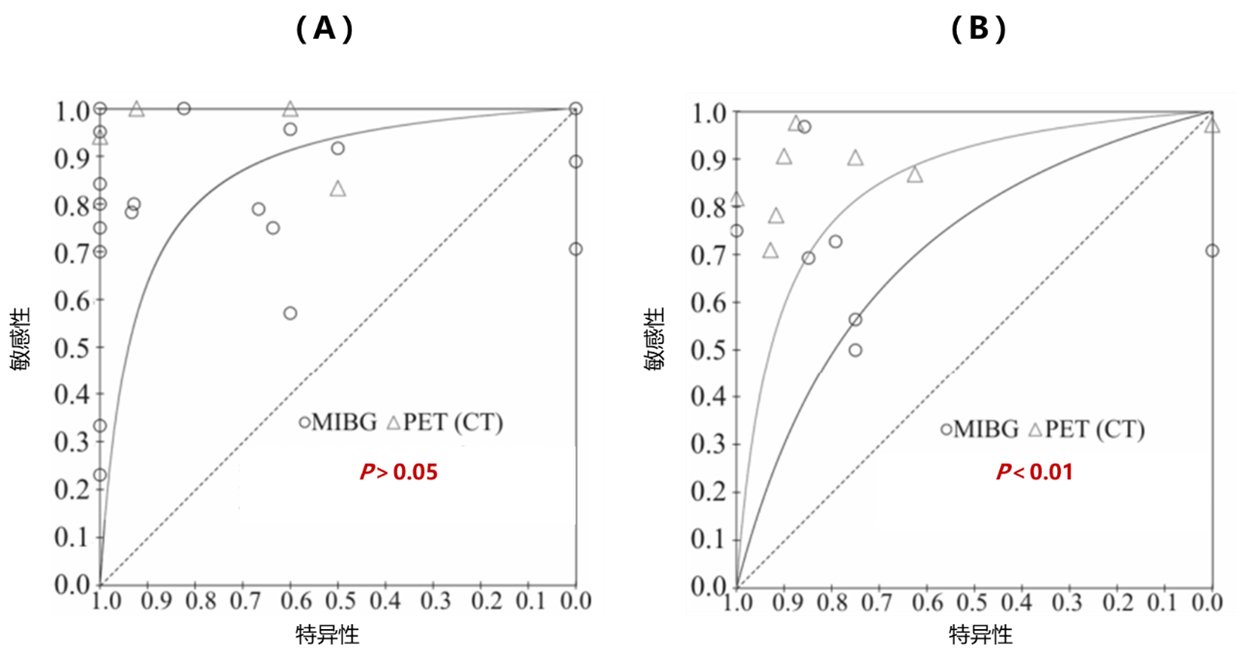
图1. MIBG和PET-CT诊断神经母细胞瘤(A)和基于病灶进行疾病分期(B)的特征曲线分析
根据所述内容,我们不难发现,PET-CT与MIBG在神经母细胞瘤的诊断上展现出了相似的效能,并且它们各自具有独特的优势,使得适用范围更加广泛。这一点在《神经母细胞瘤核医学成像指南》中得到了明确指出:PET-CT和MIBG两者之间存在优势互补的关系。通过将这两种成像方式结合使用,可以极大地提高诊断的准确性,甚至能够检测出单独使用任何一种检查手段都难以发现的疾病部位7。
Ga-DOTA和Cu-NOTA
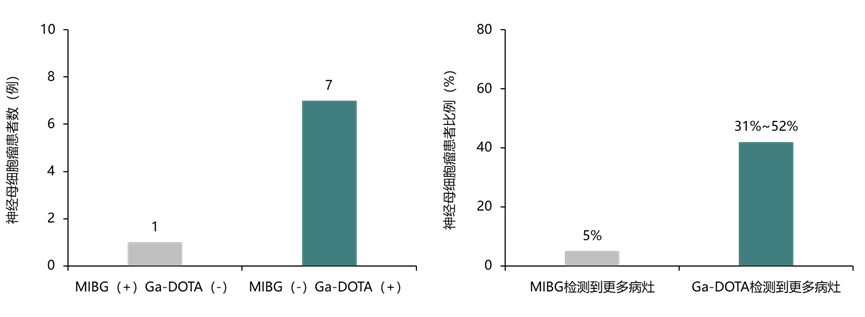
NOTA与DOTA均归类于生长抑素类似物(SSA),它们能特异性地与神经母细胞瘤表面的生长抑素受体(SSTR)结合。相较于DOTA,NOTA展现出了与放射性核素Cu更高的亲和力及更稳定的结合特性,从而有效降低了意外辐射暴露的潜在风险,成为了一种更为理想的耦联选项10。
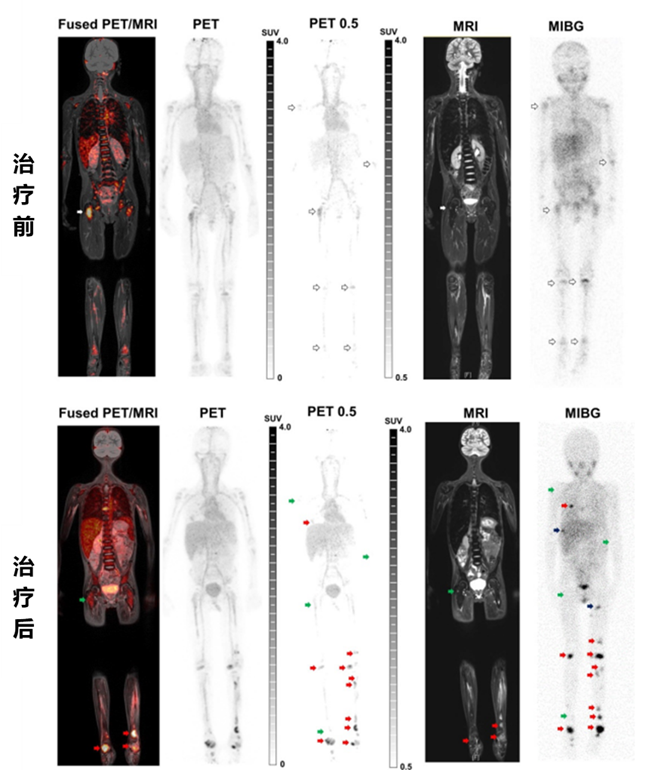
此外,该研究还发现,Cu-NOTA-GD2 PET在检测某些新骨病灶方面可能存在局限性。然而,当与MIBG和MR显像技术结合使用时,其检测效果得到了显著提升(见图3)。这表明,Cu-NOTA-GD2 PET不仅可用于指导GD2免疫治疗的实施,还能与其他显像方法相辅相成,共同提高检测的灵敏度和特异性。
骨髓活检及特异性标志物检测
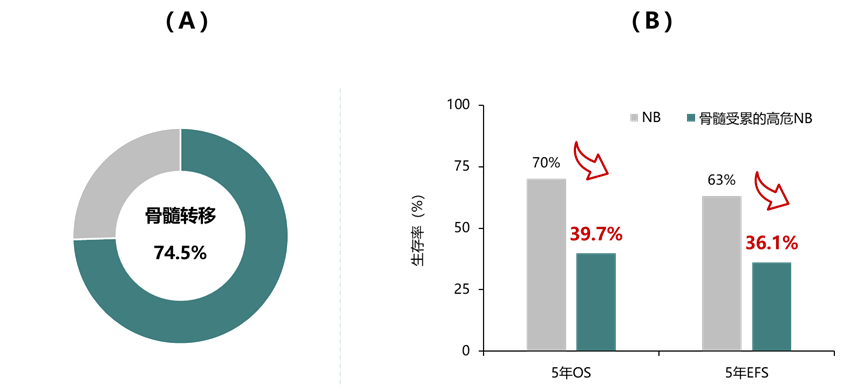
骨髓是神经母细胞瘤最常见的转移部位,74.5%的高危神经母细胞瘤患者伴有骨髓转移,并且骨髓受累患者的预后相对更差1,11-12,见图4。因此,对骨髓受累的准确评估对于疾病的正确分期、风险分层的确定以及后续治疗方案的制定具有举足轻重的意义。在神经母细胞瘤的诊断与评估流程中,骨髓转移病灶的检测无疑是一个关键环节。
目前,骨髓活检(BMB)被视为评估神经母细胞瘤患者骨髓受累状况的金标准。通过检测如同源异型盒蛋白2B(PHOX2B)等特异性标志物,BMB的准确性得到了显著提升,使得骨髓病灶的评估更为精确1。为了进一步探究BMB与其他诊断手段在骨髓受累评估中的价值差异,一项回顾性研究应运而生。
该研究纳入了188例神经母细胞瘤患者,研究结果显示,相较于BMB单独使用,结合PHOX2B检测(无论是骨髓还是血液样本)以及PET-CT的诊断效能均展现出了明显的优势1(见图5)。这一发现不仅强调了多种诊断手段联合应用的重要性,也为神经母细胞瘤患者骨髓受累的评估提供了更为全面、准确的策略选择。
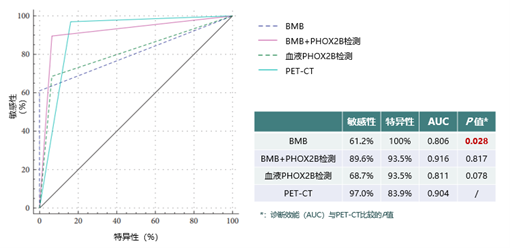
图5.不同检查方式对神经母细胞瘤骨髓受累的诊断效能
该研究还显示,PET-CT评估骨髓受累的敏感性较高,而BMB评估骨髓受累的特异性较高,二者结合有助于进一步提升神经母细胞瘤病灶评估的准确性。

参考文献
1. Liu J, et al. Contrast Media Mol Imaging. 2022 Jan 6;2022:7556315.
2. Samim A, et al. J Pers Med. 2021;11(4):270.
3. Wang Y, et al. Contrast Media Mol Imaging. 2021 Sep 1;2021:5333366.
4. Barr EK, et al. Pediatr Blood Cancer. 2020;67(10):e28390.
5. 中国抗癌协会小儿肿瘤专业委员会,等.中华小儿外科杂志,2022,43(7):588-598.
6. Park JR, et al. J Clin Oncol. 2017;35(22):2580-2587.
7. Bar-Sever Z, et al. Eur J Nucl Med Mol Imaging. 2018;45(11):2009-2024.
8. Matthay KK, et al. Br J Cancer. 2010;102(9):1319-1326.
9. Xia J, et al. J Huazhong Univ Sci Technolog Med Sci. 2017 Oct;37(5):649-660.
10. Schmitt J, et al. Theranostics. 2022;12(13):5615-5630.
11. Su Y, et al. Pediatr Investig. 2020 Sep 27;4(3):157-167.
12. 范洪君,等.中华儿科杂志,2019,57(11):863-869.
13. Burchill SA, et al. Cancer. 2017;123(7):1095-1105.












