疑贰之见——β淀粉样蛋白假说还可信吗?
阿尔茨海默病(AD)的致病过程由多种机制和因素参与其中,包括淀粉样蛋白瀑布假说、Tau蛋白的过度磷酸化假说、氧化应激和炎症级联假说等。其中,淀粉样蛋白瀑布假说是AD领域研究最广泛的一个假说,该假说的核心观点为“Aβ在各类脑组织中的超常积累以及聚集形成的β-淀粉样斑块而导致AD的发生发展”。 但前段时间的学术丑闻,让本就负重前行的AD研究“雪上加霜”。本文将从Aβ的源头谈起,论证β淀粉样蛋白假说是否还有探索的价值。
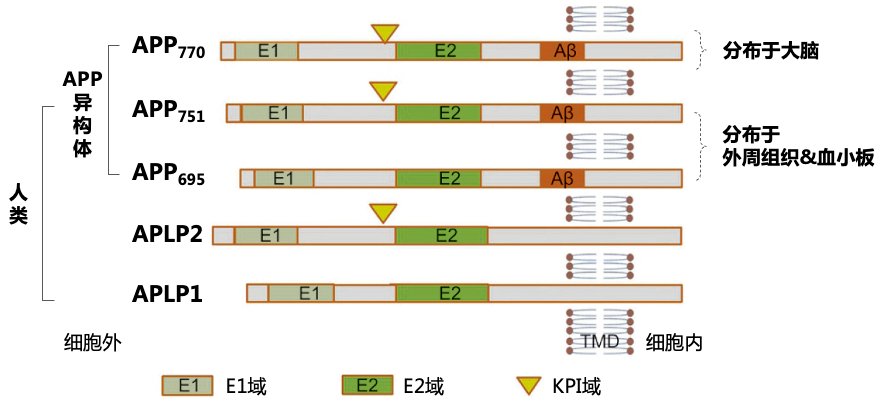
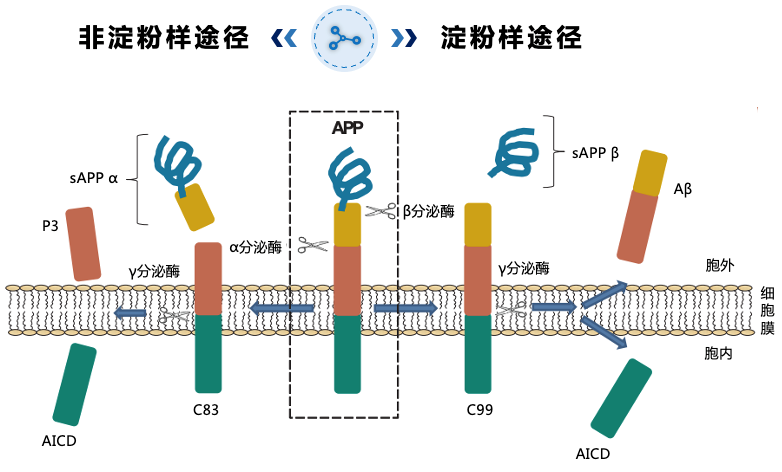
图2. Aβ的形成过程
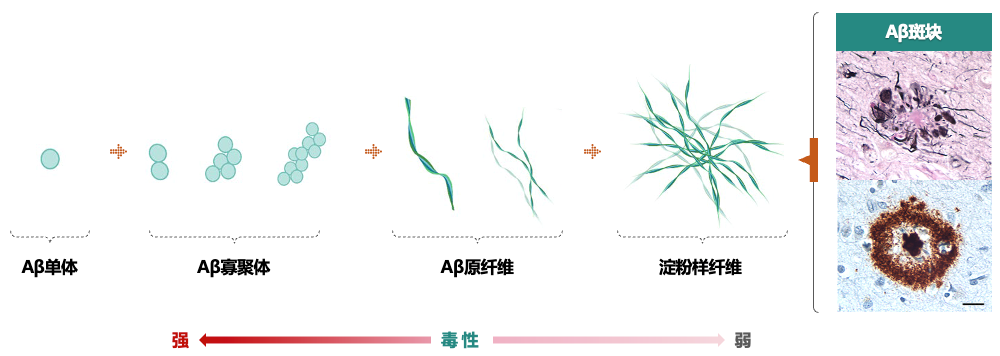
图3. Aβ的聚集过程


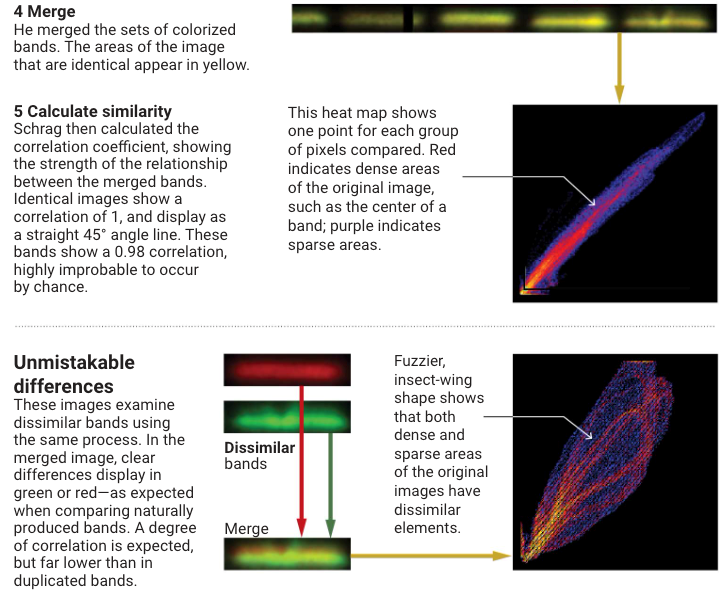
图3. Science官网截图
事情的起因是Sylvain Lesné团队于2006年发表在《Nature》杂志上的一篇名为《A specific amyloid-β protein assembly in the brain impairs memory》的文章,他们首次发现并分离出了一种名为Aβ*56的Aβ寡聚体,并认为它会导致转基因鼠痴呆。这篇文章当时被认为是Aβ寡聚体领域的重要奠基性研究,在本世纪已被引用了2300余次。但据最新的调查报告显示,该文章中涉及到Aβ*56的图像有明显的PS痕迹,实验结果完全是子虚乌有。
虽然Aβ*56系学术造假的产物,那风靡已久的β淀粉样蛋白假说真就变的一无是处吗?
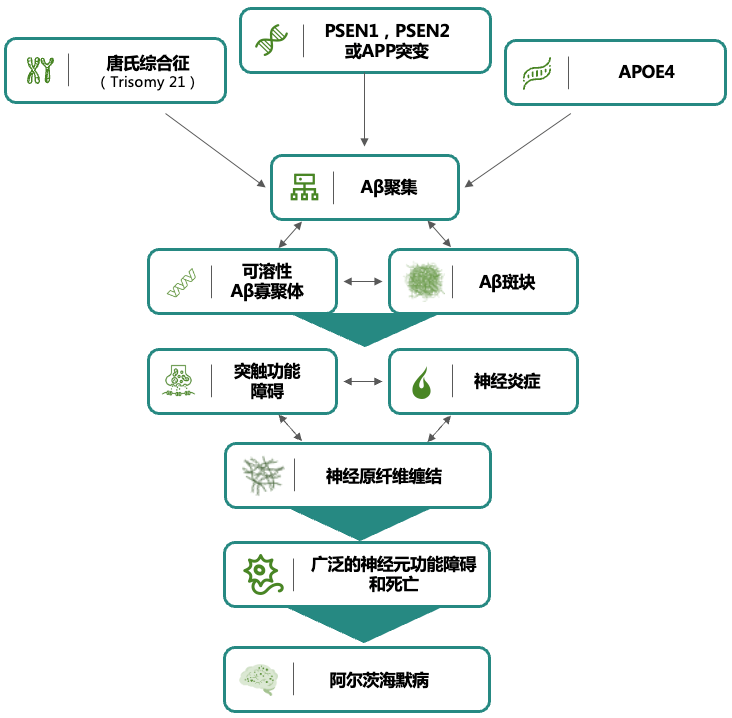
图5. β淀粉样蛋白假说
参考文献
作者:歆语健康
友情链接 歆语健康—上海歆语网络科技有限公司
互联网药品信息服务资格证书编号:(沪)-非经营性-2022-0087












