高危神经母细胞瘤患者复发率高、预后差,长期生存率不足50%1。治疗后微小残留病灶是导致复发的重要原因。造血干细胞移植能在强力杀伤肿瘤的基础上实现免疫重建,而联合移植后双唾液酸神经节苷脂(GD2)免疫维持治疗后可进一步消除残余肿瘤细胞,给神经母细胞瘤患者带来持续缓解和长期生存获益。
现将1例接受自体造血干细胞移植(ASCT)和GD2免疫维持治疗的M期高危腹膜后神经母细胞瘤患儿病例报告如下。患儿男,诊断年龄2岁7月,2021年8月9日因“发现腹部包块1天”入院就诊。诊断时一般情况可,心肺无特殊。腹部稍显膨隆,上腹部可触及10 cm×8 cm大小包块,质地韧,边界不清,无触痛,无发热、呕吐、腹痛、腹泻症状。2021年8月8日,门诊超声显示肝脏实质性占位病变,考虑肿瘤合并破裂出血;门静脉声像异常,考虑门静脉血栓形成。实验室检查结果显示血红蛋白97 g/L,稍低于正常值;天门冬氨酸氨基转移酶(AST)78 IU/L,较正常值明显升高;乳酸脱氢酶2276 IU/L,较正常值明显升高;纤维蛋白1.99 g/L,较正常值明显下降。2021年8月9日,肿瘤标志物检查显示,神经元特异性烯醇化酶(NSE)为348.2 ng/mL,尿香草基扁桃酸(VMA)为0.35 ,较正常值均明显升高。8月10日,胸部CT、全腹部CT平扫及增强CT(见图1)显示,腹腔巨大占位,考虑肿瘤来源于腹膜后,病灶侵犯左肾及肝门可能;腹膜后及纵膈淋巴结肿大;腹腔少量积液(不除外肿瘤包膜破裂),考虑神经母细胞瘤可能。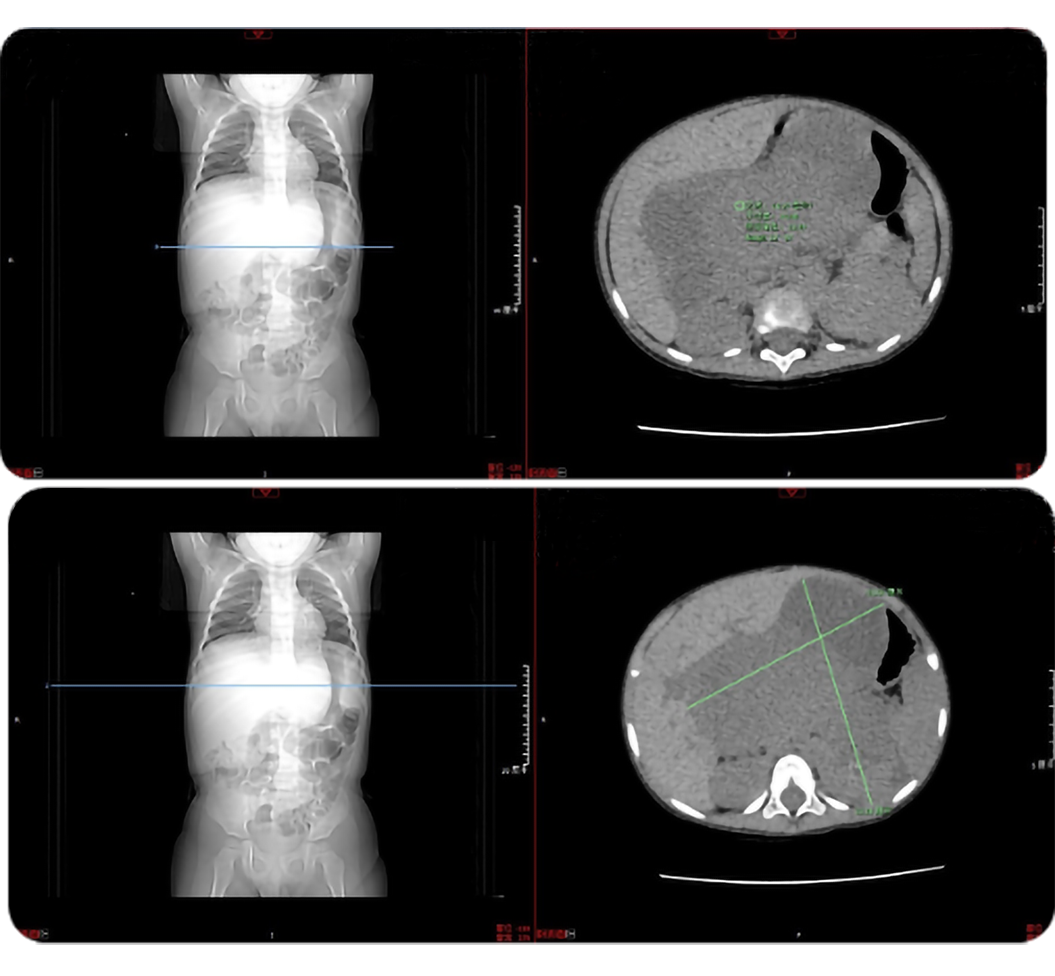
图1. 患儿胸部CT、全腹部CT平扫及增强CT检查结果
2021年8月14日, PET-CT(见图2)显示中上腹腔见多发不规则巨大囊实性占位,最大层面约14.7 cm×12.2 cm×13.7 cm,实性区代谢增高,考虑为恶性肿瘤,以神经母细胞瘤可能大;左侧膈上、膈肌脚后间隙、右肾门区及腹膜多发高代谢肿大淋巴结影及高代谢软组织包块,考虑伴有转移。
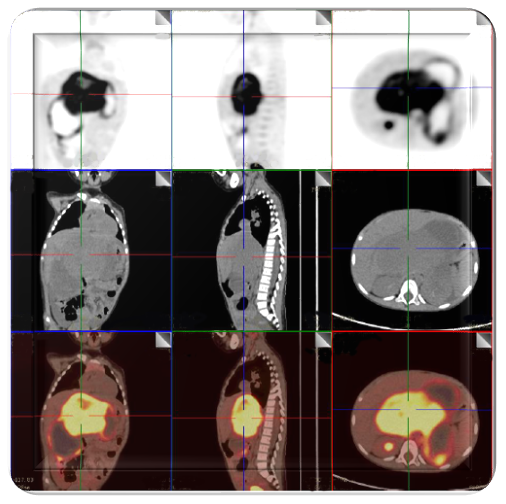
图2. 患儿PET-CT检查结果
2021年8月13日,骨髓细胞学检查显示右髂后增生活跃,分类不明细胞占1.5%,全片见大量转移肿瘤细胞团,见图3。左髂后骨髓增生明显活跃,未见特殊细胞及寄生虫。骨髓双侧髂后流式细胞学检查显示,骨髓神经母细胞瘤表型即表达CDC81、CD56、GD2,不表达CD45的细胞。8月18日骨髓组织右髂后符合神经母细胞瘤骨髓转移,骨髓组织左髂后增生大致正常,未见肿瘤转移。9月1日骨髓N-MYC基因检测显示存在扩增可能。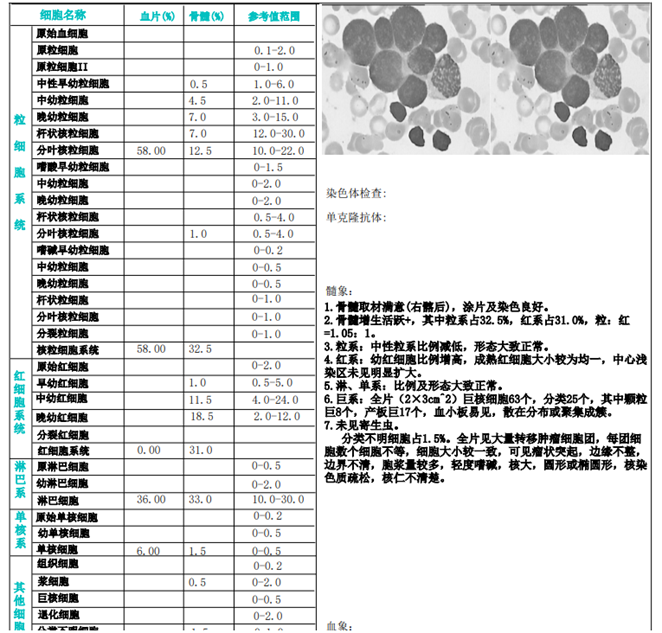
结合上述检查结果,最终该患者诊断为腹膜后神经母细胞瘤M期,高危组(骨髓、左肾、肝门、肠系膜淋巴结等多发转移)。
根据美国儿童肿瘤协作组(COG)的建议,患儿接受高危组治疗方案,包括诱导治疗、巩固治疗和维持治疗三个阶段,见图4。
诊断后,患儿于2021年8月17日开始接受诱导化疗,2个周期后进行自体干细胞采集;4个周期后,患儿于2021年11月7日行腹膜后肿瘤切除术,术后病理符合神经母细胞瘤,肿瘤组织N-MYC基因扩增仍为阳性;术后行2个疗程化疗。
6个周期诱导化疗后,患儿于2022年1月13日行PET-CT复查,显示“左上腹残余肿瘤病灶”;随后追加2个周期化疗,第一周期采用ITV方案化疗后,患儿出现严重腹泻,体重明显下降,第二周期更换为CAV方案化疗。患儿于2022年2月20日行肝周病损切除术,切下的组织经术后病理未见明显肿瘤残存;于2022年3月2日行胸腹部CT,显示肝左叶、肝门区及肝右叶低密度灶,病灶范围较前减小,结合病史,考虑感染性病变可能;于2022年3月4日骨髓涂片、流式、活检,均未见肿瘤细胞。患儿达到完全缓解(CR)状态。
患儿于2022年3月20日开始接受大剂量化疗联合ASCT巩固治疗。预处理方案为Bu-Mel(白消安+美法仑);于2022年3月27日回输自体造血干细胞;于2022年5月6日至2022年6月2日接受放疗。2022年6月10日,行腹部CT显示原肝左叶、肝门区及肝右叶低密度灶现未见显示;于2022年6月12日再次行骨髓涂片、流式、活检,均未见肿瘤细胞。患儿处于CR状态。
巩固治疗结束后,患儿开始GD2单抗达妥昔单抗β免疫维持治疗。于2022年7月4日,接受第1周期达妥昔单抗β输注+异维甲酸口服;于2022年8月12日,接受第2周期达妥昔单抗β输注+异维甲酸口服。2个周期后进行疾病评估,于2022年9月12日行PET-CT未见明显高代谢;于2022年9月15日行骨髓涂片、流式、活检,均未见肿瘤细胞。患儿持续处于CR状态。随后分别于2022年9月19日、10月24日和11月28日接受第3、第4和第5周期达妥昔单抗β输注+粒细胞-巨噬细胞集落刺激因子(GM-CSF)输注+异维甲酸口服治疗;于2023年1月19日接受异维甲酸口服治疗1个周期。见图5。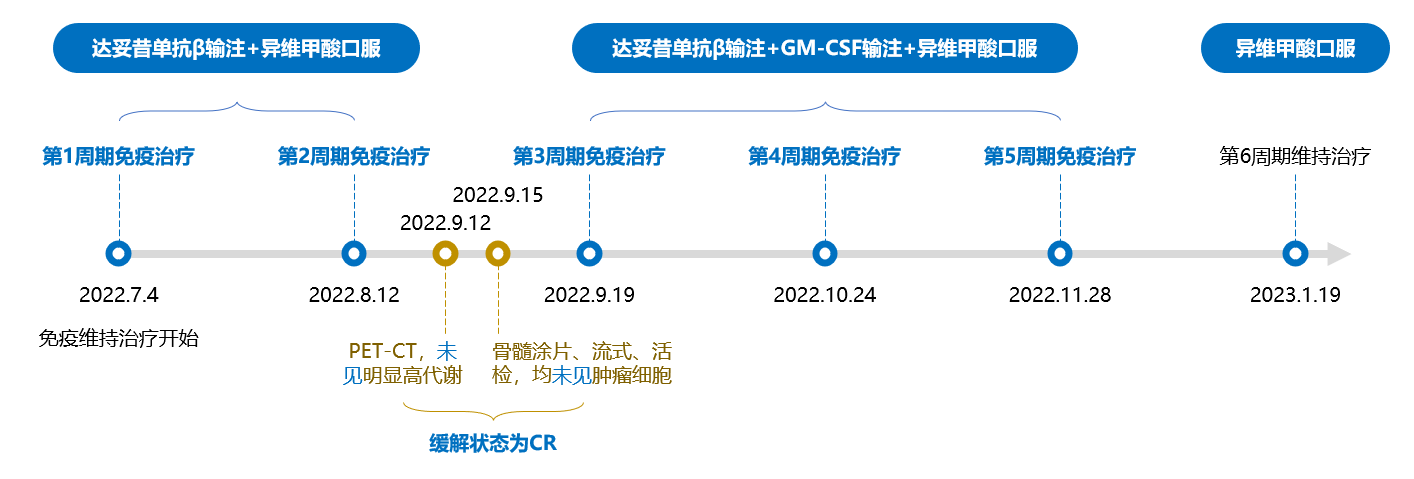
GM-CSF:粒细胞-巨噬细胞集落刺激因子
免疫治疗期间,患儿出现发热,肛周及会阴部皮肤瘙痒、疼痛,呕吐、腹泻、腹痛,浮肿、尿量减少以及骨髓抑制(主要表现为血小板、血红蛋白1-2度下降)等不良反应,在常规干预下均可缓解。第一周期免疫治疗期间,达妥昔单抗β于4月7日11时开始由慢到快输注,使用后24-48小时期间,患儿出现发热,给予药物治疗后体温缓慢下降,见图6。发热期间,结合血常规、超敏C反应蛋白等检查结果,考虑体温变化原因可能是免疫反应。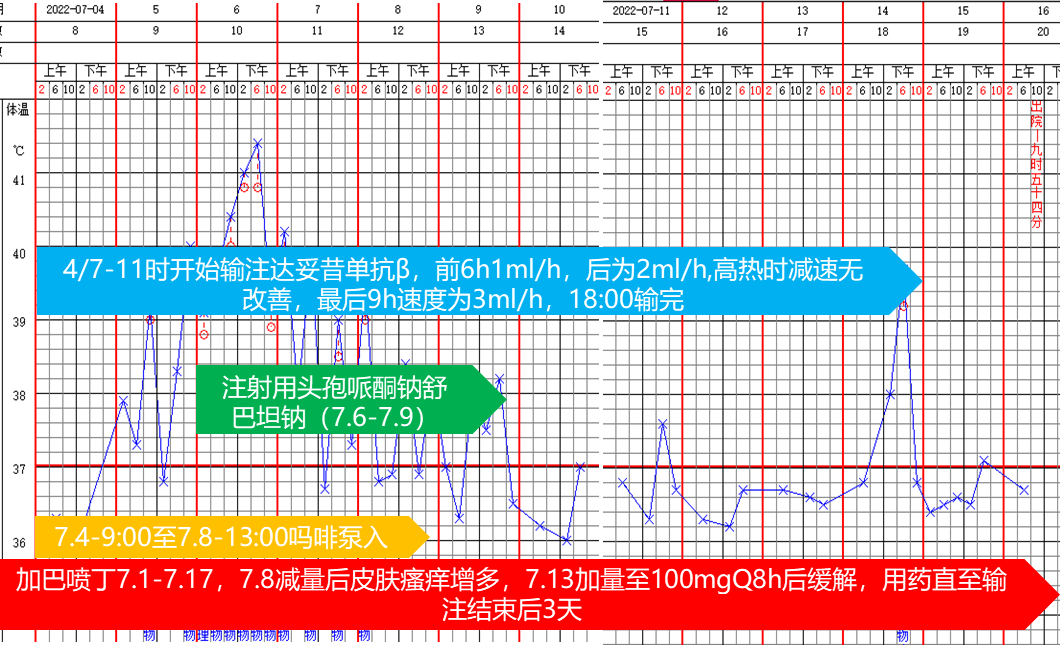
图6. 第一周期免疫治疗期间药物治疗及体温变化情况第二周期免疫治疗期间,患儿不良反应相对较少,精神状态更好。与第一周期免疫治疗相比,患儿最高体温更低,发热持续时间更短。治疗期间未使用抗生素,吗啡仅使用了1天,药物治疗及体温变化情况见图7。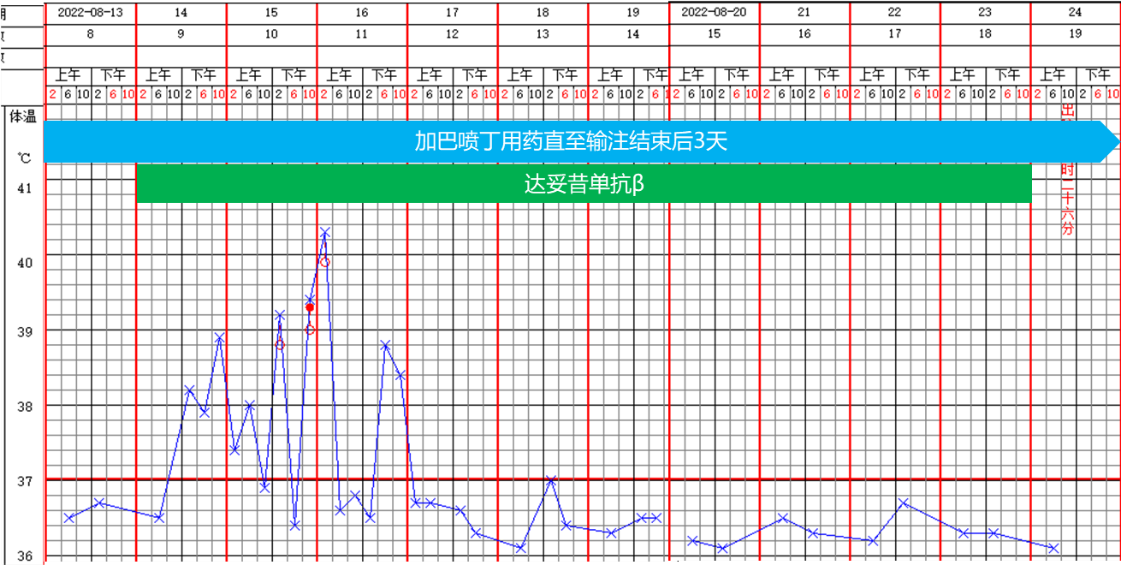
图7. 第二周期免疫治疗期间药物治疗及体温变化情况
第三周期免疫治疗方案中增加了GM-CSF,患儿不良反应相对前两个治疗周期更少,最高体温更低,发热持续时间更短,且患儿未使用吗啡镇痛(见图8)。第四和第五周期免疫治疗期间,患儿未再出现发热症状,说明随着免疫治疗的进行,患儿的不良反应逐渐减轻。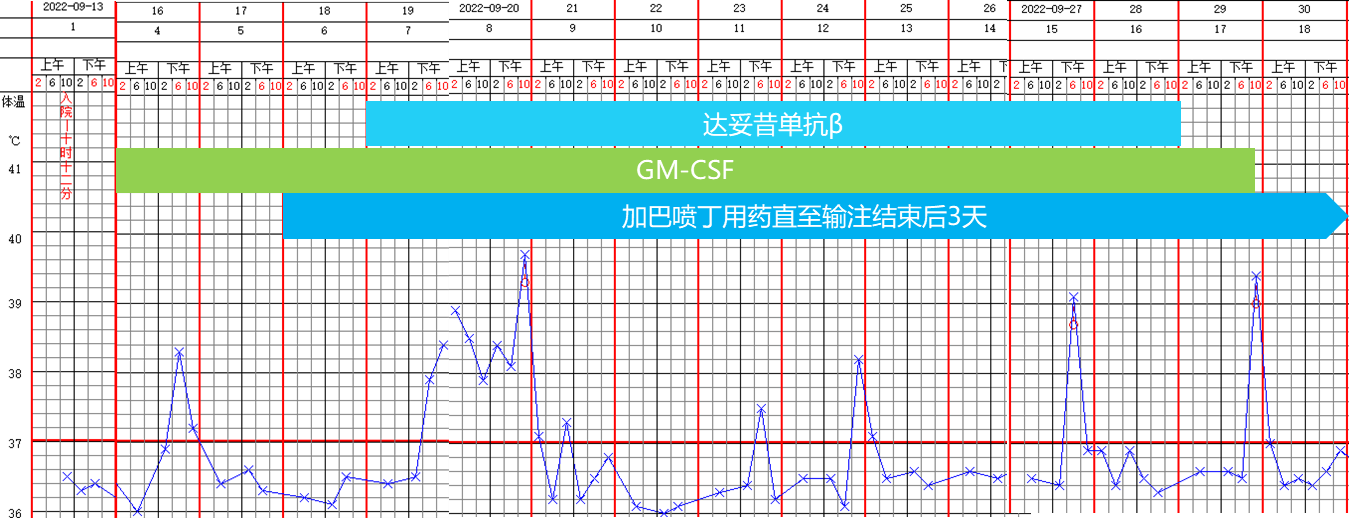
图8. 第三周期免疫治疗期间药物治疗及体温变化情况
患儿经过诱导、巩固和免疫维持治疗后,患儿疗效评估为持续CR。
2023年2月12日,患儿血常规显示NSE水平为14.3 ng/mL、VMA水平为3.1 mg/24h,均处于正常水平;血红蛋白106 g/L,稍微低于正常值;胸部+全腹CT平扫+增强显示肝S4-S7段片状异常强化区,范围较前缩小,考虑异常灌注可能;纵膈多发小淋巴结、心尖前缘和膈肌间隙稍肿大淋巴结,均大致同前,与肿瘤无关;心包少量积液显示已吸收。2023年2月17日,骨髓涂片、流式细胞学、活检均未见肿瘤细胞。患儿持续处于CR状态。
本病例为初治M期高危神经母细胞瘤患儿,伴骨髓、左肾、肝门、肠系膜淋巴结等部位多发转移。患儿经过COG高危组方案诱导化疗、手术及ASCT巩固治疗后达到CR,且符合达妥昔单抗β的适应症 。国际III期多中心大型临床研究显示,达妥昔单抗β治疗高危神经母细胞瘤5年无事件生存(EFS)率达57%,5年总生存(OS)率达64%,其中CR患者3年EFS率达64%,显著高于VGPR、PR患者,提示该部分患者治愈率更高,预后更好。根据《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识》,选用方案二即达妥昔单抗β+GM-CSF+异维甲酸进行免疫治疗。免疫治疗期间未出现严重不良反应,免疫治疗第3周期前和结疗后3个月复查仍维持CR状态。本文由深圳市儿童医院血液肿瘤科的袁秀丽主任担任点评专家,文章以非商业研究及教育为目的,不用作商业用途,欢迎阅读、分享!
神经母细胞瘤是儿童时期最常见的恶性颅外实体肿瘤,占所有儿童恶性实体肿瘤的8-10%,占儿童肿瘤相关死亡率的10-15%,被称为儿童肿瘤之王。初发患者中高危神经母细胞瘤占比大于50%,预后差,5年OS率<50%,迫切需要规范化的诊断及治疗。该病例应用国际上先进的INRGSS分期系统进行危险度分期,应用标准的COG高危化疗方案进行规范化的治疗,结合了化疗、手术、自体造血干细胞移植、放疗、GD2单抗免疫治疗等多种综合治疗手段,并根据患儿自身情况调整化疗方案,给予白消安+美法仑的单移植策略,患儿达到了非常好的治疗效果,处于CR状态。























